Contribuciones originales
Carlos Alberto Cañas Dávila*
* Internista Reumatólogo, Fundación Valle del Lili Cali
Resumen
El hueso es un tejido vivo, muy activo. Cumple tres funciones principales: de soporte para el sistema musculoesquelético: de protección para órganos vitales (cerebro, corazón, pulmones) y como reserva metabólica en la hematopoyesis y en la homeostasis del calcio.
Existen dos compartimientos y dos tipos de hueso: Axial, constituido principalmente por la columna y las vértebras, en donde el hueso es de tipo trabecular, y Apendicular, correspondiente a los huesos largos y con hueso de tipo cortical.
El hueso es un tejido conectivo mineralizado, compuesto por una parte no celular o material osteoide, la cual tiene dos fases (proteica y mineral) y otra parte celular (osteoblastos y osteoclastos). El tejido óseo está en proceso permanente de recambio, sin modificar su integridad anatómica y estructural.
El recambio no se realiza simultáneamente en toda la superficie ósea sino únicamente en áreas predeterminadas, llamadas Unidades de Remodelamiento Oseo. El proceso de recambio óseo tiene varias etapas: activación, resorción, reversión, y formación.
El concepto actual de “calidad ósea” se basa en conocimientos sobre la regulación mecánica de la eficiencia estructural ósea y las distintas maneras como se perturba su acción: hereditarias, mecánicas y endocrino-metabólicas. Se analizan los factores condicionantes para el aumento del recambio óseo durante la menopausia y las intervenciones para la prevención primaria de la enfermedad.
Palabras clave: Estructura ósea, recambio óseo, osteoblasto, osteoclasto, unidad de remodelamiento óseo, calidad ósea, osteoporosis postmenopáusica.
Abstract
Bone is a very active living tissue. Its principal functions are: support for the musculoskeletal system, protection for vital organs (brain, heart, lung) and metabolic reserve for hematopoiesis and calcium homeostasis. Bone is divided in two compartments and two types of tissue: Axial, mostly related to the spine and vertebrae, where bone is mostly trabecular, and Appendicular, related to the long bones of the extremities, mostly with cortical bone.
Is a mineralized connective tissue with a noncellular portion which has two phases (proteiform and mineral) and a cellular phase (osteoblasts and osteoclasts). Bone tissue is in permanent remodeling process, with no modification of its anatomical or structural integrity. Bone remodeling does not simultaneously take place along the entire surface but specifically at predetermined areas called Bone Remodeling Units.
The process has several phases: activation, resorption, reversion and formation. The current concept of “bone quality” is based on the knowledge about the mechanical regulation of bone structural efficiency and different ways of how its action is disturbed: hereditary, mechanical or endocrin-metabolic. Conditioning factors for increased bone remodeling after menopause and primary prevention interventions are presented.
Key words: Bone structure, bone remodeling, osteoblast, osteoclast, Bone Remodeling Unit, bone quality, postmenopausal osteoporosis.
1. Introducción
El hueso tiene tres funciones principales: mecánica o de sostén, la cual permite la inserción muscular y, por ende la locomoción; de protección de órganos vitales como el cerebro, corazón o pulmones, al igual que la médula ósea, y de tipo metabólica la cual permite la homeostasis de diferentes iones principalmente calcio y fósforo1 (Fig. 1).

Figura 1. Funciones principales del Hueso
El hueso es un tejido muy activo, el cual permanentemente está eliminando tejido viejo (actividad resortiva o de remodelado) y formando tejido nuevo (actividad formativa o de modelado). El conjunto de estas actividades se conoce como recambio óseo y debe realizarse en una forma balanceada, de tal manera que a pesar de esta gran actividad metabólica, el hueso permanece con su integridad anatómica y estructural1.
El desacople del recambio óseo determina patologías óseas relacionadas con la función de soporte o de sostén. Si el balance es negativo determina una osteopatía fragilizante, como es la osteoporosis.
Calidad Ósea
La función de soporte del hueso es efectiva en el sentido de mantener una buena calidad ósea. Esta es la consecuencia de diversos procesos que se inician con la percepción por parte de un sistema sensor de estímulos mecánicos (gravedad, actividad física), el cual en últimas, genera señales a las células que participan en el recambio óseo, con el fin de modificar en diferentes sentidos la síntesis del material óseo y su distribución espacial (arquitectura del hueso).
Para entender el funcionamiento normal del recambio óseo en lo que se refiere a la función de sostén y las enfermedades que se derivan de las alteraciones de estos mecanismos, es importante conocer la composición del hueso normal, las células involucradas en el recambio óseo, las fases de este recambio, el concepto de calidad ósea, las funciones del mecanostato, las situaciones que determinan su mal funcionamiento y el posible enfoque fisiopatológico.
2. Composición del hueso normal
El hueso es un tejido conectivo mineralizado, compuesto por una parte no celular (material osteoide), la cual a su vez presenta dos fases (proteica y mineral), y otra celular.
2.1. Componentes no celulares
2.1.1. La fase proteica está compuesta principalmente por colágeno (70% del peso seco) y el 95% de las proteínas. El colágeno es predominantemente tipo 1, el cual consiste en tres cadenas de polipéptidos dos a1 y una a2, que conforman estructura en helix.
La secuencia de cada cadena contiene glicina-X-Y en trímeros repetidos, donde X y Y son otros aminoácidos (los más comunes son la prolina y la hidroxiprolina). Las hélices son unidas por piridinolina y por deoxipiridinolina, las cuales son liberadas en el proceso de resorción. Las fibras de colágeno son la matriz para el depósito del mineral2.
Las otras proteínas no colágenas son la osteocalcina, de importancia en la formación de hueso nuevo, siendo su formación dependiente de las Vitaminas K y D, constituida por tres residuos gammacarboxiglutámicos las cuales le confieren afinidad por el calcio y capacidad reguladora durante la mineralización, es sintetizada por el osteoblasto, siendo sus niveles séricos un indicador de la actividad de estas células (actividad osteoblástica); y por el osteocito, al ser sometido a fuerzas mecánicas que estimulan la remodelación ósea.
La osteonectina, actúa como un complejo con la fosfatasa ácida que une colágeno, calcio e hidroxiapatita.
Las sialoglicoproteínas afectan la tasa de formación y el tamaño final de las fibras de colágeno. También participan factores de crecimiento, cuya acción se ejerce a nivel local2.
2.1.2. La fase mineral consiste en hidroxiapatita: Ca10(PO4)6(OH)2
2.2. Componentes celulares del hueso
2.2.1. Osteoblastos
Los osteoblastos son las células osteoformadoras al generar depósito activo de material osteoide. Se disponen en forma de capa epitelioide en la superficie ósea. Estas células tienen estructura poligonal y aplanada con múltiples prolongaciones en forma de huso. El núcleo se ubica en el lugar más alejado de la superficie ósea. El citoplasma es basófilo y contiene abundantes cuerpos de Golgi, vacuolas citoplasmáticas con precursores de matriz ósea y abundante retículo endoplásmico rugoso, lo cual la capacita para su gran actividad de síntesis proteica3.
Los osteoblastos sintetizan la mayoría de las proteínas encontradas en el hueso: colágeno tipo I, osteocalcina, osteonectina, osteopontina, proteoglicanos y proteínas morfogénicas del hueso. Además sintetiza fosfatasa alcalina y receptores de superficie para vitaminas, hormonas y citoquinas3. La osteopontina y la osteonectina se encargan de la adhesión celular.
Los osteoblastos tienen progenitores mesenquimatosos los cuales se diferencian en “unidades formadoras de colonias de fibroblastos” (CFU-F). La diferenciación se lleva a cabo en un microambiente especial donde participan diversas hormonas, factores de crecimiento y citoquinas. Por ejemplo, el factor de crecimiento transformante beta (TGF- b), estimula la quimiotaxis de precursores de osteoblasto y el factor de crecimiento de fibroblastos (FGF), activa el osteoblasto para formación de hueso.4
Las CFU-F tienen características histopatológicas de “formadoras de hueso”, es decir son “fosfatasa alcalina positivas”, productoras de colágeno I e incluso formadoras de nódulos calcificados en medios adecuados 4. Bajo el efecto de diferentes estímulos mediados por la interleuquina-6 (IL-6), la IL-11, el factor estimulante de colonias de granulocitos y macrófagos (GM-CSF), el factor estimulante de colonias de macrófagos (M-CSF) y la oncostatina M, se va diferenciando hasta llegar al osteoblasto maduro5.
El osteoblasto interviene en la mineralización, al generar materiales y el ambiente propicio para la precipitación de sales de fosfato de calcio.
Este fenómeno se lleva a cabo por varios mecanismos1,3:
1. Formación de vesículas de secreción rodeadas por membranas, en cuyo interior existe un microambiente propicio para la precipitación de las sales descritas;
2. Generación de estructuras “huecas”, los cuales quedan después del ensamblaje longitudinal de las cadenas de colágeno tipo 1, las cuales son sitios para el proceso de nucleación (fase inicial del depósito de las sales),
3. Presencia de actividad de fosfatasa alcalina, la cual hidroliza e inactiva el pirofosfato, un potente inhibidor de la mineralización, además de ayudar a proveer el fosfato inorgánico en la reacción de mineralización,
4. Presencia de algunas proteínas morfogénicas óseas (BPM), las cuales ejercen su acción en osteoblastos a través de receptores que median efectos de hipertrofia e hiperplasia6. Algunas de estas proteínas tienen secuencias de aminoácidos de la superfamilia del TGF-b. La función de la BMP-1 está relacionada con las interacciones proteína-proteína y de la unión del calcio con la matriz osteoide6.
osteocito
En la medida que el hueso se mineraliza el osteoblasto deja de tener actividad de síntesis de material osteoide y se convierte en osteocito el cual va quedando incluido en el hueso rígido y empieza a tener funciones de receptor de fuerzas externas principalmente determinadas por la actividad muscular.
Los osteoblastos juegan también un papel fundamental en la resorción ósea, dado que ésta se inicia gracias a la recepción de un mensaje a través de estímulos como el estrés mecánico o de moléculas como la hormona paratiroidea (PTH), la vitamina D, el factor de necrosis tumoral alfa (TNF-a), las cuales estimulan dichas células para sintetizar la IL- 1b y la IL-6, además de prostaglandinas, capaces de activar los osteoclastos.
Los osteoblastos expresan también moléculas de adhesión: ICAM-1, V-CAM-1, LFA-3, miembros de la superfamilia de las inmunoglobulinas. Las células T tienen capacidad de adherirse a los osteoblastos, ya que poseen los ligandos de dichas moléculas de adhesión: LFA-1, VLA-4 y el CD2, respectivamente7. La función de esta adhesión es la generación de señales de activación las cuales facilitan la producción de citoquinas, como la IL-1 y el TNF-a, en el contexto de procesos inflamatorios.
Estas citoquinas a su vez pueden activar los osteoclastos, siendo esta una de las vías para la generación de osteopenia yuxtaarticular en procesos inflamatorios articulares como el que se presenta en artritis reumatoidea8. Algunos investigadores sugieren la presencia de citoquinas provenientes del sistema inmune, como factor coadyuvante en desarrollo de la osteoporosis postmenopáusica7.
2.2.2. Osteoclastos
Los osteoclastos son células que llevan a cabo la resorción de hueso viejo, a través de una activa digestión proteolítica. Son células grandes multinucleadas, parecidas a los macrófagos, cuyos precursores son macrófagos mononucleares (monocitos), los cuales son liberados a la sangre y captados en sitios de resorción ósea, fusionándose con otros y formando el osteoclasto.
Esta célula en plena actividad forma túneles profundos en la superficie del hueso compacto, generando cavidades que son invadidas posteriormente por otras células endoteliales. Estos túneles se extienden a razón de 50 mm. por día9.
La acción del osteoclasto sobre el hueso se ejerce al crear un ambiente ácido y al excretar enzimas proteolíticas, además de tener actividad de fagocito sobre los detritos de la matriz ósea degradada. La acidificación de la zona en contacto con el hueso se debe a la acción de hidrogeniones, en forma similar como actúan los túbulos renales y las células parietales del estómago, donde intervienen bombas de protones y la acción de la anhidrasa carbónica1.
En el espacio extracelular se forman lisosomas secundarios donde se liberan enzimas proteolíticas como la colagenasa.
Luego de cumplir sus funciones el osteoclasto entra en apoptosis, por acción de diversas hormonas y citoquinas.
Los osteoblastos tienen progenitores mesenquimatosos los cuales son llamados “unidades de formación de colonias de granulocitos y macrófagos” (CFU-GM). La diferenciación se lleva a cabo en un microambiente especial donde participan diversas hormonas, factores de crecimiento y citoquinas.
Las CFU-GM evolucionan a monocito:
Macrófago y posteriormente a osteoclasto por la participación de IL-1, IL-3, IL-11, TNF-a, GM-CSF, M-CSF y el factor inhibitorio leucémico (LIF)10. Existe sinergismo entre la IL-3 y la IL-6 para la formación de precursores de osteoclastos y el incremento de la síntesis de GM-CSF. La presencia simultánea de un aumento de la IL-6 y la IL-1 lleva a una activación osteoclástica ex vivo, en cocultivo con osteoblastos10. Es evidente la interacción permanente osteoblasto-osteoclasto.
Además, la PTH induce la liberación de factores solubles estimulantes de la diferenciación osteoclástica como son el MSF, el GMSF y la IL-11, aumentando el número de precursores osteoclásticos1. Sin embargo, la PTH puede inducir la formación de hueso cuando se administra en forma intermitente a través de la liberación de factor de crecimiento similar a la insulina tipo 1 (IGF-1) y el TGF-b1.
Como ya se había comentado la IL-6 es producida en respuesta a la PTH, vitamina D, la IL-1, y el TNF-a. El osteoblasto participa en la activación y reclutamiento de los osteoclastos, además de las células precursoras y estromales.
Los osteoclastos están desprovistos de receptores para Fc y complemento a diferencia de otros fagocitos mononucleares que si los poseen. Tienen receptores para calcitonina y estrógenos, pero no para PTH o Vitamina D31. La calcitonina es un potente inhibidor de su acción aunque su efecto es transitorio quizá por mecanismo de regulación baja que se ejerce sobre el mRNA. La calcitonina produce contracción de la membrana celular, disolución de osteoclasto maduro en células mononuclear, además de inhibir la diferenciación de precursores1.
En los precursores de osteoclasto y en los osteoclastos:
También se expresa el receptor activador del factor nuclear kB (RANK), el cual, si es estimulado por su ligando, induce la diferenciación y activación de estas células8. Estas reacciones son de importancia para entender la relación entre enfermedad inflamatoria y
3. El recambio óseo y sus fases

Figura 3. Fases del remodelado óseo
Como se ha comentado, normalmente el hueso está en un recambio continuo, sin modificar su integridad anatómica y estructural. El recambio óseo se efectúa con el fin de remodelar el hueso para reparar microdaños y adaptar la microarquitectura según los cambios de fuerzas biomecánicas.
Se calcula que en un adulto el 25% de hueso trabecular y 3% del cortical es reemplazado cada año. Esta diferencia se debe a que el hueso trabecular tiene una alta relación superficie / volumen, así el 75% de la superficie del hueso está en contacto con médula ósea y esto facilita la acción osteoclástica5.
La primera fase del recambio óseo o de activación es un fenómeno que se lleva a cabo en las llamadas unidades básicas multicelulares (UBC). Previamente hay un reclutamiento en las UBC de precursores osteoclásticos de las líneas de los fagocitos mononucleares. Posteriormente empieza la diferenciación al unirse varias de estas células generándose una nueva grande y multinucleada, la cual por diversos estímulos continúa con un proceso de activación y de generación de un borde en cepillo en la membrana celular adyacente a la matriz ósea 7.
En la diferenciación de precursores participan:
– PTH
– Vitamina D3
– RANKL/ODF
– Prostaglandina E2
– IL-11
– TNF-alfa
– IL-1
En la activación participan:
– RANKL/ODF
– IL-11
– IL-15
– IL-17
– IL-1
– TNF-alfa
– MGSF
– LIF
– IL-6
También puede haber un estímulo negativo o de inhibición de la osteoclastogénesis, la cual puede ser dada por la IL-4, la IL-13, interferón-gamma (INF-g), y la IL-185,10.
Después del reclutamiento, la diferenciación y la activación del osteoclasto, empieza la segunda fase o de resorción. En el hueso cortical se genera un defecto en forma de túnel y en el hueso trabecular en forma de laguna (laguna de Howship).
Existe luego una fase de aparente inactividad o fase de reversión, la cual termina al iniciarse la activación osteoblástica, denominada fase de formación. Los osteoblastos que se encuentran en la superficie ósea se transforman en células de revestimiento y los que están dentro de la matriz en osteocitos.
ÇPara que este proceso de remodelado mantenga la masa ósea pico se requiere de un proceso de sincronización y coordinación entre el osteoblasto y el osteoclasto, denominado “fenómeno de acoplamiento” o de “balance óseo”11. En condición de normalidad su valor es cero hasta la tercera o cuarta década de la vida, y partir de allí hay un ligero balance negativo en cada unidad (3%), que explica la pérdida fisiológica de masa ósea.
El volumen de hueso renovado en la unidad de tiempo es el “recambio”, y este se encuentra determinado por la intensidad de activación de los osteoclastos y osteoblastos de cada unidad de remodelación ósea. Este recambio es el principal factor determinante para el capital óseo de la masa pico.
El recambio óseo se realiza principalmente en Área:
– Subperiostica
– Endohaversiana
– Subcortical
– Envoltura trabecular
4. Calidad Ósea
Con los conocimientos actuales que se tienen sobre la microarquitectura del hueso y su importancia en la resistencia a la deformación, el concepto de masa ósea es un evento secundario, dado que se le empieza a dar más importancia a la forma como el hueso a través de diversos estímulos ha condicionado su estructura para ser más eficiente.
La modificación del trabeculado óseo aumenta la capacidad de resistir mejor a las fuerzas mecánicas que se le imponen. Esto en contraposición a generar un aumento de la masa o del peso del hueso. Ha sido éste un mecanismo muy eficiente adoptado por la evolución de los animales12.
Los estudios de Ferrati sobre el mecanostato óseo han llevado a comprender mejor la regulación mecánica de la eficiencia estructural ósea, las distintas formas como se perturba su acción y las derivaciones clínico terapéuticas de esta forma de interpretar la biología ósea a partir del concepto de calidad ósea.
En resumen, podemos decir que la causa principal de la fractura de cualquier estructura sólida es su deformación. La resistencia a esta deformación en el caso del hueso se denomina rigidez ósea. Esta rigidez depende de la calidad del material (rigidez intrínseca) y su distribución espacial o diseño macroarquitectónico. Tratándose de hueso debemos referirnos a las matrices orgánica y mineral, al igual que se distribución o tramado.
5. Mecanostato Óseo
El diseño arquitectónico que va adoptando el hueso a través del tiempo depende de las cargas que se le imponen. El sensor de estas cargas parece ser el osteocito con sus prolongaciones e interconexiones intercelulares ubicadas dentro de la matriz ósea. La intensidad de los estímulos es interpretada por los osteoblastos y osteoclastos, que a través de su función coordinada de recambio óseo constante permite generar más o menos rigidez al final del proceso.
Se presenta readecuación estructural, cambiando la orientación de las trabéculas, el grosor de las mismas, o la reubicación del material óseo, por ejemplo localizándolo más hacia la periferia si se requiere una mayor resistencia 12. Todo este mecanismo de recepción y respuesta se conoce como mecanostato óseo.
Los osteocitos son las células más abundantes del hueso, y como se dijo, están embebidas en la matriz ósea mineralizada y están interconectadas entre sí y con los osteoblastos mediante prolongaciones celulares, ubicadas dentro de canalículos que a su vez son ricos en un líquido llamado fluido periosteocítico, cuya composición es similar al plasma. Todo este complejo se llama “complejo lacunado canalicular”.
El mecanismo por el cual el osteocito sensa la presencia de torsión ósea, parece ser por cambios piezoeléctricos, que modifican la actividad eléctrica de la célula y sus prolongaciones, quizás en paralelo con fenómeno similar en el fluido periosteocítico13. Existen teorías que plantean el fluido solo es el que cumple el papel receptor, generándose impulsos eléctricos por salto de electrones en la periferia14.
También se postulan los movimientos de la albúmina a través de espacios interfibrilares. Finalmente se generan cambios de potenciales en la membrana osteoblástica con el consecuente flujo iónico, especialmente mediante canales de calcio13.
Ante efectos de tensión mecánica, las estructuras del citoesqueleto del osteoblasto también presentan modificaciones que ayudan a su adhesión a la matriz extracelular.
Se presenta un incremento en la síntesis de: fibronectina (importante en la adherencia a la matriz extracelular), que va aumentando en relación con el tiempo, actina, vinculina (como componente intracelular del andamiaje molecular que lo une con otras células, asociándose a las cadherinas que tienen componentes transmembrana) y una disminución en la osteopontina, sin afectar las Beta-1 integrinas ni las vinectinas (filamentos intermedios)15.
Otras células que pueden tener importancia en estas funciones son las células de revestimiento, las cuales pueden sintetizar prostaglandinas, ÓXIDO NITRICO, y otras sustancias para permitir el equilibrio del medio ambiente óseo. Interactúan con moléculas de adhesión, se comunican entre sí y con los osteocitos16.
También participan en la integración del mecanostato óseo, diversos neuropéptidos, cuyos mecanismos de acción son motivo de investigación. Se sabe por ejemplo que el péptido relacionado con el gen de la calcitonina (CGRP) y el péptido vasoactivo intestinal (VIP), inhiben la resorción ósea17.
Entendiendo estos mecanismos puede entenderse que la osteopenia y el aumento de la fragilidad ósea no necesariamente están asociados.
El ejercicio físico moderado e intenso incrementa la masa y la calidad óseas, pero su rendimiento disminuye con la edad por el deterioro de las células sensoras o efectoras del mecanostato. Los casos extremos de inmovilidad o de ingravidez hace que se pierda hasta la mitad de la masa ósea en pocas semanas12.
6. Alteraciones del Mecanostato Óseo
6.1. Perturbaciones hereditarias, mecánicas y endocrinometabólicas del mecanostato
Existen defectos hereditarios del mecanostato: osteogenesis imperfecta, displasias óseas, osteoesclerosis
En cuanto a las perturbaciones mecánicas, debe tenerse en cuenta la inmovilidad y el estado de falta de gravedad. Desde el punto endocrinometabólico, el mecanostato es obligado a trabajar para corregir anomalías del calcio, la PTH y la vitamina D, las cuales son reacciones de tipo anabólico igual que los efectoscatabólicos derivados de la ooforectomía o de restricciones en el aporte de calcio, fósforo, proteínas, etc., antianabólicos de los glucocorticoides, y anticatabólicos de los estrógenos, calcitonina o medicamentos como los bifosfonatos.
6.2. Clasificación de los cambios óseos a la luz de la calidad y la densidad óseas.
Estos conceptos nos llevan a un posible enfoque densitométrico de los individuos en términos de su calidad ósea y postular una posible clasificación de los pacientes así DMO:
- Normal-calidad ósea normal: Sujeto normal
- Reducida-calidad ósea normal: Osteopenia simple
- Normal-calidad ósea reducida: Osteopatía fragilizante no osteopénica.
- Reducida-calidad ósea reducida: Osteopatía fragilizante osteopénica
Estos conceptos hacen cuestionar la definición de osteoporosis como “reducción de la masa ósea y alteración microestructural que conlleva a riesgo de fractura aumentado”, quedaría encuadrado sólo en la cuarta forma de clasificación12.
7. Factores determinantes para el desarrollo de la osteoporosis postmenopáusica
Durante el desarrollo de la osteoporosis postmenopáusica hay un aumento del remodelado óseo, es decir, un incremento tanto de la actividad resortiva como de formación y además un imbalance, ya sea aumentándose la resorción o disminuyéndose la formación.
En la osteoporosis postmenopáusica existe un fenómeno similar a la osteoporosis secundaria a la ooforectomía.
Las evidencias de estos fenómenos se han reproducido en modelos animales. Por ejemplo la ooforectomía en ratas se asocia con un incremento en los marcadores de resorción y formación, con exceso de los primeros. Este resultado de tipo catabólico se debe a un aumento de los niveles séricos y locales de IL-6, los cuales alteran el hueso en forma independiente al mecanostato, el cual es ignorado en su acción de mantenimiento de función de sostén del hueso10.
Las evidencias de la participación de la IL-6 en el desarrollo de la osteoporosis postmenopáusica se dan en la conclusión de diferentes trabajos de investigación18:
- La ooforectomía aumenta la pérdida de masa ósea,
- Esta pérdida ósea se previene con la administración de estrógenos o anticuerpos bloqueadores de IL-6,
- La producción de IL-6 en cultivos de médula ósea es inhibida por estrógenos (Efecto inhibitorio a nivel de transcripción del gen-222 bp del promotor),
- La IL-6 aumenta los marcadores de resorción ósea in vivo,
5. la IL-6 aumenta con la aplicación de la PTH, asociándose a un incremento en la resorción ósea, y - Los niveles de IL-6 aumentan en médula ósea después de la menopausia.
El incremento de la IL-6 en la menopausia humana o en ratas ooforectomizadas explica el aumento de la actividad osteoclástica:
Pero no el de la osteoblástica (también se comentó cómo en la osteoporosis hay aumento tanto de la actividad formadora como resortiva de hueso).
En dichos modelos animales se aprecia un aumento de las CFU-F y CFU-GM cuya causa no es clara. Se implican el LIF y la oncostatina M. Estas citoquinas biológicamente tienen funciones similares, y junto a la IL-6, la IL-11 y la cardiotropina-1 comparten receptores (Gp130) y señales intracelulares parecidas19.
Se conoce además que la deprivación estrogénica induce apoptosis de los osteocitos.
Tanto en la osteoporosis postmenopáusica como en la relacionada con el envejecimiento existen otros factores que perturban la acción del mecanostato óseo:
- Factores genéticos (étnicos, familiares), implicándose mutaciones en los genes de la Vitamina D, PTH, colágeno tipo 1 y posiblemente del receptor de los estrógenos.
- Factores nutricionales: falta de aporte adecuado del calcio;
- Alteraciones del metabolismo de la vitamina D cuyas acciones principales son aumentar la absorción del calcio y la síntesis de osteocalcina, proteína morfogénica del hueso.
- Esta hormona disminuye con la edad, situación que puede deberse a una disminución en la exposición solar y/o a un descenso de la alfa-hidroxilación de la 25 hidroxi-vitamina D. También la respuesta intestinal a ésta hormona se encuentra disminuida en ancianos20.
- La desnutrición proteica en ancianos predispone a caídas y por ende a las fracturas, expresión clínica de la osteoporosis. La desnutrición proteica, además, está asociada con la disminución de la masa muscular. Se ha hecho una correlación positiva entre la masa muscular y la densidad mineral ósea21.
- El sedentarismo es un determinante importante de osteoporosis, dado que el mecanostato sensa una pobre actividad muscular, por lo tanto sus señales a las células de remodelado son de carácter inhibitorio generándose una estructura ósea más frágil, dadas las necesidades limitadas que el huésped ha impuesto. La disminución de la masa muscular está en proporción directa a la disminución de la calidad ósea21.
- El uso de corticoides, el tabaquismo, el consumo excesivo de café y alcohol, al igual que el consumo de diversos medicamentos como anticonvulsivantes u hormona tiroidea, tienen efectos perturbadores sobre el mecanostato por mecanismos diversos22-24.
- Las enfermedades crónicas debilitantes, por diversos factores catabólicos sobre masa muscular e inmovilidad.
8. Cambios determinantes en la osteoporosis asociada a enfermedad inflamatoria articular (eslabón entre el sistema inmune y el hueso)
Los mecanismos que relacionan ciertas enfermedades inflamatorias como la artritis reumatoidea y el aumento de la resorción ósea, son motivos de activa investigación en el momento. Puede decirse que es el eslabón entre el sistema inmune y el hueso, en la generación de osteopenia y osteoporosis.
La activación de los linfocitos T conlleva a la expresión en su membrana celular del RANKL (molécula de la familia del TNF-a), la cual tiene dos regiones, una unida a la membrana con un segmento transmembrana y un tallo citoplasmático, y otra secretada que puede desprenderse por acción de la enzima convertidora del TNF-a (TACE). Así, puede decirse que existen dos formas de la RANKL: una celular y otra soluble.
Esta última una vez en el espacio extracelular puede ir a unirse a su receptor (RANK) en la membrana de los precursores de osteoclastos y de osteoclastos, para su diferenciación y estimulación. Un mecanismo de control del RANKL, es su unión al receptor soluble llamado osteoprotegerina (OPG) para su posterior eliminación. Este conocimiento tendrá implicaciones muy importantes en el entendimiento de la osteoporosis asociada a artritis reumatoidea y su posible terapéutica8 (Fig. 4).
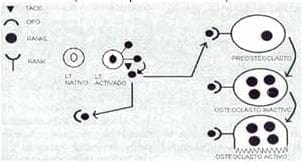
Figura 4. Mecanismo de relación de sistema inmune y remodelado óseo.
(Ver decripción en el texto)
Como antes se mencionó, otro factor implicado en el aumento de la actividad osteoclástica en la artritis reumatoidea se presenta a través del incremento de la síntesis de IL-1 b e IL-6 a partir del osteoblasto, como consecuencia de señales intracelulares derivadas de su adhesión con los linfocitos T y la participación de varias moléculas de adhesión y sus ligandos.
Referencias
- 1. Hahn B H. Osteopenic bone disease. En Koopman WJ, editor. Arthritis and allied conditions. A textbook of Rheumatology 13th Edition. Baltimore: Williams & Wilkins; 1997; 2203-2231.
- 2. Rubin CT, Slege CB. Biology, physiology and morphology of bone. En Sledge CB, Ruddy S, Harris ED Jr. Kelley WN, eds. Arthritis surgery. Philadelphia: WB Saunders; 1994; 71-93.
- 3. Garavito XA, Pinzón F, Ardila E. El osteoblasto. Boletín ACOMM. Enero 2000; 9-12.
- 4. Benayahu D, Fried A, Zipori D, Wientroub S. Subpopulations of marrow stromal cell share a variety of osteoblastic markers. Calcif Tissue Int 1991; 49: 202-207.
- 5. Manolagos SC, Jilka RL. Bone marrow, cytokines and bone remodeling. N Engl J Med 1995; 332: 305-310.
- 6. Mohan S, Baylink DJ. Bone growth factors. Clin Orthop Relat Res 1991; 236: 433-446.
- 7. Tanaka Y, Morimoto. Osteoblast are regulated by the cellular adhesión through ICAM-1 and VCAM-1 . J Bone Min Res 1995;10: 1462-1468.
- 8. Hofbauer LC, Heufelder AE. The role of osteoprotegerin and receptor activator of nuclear factorKB ligand in the patogenesis and treatment of rheumatoid arthritis. Arthritis Rheum 2001; 44: 253-259.
- 9. Alberts B, Bray D, Lewis J, Raff M, Roberts K, Watson JD. Differentiated cells and the maintenance of tissues. En Alberts B, Bray D, Lewis J, Raff M, Roberts K, Watson JD, eds Molecular biology of the cell Third Edition. NY: Garland Publishing; 1994; 1139-1193.
- 10. Cañas CA, Iglesias A. Fisiopatología de la osteoporosis. En Ardila E, Mautalen CA. eds. Osteoporosis en Iberoamérica. Santafé de Bogotá:Vesalius; 2000; 23-34.
- 11. Notelovitz M. La fisiología del hueso En Osteoporosis: prevención, diagnóstico y manejo. Tercera Edición. Santafé de Bogotá: D´Vinni Editorial Ltda.; 1999; 17-40.
Bibliografía
- 12. Ferreti JL. Biomecánica ósea. En Ardila E, Mautalen CA. eds. Osteoporosis en Iberoamérica. Santafé de Bogotá:Vesalius; 2000; 47-64.
- 13. Rueda PN, Zamudio A. El osteocito, mecanotransducción y calidad ósea. Boletín ACOMM Junio 2000; 6-8.
- 14. Weinbaum S. 1997 Whitaker distinguished lecture: models to solve mysteries in biomechanics at the cellular level; a new view of fiber matrix layers. Ann Biol Eng 1998; 26: 627-643.
- 15. Meazzini MC, Toma CD, Schaffer JL, Gray ML, Gerstenfeld LC. Osteoblast cytoskeletal modulation in response to mechanical strain in vitro. J Orth Res 1998; 16: 170-180.
- 16. Kawata A, Mikuni-Takagaki Y. Mechanotransduction in stretched osteocytes _ temporal expression of immediate early and other genes. Bioch Biophys Res Comm 1998; 246: 404-408.
- 17. Konttinen YT, Imai S, Suda A. Neuropeptides and the puzzle of bone remodeling. Acta Orthop Scand 1996; 67: 632-639.
- 18. Mundy GR. Editorial. An OAF by any other name. Endocrinology 1996; 137: 1149-1150.
- 19. Jay PR, Centrella M, Lorenzo J, Bruce AG, Horowitz MC. Oncostatin-M. A new bone active cytokine that activates osteoblasts and inhibits bone resorption. Endocrinology 1996; 137: 1151-1158.
- 20. Bouxein ML, Marcus R. Overview of exercise and bone mass. Rheum Dis Clin North Am 1994; 20: 787-802.
21. Kanis JA, Melton LS III, Chistiansen C, Johnston C, Khaltaev N. The diagnosis of osteoporosis. J Bone Min Research 1994; 9: 1137-1147. - 22. Iglesias-Gamarra A., Vásquez L, La Madrid J. Eds. Enfermedades metabólicas del hueso. Vol. II Bogotá: INS 1992; 375-445.
Fuentes
- 23. Harris S, Dawson-Hugues. Caffeine and bone loss in healthy postmenopausal women. Am J Clin Nutr 1994; 60: 573-578.
- 24. Cauley JA, Gutai SP, Kuller LH, et al. Black-white differences in serum sex hormones and bone mineral density. Am J Epidemiol 1982; 116: 141-148.