Miguel Bueno, Libardo Bravo, Alvaro Cuadros, William Cárdenas, Carmenza E. de Romero, Clara Torres, Arlex Echeverry, Martha Cifuentes, Gustavo Gómez**
*Grupo de estudio sobre menopausia, Clínica de Menopausia, CMI Auspiciada y financiado por Laboratorios Schering Colombiana S.A. **Correspondencia gusgomez@mafalda.univalle.edu.co
Resumen
La enfermedad de Alzheimer (E.A.) es la forma más común de demencia . Demencia es un nombre genérico para síndromes degenerativos progresivos del cerebro, los cuales afectan la memoria, la ideación, el comportamiento y las emociones.
Los síntomas pueden incluir: pérdida de la memoria, dificultad para encontrar las palabras adecuadas o comprender las que otras personas están diciendo, dificultad para realizar funciones previamente rutinarias y cambios de personalidad y del estado de ÁNIMO.
La demencia no es parte normal del enevejecimiento. No tiene límites sociales, económicos, étnicos ni geográficos. Cada persona puede experimentar la demencia de una manera particular, pero eventualmente pueden no tener control de sí mismos y necesitan ayuda para todos sus actos de la vida diaria. Existen diversas enfermedades las cuales pueden causar síntomas de demencia como resultado de los cambios que ellos tienen en su cerebro y la pérdida final de las neuronas.
Aún no se conoce por qué algunas personas desarrollan demencia, pero existen múltiples factores de riesgo para el desarrollo de EA. Ellos incluyen: edad, genes, educación, alcohol y trauma cráneo encefálico.
El diagnóstico de EA, por ahora, se hace sólo con base en los hallazgos de autopsia. Recientemente se han logrado establecer criterios de diagnóstico mediante técnicas especiales con resonancia magnética nuclear. No existe cura farmacológica para la EA. Actualmente se estudian nuevas drogas para la mejoría de algunos síntomas de la enfermedad. Todas presentan efectos adversos los cuales limitan su uso. Se plantea la conveniencia del uso de los estrógenos y posiblemente de los andrógenos para la mejoría de los síntomas de EA.
Palabras clave: Enfermedad de Alzheimer, demencia, factores de riesgo, estrógenos, andrógenos.
Abstract
Alzheimer’s Disease (AD) is the most common form of dementia, Dementia is a generic name for progressive degenerative brain syndromes which affect memory, thinking, behaviour and emotions. Symptoms may include: loss of memory, difficulty in finding the right words or understanding what people are saying, difficulty in performing previosuly routine tasks and personality and mood changes. Dementia is not a normal part of ageing.
It knows no social, economic, ethnic or geographical boundaries. Although each person will experience dementia in their own way, eventually those affected are unable to care for themselves and need help with all aspects of daily life.
There are a number of diseases which cause the symptoms of AD as a result of the changes they have on their brain and the ultimate loss of nerve cells. It is not currently understood why people develop AD but there are many factors which have been suggested to have an effect on the risk of developing AD. Some of these include: age, genes, education, alcohol and head injury.
There is no simple test to diagnose AD and the diagnose can only be confirmed with certainty by examining the brain at post mortem. More recently diagnostic crietria have been established by special techniques of nuclear magnetic resonance. To date, there is no pharmacological cure for AD. Currently, new drugs are being developed for the improvement of symptoms of the disease. They all present adverse effects which limit their use. The use of estrogens and possibly androgens for the treatment of AD is being proposed.
Key words: Alzheimer’s disease, dementia, risk factors, estrogens, androgens.
Introducción
Definiciones
Enfermedad de Alzheimer (E.A.) denominada así en memoria de Alois Alzheimer, neurólogo alemán, quien en 1906 describió los síntomas y los cambios en el tejido cerebral de una mujer fallecida a causa de una enfermedad mental rara.
El cerebro de la paciente presentaba placas y ovillos de fibras nerviosas. En el cerebro de los enfermos con E.A. se encuentran también pérdida de células nerviosas en las áreas del cerebro responsables del proceso de la memoria y de otras funciones mentales y niveles bajos de sustancias químicas encargadas de llevar y traer complejos mensajes entre billones de células nerviosas importantes para el pensamiento y la memoria. Tomada en conjunto, la E.A. es una patología degenerativa del cerebro, la cual afecta la memoria, el área cognitiva y la conducta e interfiere con las actividades habituales diarias.
La E.A. es la forma más frecuente de demencia. Se describen, también, la demencia vascular y la demencia asociada a la enfermedad de Parkinson (20%), a la Enfermedad de los Cuerpos de Lewy, de Huntington, de Creutzfeldt-Jacob y de Pick. Otras enfermedades tales como los tumores cerebrales, el trauma craneano, trastornos metabólicos, disfunción tiroidea, malnutrición, el abuso de drogas, medicamentos y alcohol, también pueden causar confusión, deterioro mental y demencia. Igualmente, la Hidrocefalia con Presión Normal, la depresión y el delirio, pueden asociarse o al menos simular estados de demencia.
Aspectos Epidemiológicos
La E.A. se considera como la epidemia del Siglo XXI, debido al notorio aumento en la prevalencia e incidencia. Esto, debido al aumento de la expectativa de vida de la población en general y de las mujeres en particular. La incidencia hasta los 65 años es de 1:1000, mientras que en los mayores de 65 es de 1:20. El envejecimiento normal no parece ser la causa directa de la enfermedad ya que la mayoría de las personas de 80 y más años no la desarrollan.
En los Estados Unidos de Norteamérica, más de 4.000.000 de personas de edad avanzada sufren de E.A. Se espera que esta cifra se triplique en los próximos veinte años a medida que más mujeres y hombres vivan hasta los 80 y 90 años.1
La E.A. es más frecuente en mujeres que en varones (3:1) y la frecuencia es casi el doble por cada cinco años de avance de la edad.(Gráfica 1).
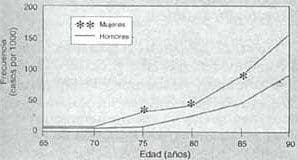
Gráfica 1. Frecuencia de Enfermedad de Alzheimer por sexo y por edad.
Tomada de Jorm, 19872
Factores Predisponentes (supuestos)
1. Edad avanzada
2. Historia familiar de E.A. u otro tipo de demencia (RR > 2)
3. Mutaciones en sitios genéticos específicos, sobre cromosomas (Presenilina 1 gen en el cromosoma 14, presenilina 2 gen en el cromosoma 1 y el gen de la proteína precursora amiloide en el cromosoma 21, causan formas poco comunes de E. A., las cuales se presentan antes de los 60 años).
4. Historia personal o familiar de Síndrome de Down (Trisomía 21)
5. Bajo nivel educacional
6. Género femenino (3:1)
7. Zurdería
8. Trauma Cráneo-encefálico, incluyendo la Demencia Pujilística, en especial si se es mayor de 50 años, portador del Gen E4 alelo de apolipoproteína E y si ha habido pérdida del conocimiento.
9. Depresión previa
10. Exposición a solventes
11. Exposición a aluminio (presente en el agua del grifo, los antitranspirantes, los antiácidos y el té) En este caso se encuentran ovillos neurofibrilares similares, aunque no iguales, a los de E.A.
12. Enfermedad tiroidea
13. Campos electromagnéticos (ocupaciones especiales, amalgamas dentales)
14. Estrés psicológico temprano.
Factores de Protección (supuestos)
a. Drogas anti-inflamatorias.3 La E.A. es rara en pacientes con artritis reumatoidea, consumidores habituales de AINES, los cuales actúan inhibiendo la colinesterasa, precursora de las prostaglandinas y destructora de la acetilcolina.
b. Antioxidantes, los cuales actúan como captadores de radicales libres (Vitaminas E y C, entre otras).
c. Hábito de fumar. La nicotina parece retardar la acción de la colinesterasa, haciendo más duradera la acción de la acetilcolina. Estudios en Europa muestran que el efecto protector, el cual retarda la aparición de la enfermedad por varios años, es válido para fumadores moderados. En los grandes fumadores, el riesgo de padecer la enfermedad es dos veces mayor.
d. Alcohol. Estudios recientes indican que el consumo de 40 gm/día (mujeres) y 80 gm/día (hombres), disminuye la probabilidad de sufrir disfunción cognitiva4
e. Niveles de colesterol. Se ha establecido que los niveles sanguíneos de colesterol modulan la formación de depósitos de péptido beta-amiloide (Abeta), principal constituyente de la placa beta-amiloide. Las estatinas, a su vez, cruzan la barrera hematoencefálica y disminuyen los niveles de colesterol por debajo de un nivel crítico e inhiben el paso amiloidogénico productor de Abeta, quizás por disminución de APP de microdominios de membrana de colesterol y de esfingolípidos.
Además, los niveles bajos de colesterol celular reducen la habilidad de Abeta para actuar como base para la formación de nuevas neurofibrillas.5 Se considera, igualmente, que la acumulación y agregación de Abeta dentro del tejido cerebral es causa probable de EA. En este proceso participan de manera importante algunas enzimas responsables de la homeostasis del colesterol.
Se ha encontrado que modificando los niveles de colesterol se puede influir el metabolismo de Abeta y que el uso de agentes hipolipidémicos, específicamente los inhibidores de la reductasa HMG-CoA, se puede reducir la incidencia de EA.
Es posible que el colesterol influya sobre el metabolismo de Abeta de diversas maneras, por ejemplo, mediante alteración de la producción de Abeta y por cambios en el depódito y eliminación del compuesto.6-7
f. Terapia de Reemplazo Estrogénico (TRE). Sin duda, el tema más debatido. Durante la última década, diversos estudios en animales y en humanos han demostrado un efecto benéfico de los estrógenos sobre la función cognitiva y sobre la memoria. Tal acción se ejerce sobre estructuras como el cerebro basal anterior, el hipocampo, el putamen caudado, el tallo cerebral medio y otros más, relacionados con la memoria y el proceso cognitivo.
Aspectos Genéticos
En los pacientes con E.A. se han encontrado anomalías en genes de los cromosomas 1, 14, 19 y 21. La enfermedad temprana se relaciona con los cromosomas 14 y 21 y la tardía con el cromosoma 19.
El síndrome de Down, relacionado con el cromosoma 21, puede coincidir con la E.A. si los pacientes alcanzan la edad suficiente para desarrollarla. Pueden no presentarse todos los síntomas. El mismo cromosoma 21 ha sido identificado como precursor de la proteína beta-amiloide de las placas neuronales halladas en la E.A. El gen ligado al cromosoma 19 es el responsable de la producción de apoE4, con riesgo aumentado para E.A. (Duplica el riesgo del 1 a 2 por 1000 en mayores de 50 años, pero no todos los portadores la desarrollan).
Aspectos Bioquímicos
Diversas substancias actúan directamente o como mediadoras en el proceso de la función cerebral y tienen por ello importancia en el estudio de la E.A.
a. Acetilcolina: es el Hidróxido de Acetiletanoltrimetilamomio, éster del ácido acético de la colina, aislado de la ergotamina. Su papel como neurotransmisor al nivel de las sinapsis nerviosas es muy importante. Se encuentra disminuida en la E.A.
b. Colinesterasa: pertenece a una familia de enzimas presentes en líquidos y tejidos corporales. Capaz de catalizar la hidrólisis de la Acetilcolina.
c. Proteína Tau. Aislada en 1975 por Weingarten y colaboradores: se caracteriza por inducir la formación de microtúbulos. Diez años después se descubrió que Tau es el componente proteico predominante en los Filamentos Helicoidales Pareados (PH Fs) y en los ovillos Neurofibrilares (NFTs), lesiones patológicas características de la E.A. Posteriormente, se descubrió que Tau está más fosforilada en la E.A. que en cerebros de ancianos sanos.8-21
d. Proteína beta-amiloide: sustancia fundamental para la formación de las placas neuríticas encontradas en la E.A. Su forma 42-aminoácido es críticamente importante en la patogénesis de la E.A. Se ha postulado que la proteína soluble beta-amiloide I-42 es rápidamente digerida en cerebros normales, pero no en la E.A.
e. Presenilinas I y II: proteínas de los cromosomas 14 y 1, respectivamente. Sus anormalidades han sido implicadas en mutaciones autosómicas dominantes capaces de desarrollar E. A.
Aspectos Histopatológicos
a. Placas neuronales. Es el hallazgo fundamental para comprender la patogénesis de E.A.9 Están constituídas por depósitos de proteína beta-amiloide. Se desconoce aún el mecanismo para su formación. Existe, igualmente, gran controversia acerca de la forma como su presencia lleva a la pérdida de las sinapsis y a la muerte celular consiguiente. Se postula que pueda ser mediante la acumulación intracelular de calcio.
b. Ovillos neurofibrilares (tangles). Se encuentran en cerebros de pacientes con E.A. en estrecha asociación con la muerte celular, especialmente en zonas de influencia colinérgica. como el cerebro basal anterior y el hipocampo. Allí se localizan dentro de las neuronas de grupos celulares, los cuales eventualmente aparecen despoblados. Su número se correlaciona con la evolución de la enfermedad. Sus componentes principales son los filamentos hélico-apareados, constituidos casi totalmente por proteína Tau, cuya función normal es ligarse a los microtúbulos y así estabilizar la estructura de la célula nerviosa. La ultraestructura muestra los filamentos rectos enrollados en parejas. Ambos tipos de filamentos se encuentran en las neuronas con ovillos.10-22
El proceso evolutivo o secuencial se ha descrito así:
1. Acumulación de proteína Tau hiperfosforilada (Enzima responsable?)
2. Aparición de ambos tipos de filamentos y
3. Muerte de la neurona
Los ovillos neurofibrilares vistos al microscopio electrónico son similares en EA y en ancianos cuerdos.
Características Clínicas
El inicio y curso clínico de la E.A. son, por lo general, imprecisos. Se pueden distinguir tres etapas:
1. Temprana: El síntoma principal es alteración de la memoria y de la concentración, lo cual conlleva implicaciones de tipo personal, social y laboral, especialmente por incompetencia. Es una etapa de gran estrés para el enfermo ya que él está plenamente consciente de la situación. Las funciones motoras están conservadas.
2. Intermedia: A medida que los síntomas se agravan, aparece dificultad para interpretar estímulos externos (tacto, vista, gusto, oído), insomnio, pérdida de la noción de tiempo/espacio, incoordinación motora, cambios de humor, agresividad, afasia, apraxia y anoxia. Necesidad de abandonar el trabajo y dejar de conducir. Aún puede conservar cierto grado de independencia.
3. Tardía o avanzada: La demencia se acentúa, todas las funciones mentales se alteran, las funciones cognitivas desaparecen. Hay dependencia total de otras personas. Aparece labilidad a infecciones y la muerte se presenta por complicaciones como la neumonía.
Diagnóstico
Se desconoce la causa de la E.A. No existe, por ahora, ayuda alguna de laboratorio que permita diagnosticar con exactitud la E.A.
El diagnóstico puede ser:
a. Posible: hay deterioro en dos o más funciones cognitivas (memoria, dicción, ideación), en asociación con otra enfermedad no causante de la demencia pero la cual dificulta el diagnóstico de E.A.
b. Probable: Similar al anterior, pero en ausencia de una segunda enfermedad coexistente.
c. Seguro o definitivo: Confirmación de placas neuríticas y ovillos neurofibrilares. Sólo es posible mediante biopsia de cerebro o en tejidos de autopsia.
Ayudas Diagnósticas
a. Pruebas habituales de laboratorio, para descubrir una posible enfermedad subyacente (Diabetes, Hipertensión)
b. Evaluación neuro-psicológica para buscar fallas de la memoria, del habla y de la atención y de la planificación de actividades cotidianas. Incluyen mini-examen del estado mental (orientación en tiempo y espacio, seguimiento de instrucciones sencillas).
c. Métodos de exploración del cerebro en vivo:
• Resonancia Magnética Nuclear (RMN): imágenes detalladas y comparables del cerebro sano y enfermo, actualmente y en proyección cronológica.
• Tomografía Axial Computarizada (TAC): permite determinar el espesor de algunas estructuras del cerebro con riesgo de disminución, a veces rápida en la E.A.
• Tomografía de Emisión de Protones (PET): mide el aprovechamiento de la glucosa en zonas específicas del cerebro, el cual esta disminuido en casos de E.A.
• Estudios más recientes11 han permitido la aplicación específica de la Resonancia Magnética Nuclear (RMN) mediante la técnica de “Voxel Compression Mapping”, la cual permite el seguimiento en vivo de la progresión de la EA y mejor aún, descubrir el inicio de la enfermedad desde los primeros síntomas, de especial importancia en pacientes de alto riesgo para ella. Permite, además, el seguimiento de esquemas de terapia medicamentosa.
Tratamiento
No existe tratamiento curativo para la E.A. Existen algunas drogas para la mejoría, en algunos pacientes, de diversos síntomas de la enfermedad. El enfoque principal, en la actualidad, está orientado hacia la restauración de la función colinérgica a nivel de la sinapsis, tratando de corregir el déficit existente. Tacrina (Cognex) es uno de tales fármacos.
Fue el primero en recibir aprobación por la FDA. Mejora algunos síntomas, pero sus efectos colaterales, especialmente elevación de las enzimas hepáticas y el hecho de requerir cuatro tomas/día, limitan su uso. Otros dos compuestos para mejorar los síntomas colinérgicos son Donepezil (Arisept) y Rivostigmina (Exxelon). Mejoran o estabilizan la función cognitiva. Al igual que Tacrine, tienen efectos gastrointestinales (náusea y vómito) pero su administración es más cómoda (una a dos veces/día).
Como antes se mencionó y en ausencia de contraindicaciones importantes, debe considerarse el empleo de los estrógenos para la mejoría y posible retardo de la aparición de la E.A.
Soporte para la familia. Se considera parte muy importante del tratamiento. Los familiares del paciente con E.A. deben conocer:
• Aspectos de la E.A. y de los enfoques efectivos para su cuidado
• Cómo localizar y recurrir oportunamente a los servicios a largo plazo (P. ej. cuidado diario por un adulto y/o acompañantes en la casa).
• Cómo recibir consejería individual y familiar
• Cómo participar en grupos de soporte
• Conocer la ubicación y funcionamiento de los capítulos de la Asociación de Alzheimer en su comunidad y en otros lugares para buscar ayuda si fuere necesario.
Pronóstico
El desenlace final de la E.A. es muy oscuro. Su curso, por lo general, no es agudo sino que progresa lentamente. La incapacidad física y mental absoluta es muy frecuente. El deceso ocurre alrededor de 15 años a partir del inicio de los síntomas, generalmente como complicación de una infección o por falla de diversos órganos o sistemas.
Esteroides Ováricos y el cerebro
Las hormonas gonadales tienen muchos efectos sobre el sistema nervioso central. Además de su accion sobre la regulación de gonadotropinas y PRL, los estrógenos y los andrógenos tienen acción sobre la verbalidad, la realización de tareas espacial en la memoria verbal, y habilidades motoras finas. En animales tiene la habilidad de influenciar la coordinación de movimientos y afecta los síntomas disquinéticos de la enfermedad de Parkinson en humanos.
La influencia hormonal en los procesos de la memoria parece involucrarlos en acciones en diferentes partes del cerebro como el hipocampo, y la región basal del cerebro, mientras los efectos sobre actividad motora involucran regiones como el putamen caudado, el núcleo acumbens y la sustancia nigra lo mismo que núcleos dopaminérgicos del cerebro medio.
Muchas de las acciones de los estrógenos difieren cualitativa y cuantitativamente entre los sexos sugiriendo que hombres y mujeres están sujetos a diferenciación sexual durante el desarrollo prenatal y postnatal temprano. Diferencias en la función cerebral entre sexos también se manifiestan en la diferencia entre géneros de la incidencia de sicopatologías tales como depresión (más común en mujeres) y abuso de sustancias y comportamiento antisocial (más común en los hombres).
Se encuentran receptores intracelulares de estrógenos y progesterona en la amígdala, hipocampo, cíngulos, locus ceruleus, núcleos del rafe mediano y la materia gris central. En el hipotálamo y la amígadala tienen la mayor densidad de receptores.
Estrógenos y sinaptogénesis. Estudios morfológicos han mostrado que los estrógenos inducen espinas dendríticas y nuevas sinapsis en el hipotálamo ventromedial y aumenta la de densidad de espinas dendríticas en las neuronas piramidales del hipocampo en la rata hembra12.
Diferencias en el hipocampo entre sexos durante el desarrollo. La formación del hipocampo ha mostrado diferencias en su estructura y función entre los dos sexos. Los estrógenos no inducen en un número adecuado en los machos de espinas sinápticas como en las hembras. Sin embargo el bloqueo de la aromatización de testosterona a estradiol en los neonatos machos, aumenta el número de sinapsis inducidas por los estrógenos cuando llega a adulto. Esto sugiere que la respuesta estrogénica a la regulación de la formación de sinapsis se defeminiza en machos por la acción neonatal de la testosterona.
El tratamiento neonatal con testosterona en ratas hembras mejora la habilidad de aprendizaje tridimensional. Son sólo aspectos puntuales de la acción hormonal en funciones cognitivas que se pueden aplicar a la acción de la desaparición hormonal.
Potencia terapéutico de los estrógenos. Los esteroides ováricos tiene una variedad de acciones no reproductivas en el cerebro humano y un buen número de comunicaciones científicas los han relacionado con funciones cognitivas. También, hay datos que sugieren pueden tener un papel protector contra la expresión de la demencia.
A través del aumento de la actividad serotoninérgica así como algunos procesos relacionados con norepinefrina, la TRE disminuiría la vulnerabilidad a la depresión y serviría como tratamiento coadyuvante en depresiones que no responden a la terapia antidepresiva convencional.
Papel potencial de los estrógenos en la Enfermedad de Alzheimer
Basados en las acciones de los estrógenos sobre el cerebro, se puede teóricamente preguntar cuál sería el potencial y como los estrógenos podrían ser efectivos para prevenir y tratar la E.A.
Aunque el mecanismo exacto de la pérdida selectiva de neuronas y la acumulación de ovillos neurofibrilares y placas amiloides, característicos de la E.A., no se conoce, se han identificado en estudios epidemiológicos, muchos factores los cuales modifican la expresión de la E.A. (Tabla 1).
Basados en los factores de riesgo identificados, se postula que el desorden es una consecuencia de un imbalance entre el daño y la reparación neuronal. La injuria neuronal puede ser una consecuencia de la edad, el trauma cefálico, generación de radicales libres, isquemia secundaria a eventos cardiovasculares como el infarto y a cirugías mayores.
El proceso de reparación se ve afectado por factores genéticos como el aumento de precursores de la proteína amiloide, el género femenino y la expresión del alelo de apolipoproteína E4 (Apo E4). El proceso de reparación también puede estar comprometido por insuficiencia vascular cerebral. Lo anterior sugiere que los estrógenos tendrían varios sitios donde podrían actuar para mejorar la función neuronal y facilitando la reparación de las neuronas.13
Efecto sobre el flujo vascular. Es potencialmente un mecanismo importante en el mejoramiento de la función cognitiva en las mujeres con E.A. Hay evidencia de que los estrógenos no solamente pueden prevenir el desarrollo de la enfermedad cardiovascular, ECV, sino que mejoran el flujo vascular.
La acción de los estrógenos en la modificación de las lipoproteínas y la disminución de la placa ateromatosa y por ende la insuficiencia vascular. Su acción también se ve reflejada en la inhibición de la endotelina y el aumento del ÓXIDO NÍTRICO.
El papel de la ECV en la patogénesis de la demencia está siendo revalorada debido a las nuevas tecnologías para medir el flujo vascular cerebral a través de las neuroimágenes. Estudios pertinentes sugieren que más del 50% de los pacientes con demencia, tienen alguna evidencia de enfermedad vascular y que de esos paciente con enfermedad vascular significante, la mitad tienen evidencia de E.A.
Incremento de la reparación neuronal. Además de la acción de los estrógenos con relación a sus efectos en el flujo sanguíneo, hay abundante evidencia la cual soporta su efecto directo sobre la función y el crecimiento neuronal.
Al agregarle estrógenos in vitro a cultivo de neuronas se estimula el crecimiento de las dendritas de la célula nerviosa y se aumenta la viabilidad de las mismas. Esa acción se ha reproducido en vivo en experimentos animales.
Después de la ooforectomía hay una involución de la región CA-1 del hipocampo, región relacionada con el aprendizaje y la memoria. La arquitectura neuronal y la densidad sináptica se restablece cuando se hace el reemplazo estrogénico. Efectos similares se han visto en las diferentes fases del estro de las ratas.
Esos cambios en el hipocampo están mediados a través de receptores de las hormonas esteroideas ováricas. En ratas adultas hay una disfunción de tareas de memoria y aprendizaje 28 semanas después de la ooforectomía. Esta disfunción se relaciona con una disminución de la actividad neural colinérgica (actividad de la colino acetiltransferasa) en la corteza frontal y el hipocampo y se previene con el reemplazo estrogénico.
En el cerebro animal envejecido y en el humano, se ha visto que la atrofia neuronal se expresa en las regiones del SNC ricas en presencia colinérgica como los núcleos de la base del cerebro, el hipocampo y la amígdala, las cuales son más sensibles a la pérdida neuronal relacionada con E.A. En el animal, esa atrofia se relaciona con la pérdida de la memoria espacial.
La infusión del factor de crecimiento nervioso (NGF) atenúa la atrofia de las neuronas colinérgicas y los déficits de memoria espacial. Los estrógenos por su parte estimulan la expresión de NGF, lo cual proveería otro mecanismo de facilitación del reparo neuronal por los estrógenos14.
Atenuación del daño neuronal. El mecanismo potencial por el cual los estrógenos pueden atenuar el daño neuronal se relaciona con su efecto sobre el metabolismo de la proteína precursora de amiloide APP. El depósito de b amiloide en el parénquima cerebral es una característica distintiva de la neuropatología de la E.A., pero también ocurre en grado menor en el envejecimiento.
En un sistema de cultivo celular con receptores estrogénicos, el 17 b estradiol en concentraciones fisiológicas, aumenta el metabolismo secretor del fragmento soluble de la APP sin incrementar los niveles intracelulares. Por lo tanto los estrógenos podrían modificar benéficamente el proceso de la APP reduciendo su acumulación de fragmentos neurotóxicos de b amiloide.
Estimulación del transporte y metabolismo de la glucosa. Se ha observado que el peso del cerebro disminuye entre la quinta y sexta década de edad en mujeres y sólo hasta la sexta o séptima década en el hombre. Mujeres postmenopáusicas sanas experimentan una mayor atrofia y pérdida de volumen del hipocampo y del lóbulo parietal, que el hombre.
También, después de ajustar los datos para los cambios en el volumen cerebral las mujeres también demostraron una disminución del metabolismo de la glucosa, relacionado con la edad en la región del hipocampo. En la ausencia de estrógenos, la glucopenia es tóxica para las células cerebrales. El hipocampo por su parte, es muy sensible a la glucopenia y el transporte de la glucosa depende de los estrógenos.
Se podría especular por lo tanto que la disminución en el metabolismo de la glucosa observado por PET en el hipocampo puede contribuir a la pérdida acelerada de neuronas en esta región en mujeres, con relación a los hombres.
Si este es el caso, sería otro mecanismo para contribuir al concepto de que el reemplazo hormonal estrogénico puede contribuir al mejoramiento de la función cerebral, especialmente en el área relacionada con la función cognitiva.
Estudios clínicos
Dada la mayor prevalencia de E.A. en mujeres que en hombres, se puede establecer una relación con el declive de los niveles estrogénicos en la mujer a medida que avanza en edad. Los hombres mayores mantienen niveles elevados de estrógenos mediante la conversión desde testosterona.
Existen tres asociaciones entre niveles bajos de estrógenos y deterioro cerebral: 1) la asociación de Enfermedad Cardíaca Coronaria (ECC), fractura de cadera y bajo peso corporal en mujeres con EA; 2) La correlación entre niveles bajos de estrógenos endógenos y mujeres postmenopáusicas de peso corporal bajo y 3) Riesgo menor de ECC y de fracturas de cadera en usuarias de TRE.
Estudios clínicos epidemiológicos recientes han fortalecido la hipótesis de esa acción benéfica. Pero aún en tales estudios epidemiológicos los resultados favorables se sitúan en el rango de “moderados” y no puede excluirse la posibilidad de que sesgos de observación sean los responsables de los resultados obtenidos.
Se necesitan aún estudios aleatorizados, más precisos y de intervención primaria para ratificar tales hallazgos. Actualmente se adelantan estudios tales como el de Iniciativas de Salud de la Mujer (Women’s Health Initiative- WHI), auspiciado por el
• Estudio de Cohorte de Mannhattan. Tang y colaboradores17 encontraron 167 casos de E.A. entre 1124 mujeres de edad avanzada quienes no sufrían de demencia, en un período de cinco años, en una comunidad basada en la cohorte de Mannhattan. Las usuarias de estrógenos tuvieron una disminución del riesgo de E.A. en 60% (RM=0.40, IC95%, 0.22-0.85, y la edad al primer síntoma fue significativamente más tardía entre las usuarias de estrógeno quienes desarrollaron E.A. que entre las nunca-usuarias.
•Estudio longitudinal de Baltimore sobre el envejecimiento. Kawas y cols18 hallaron 34 casos de E.A. entre 472 mujeres de edad avanzada, quienes participaron en el estudio y fueron seguidas hasta por 16 años. El RR de E.A. entre quienes alguna vez recibieron TRE oral o transdérmica, comparado con el de las nunca-usuarias, se redujo a la mitad (RM=0.46).
Debe anotarse que estos cuatro estudios longitudinales, son observacionales y que el efecto benéfico de los estrógenos para la prevención de la E.A. aún tendrá que establecerse mediante estudios aleastorizados y controlados. Sólo así podrán resolverse los sesgos atribuibles a factores diversos, tales como, por ejemplo las diferencias entre pacientes usuarias y no-usuarias habituales de TRE.
Los estudios actuales permiten concluir que la eficacia de los estrógenos sobre la E.A. tiene las siguientes características: (Paganini-Hill-19, Birge,14)
• Son eficaces en algunas pacientes.
• Son muy eficaces en mujeres con demencia leve o moderada.
• Mejoran las funciones cognoscitivas de memoria, orientación en tiempo y espacio y capacidad de cálculo.
• Mejoran la interacción social y el desempeño de las actividades diarias.
• Instituto Nacional de Salud (NIH) de los EE.UU.
La Figura 2 ilustra diversos estudios epidemiológicos sobre TRE y E.A. y los autores y hallazgos correspondientes.

Figura 2. TRE y enfermedad de Alzheimer. Estudios Epidemiológicos
Tomada de Paganini-Hill
La evidencia epidemiológica muestra reducción significativa el riesgo de E.A. en mujeres postmenopáusicas quienes reciben TRE. De los 10 estudios presentados en la figura todos menos uno estimaron que el RR de EA era cuando menos un 35% menor que en no usuarias.
Cuatro de esos estudios merecen mencionarse:
• Estudio Mundial de Cohorte. Incluyó 8877 mujeres quienes informaron acerca de la TRE recibida al inscribirse en la cohorte en 1980. En 1995 se encontró que 248 de las 3760 mujeres participantes tenían E.A. como causa de muerte. La TRE redujo el riesgo de E.A. en un 35% (Razón de momios (RM)= 0.65, IC 95% 0.49-0.88.
• Estudio de Seatle. Brenner y cols16 compararon los registros de farmacia en 107 casos de E.A. y 120 controles de igual edad. No encontraron asociación entre riesgo de E.A. y el no-uso de estrógenos (RM=1.1, IC95% 0.6-1.8), el riesgo disminuyó en un 30% (RM=0.7 IC93% 0.4-1.5) entre las usuarias de estrógenos.
• Estudio de Cohorte de Mannhattan. Tang y colaboradores17 encontraron 167 casos de E.A. entre 1124 mujeres de edad avanzada quienes no sufrían de demencia, en un período de cinco años, en una comunidad basada en la cohorte de Mannhattan. Las usuarias de estrógenos tuvieron una disminución del riesgo de E.A. en 60% (RM=0.40, IC95%, 0.22-0.85, y la edad al primer síntoma fue significativamente más tardía entre las usuarias de estrógeno quienes desarrollaron E.A. que entre las nunca-usuarias.
• Estudio longitudinal de Baltimore sobre el envejecimiento. Kawas y cols18 hallaron 34 casos de E.A. entre 472 mujeres de edad avanzada, quienes participaron en el estudio y fueron seguidas hasta por 16 años. El RR de E.A. entre quienes alguna vez recibieron TRE oral o transdérmica, comparado con el de las nunca-usuarias, se redujo a la mitad (RM=0.46).
Debe anotarse que estos cuatro estudios longitudinales, son observacionales y que el efecto benéfico de los estrógenos para la prevención de la E.A. aún tendrá que establecerse mediante estudios aleastorizados y controlados. Sólo así podrán resolverse los sesgos atribuibles a factores diversos, tales como, por ejemplo las diferencias entre pacientes usuarias y no-usuarias habituales de TRE.
Los estudios actuales permiten concluir que la eficacia de los estrógenos sobre la E.A. tiene las siguientes características: (Paganini-Hill-19, Birge,14)
1. Son eficaces en algunas pacientes.
2. Son muy eficaces en mujeres con demencia leve o moderada.
3. Mejoran las funciones cognoscitivas de memoria, orientación en tiempo y espacio y capacidad de cálculo.
4. Mejoran la interacción social y el desempeño de las actividades diarias.
5. El efecto benéfico es directamente proporcional a las dosis del compuesto y a la duración del tiempo de uso.
6. El efecto se anula a la interrupción del tratamiento.
De todas maneras, merece consideración especial la gran importancia médico social generada por los estudios que muestran el efecto benéfico de los estrógenos sobre el cerebro, dada la magnitud del problema y la posible disminución del riesgo en 1/3 a 1/2 en las mujeres bajo TRE.
Mientras los estudios en progreso confirman los resultados benéficos logrados, los médicos y sus pacientes deben decidir si iniciar o no, o continuar la TRE, con base en los conocimientos actuales. Igualmente, al establecer la relación riesgo/beneficio de la TRE, se debe considerar la posibilidad de que los estrógenos pueden retardar o prevenir el inicio de la E.A. frente a los posibles efectos adversos de la terapia.
Testosterona y Alzheimer
La observación clínica de que los hombres entre 60 y 70 años presentan E.A. con menos frecuencia, frente a la mujeres de esas mismas edades, condujo al hallazgo de que a los 84 años ambos grupos están afectados por igual. Puesto que los hombres secretan típicamente más de tres andrógenos (testosterona, metiltestosterona y epitestosterona) que las mujeres, se ha sugerido una posible neuroprotección en los varones para desarrollar E.A.
Actualmente existe poca información sobre los efectos de los andrógenos en el cerebro. Se ha encontrado, por ejemplo, que los andrógenos previenen la fosforilación de tau, uno de los hallazgos mas típicos de la E.A., mientras que los estrógenos no lo logran. Se ha encontrado, también, que la testosterona disminuye la secreción de beta-amiloide en neuronas N2a de rata. Los autores de este estudio proponen que la testosterona es aromatizada a estrógenos y actúa a través de
receptores estrogénicos. Y concluyen que los efectos de los andrógenos en el cerebro son mediados por estrógenos.
En otro estudio, Morri Gelfand, presidente electo de la Sociedad Norteamericana de Menopausia (NAMS), encontró, mediante un proceso enzimático y el uso de neuronas humanas, que la acción neuroprotectora de los andrógenos es mediada a través del receptor androgénico.
De interés clínico ha sido también el hallazgo de que las concentraciones de testosterona libre son menores en hombres con E.A.20 Existe gran expectativa por los estudios con peso evidencial importante, para analizar a fondo este interesante aspecto del manejo de la E.A.
Referencias Bibliográficas
1. Jorm, AF, Korten AE, Henderson AF. The prevalence of dementia: a quantitative integration of the literature. Acta Psychiatr Scandin. 1987; 76: 465-79.
2. Henderson VH. The epidemiology of estrogen replacement therapy and Azheimer´s disease. Neurology 1997; 48(Suppl 7): S27-S35.
3. Vane JR, Botting RM. Antiinflamatory drugs and their mechanism of action Inflamm Res 1998 Oct; 47 Suppl 2: 578-87.
4. Zuccala G, Onder G, Pedonec M et al. Dose-relarted impact of alcohol consumption on cognitive function in advanced age:results of a multicenter survey. Alcohol Clin Exp Res 2001; 25(12): 1743-8.
5. Simons M, Keller P, Dichgands J et al. Cholesterol and Alzheimer´s Disease: is there a link?. Neurology 2001; 57(6):1089-93.
6. Golde TE, Eckman TB. Cholesterol modulation as an emerging strategy for the treatment of Alzheimer´s Disease. Drug Discov Today 2001 Oct 15; 6(20): 1049-55.
7. Kipivelto M, Helkala E, Laakso MP et al. Midlife vascular risk factor and Alzheimer´s disease in later life: longuitudinal population based study. BMJ 2001; 322: 1447-51.
8. Olesen OF. Tau, amyloid and Alzheimer’s Disease Ugeskr Laiger 1994 Feb 21; 156 (8): 1116-17.
9. Su JH, Cummings BJ, Cotman CW. Plaque biogenesis in brain aging and Alzheimer’s Disease II Progessive transformation and developemental sequence of dystrophie neurities. Acta Neuropathol (BERL) 1998 Nov; 96(5): 463-71.
10. Ishii K et al. Cerebral glucose metabolism in patients with frontotemporal dementia. J. Nuel Med 1998 Nov; 39(11): 1875-8.
11. Fox N, Crum WR. Imaging of onset and progression of Alzheimer´s Disease with voxel-compression mapping of serial magnetic resonance images. Lancet 2001 Jul 21; 358(927): 201-5.
12. Halbreich U. Role of estrogen in postmenopausal depression. Neurology 1997; 48 (Suppl 7): S16-S20.
13. Sherwin BB. Estrogen effects on cognition in menopausal women. Neurology 1997; 48 (Suppl 7): S21-S26.
14. Birge SJ. The role of estrogen in the treatment of Alzheimer´s disease. Neurology 1997; 48 (Suppl 7): S36-S41.
15. Paganini-Hill A. La Enfermedad de Alzheimer, mujeres y la terapia de reemplazo de estrógenos.Current concepts in gynecology 1999 Sept; 1(3): 14-20.
16. Brenner DE, Kukull WA, Stergachis A y cols. Postmenopausal estrogen replacement therapy and the risk of Alzheimer´s Disease: a population-based case-control study. Am J Epidemiol 1994; 140: 262-7.
17. Tang M-X, Jacobs D, Stem Y et al. Effect of estrogen during menopause on risk and age of onset of Alzheimer´s Disease Lancet 1996; 348: 429-432.
18. Kawas C, Resnick S, Morrison A y cols. A prospective study of estrogen replacement therapy and the risk of developing Alzheimer´s Disease:the Baltimore Longitudinal Study of Aging. Neurology 1997; 48: 1517-1521.
19. Paganini-Hill A, Henderson VW. Estrogen deficiency and risk of Alzheimer´s Disease in women.Arch Int Med 1996; 156: 2213-2217.
20. Hogervost E, Williams J. Serum total testosterone is lower in men with Alzheimer´s Disease. Neuroendocrinol Lett 2001 Jun; 22(3): 163-8.
21. Kosik KS. The molecular and celular biology of Tau Brain Pathol 1993 Jan; 3(1): 39-43 review.
22. Gomez-Ramos P, Moran MA. Ultrastrutural aspects of neurofibrillary tangle formation in aging and Alz. Disease Micrsc Res Tech 1998 Oct 1; 43(1): 49-58