Terapias Alternativas
* Santiago Palacios G.; Director del Instituto Palacios, Madrid – España.
Resumen
El descubrimiento de la tibolona se debió a la búsqueda de una alternativa a la terapia hormonal substitutiva (THS) clásica, de una substancia que ofreciendo a la mujer postmenopáusica los beneficios de esta terapia no produjese los riesgos y principales efectos colaterales que pueden asociarse a dicho tratamiento.
Con este espíritu se diseñó la tibolona u Org OD 14, un esteroide estructuralmente relacionado con derivados de la 19-nortestosterona como el noretinodrel y la noretisterona que tiene una triple actividad hormonal estrogénica, androgénica y progestagénica.
El efecto hormonal que produce este esteroide depende del tejido en el que actúe, es decir en unos tejidos actuará como un estrógeno y producirá efectos agonistas estrogénicos, y en otros actuará como un progestágeno o como un andrógeno y producirá los correspondientes efectos hormonales.
Su perfil de actuación resultará pues de la suma de sus distintos efectos hormonales en los diferentes órganos y tejidos en los que actúa. Es por esto por lo que se dice que la tibolona es una molécula de acción tejido específica.
Palabras clave: Tibolona, HRT, Acción Tejido Específica, ATE.
Summary
Tibolone was discovered while looking for an alternative to classic HRT, as a compound that could offer postmenopausal women all the benefits of HRT without its clinical inconveniences and side effects. With that idea in mind Tibolone (Org OD-14) was created. It is an steroid compound, structurally related to 19-NET derivatives norethinodrel and norethisterone. Tibolone has triple hormonal activity, estrogenic, progestational and androgenic. Its hormonal actions depend on the target tissue, acting as an estrogen agonist in some tissues and androgenic or progestagenic on some others, with the corresponding hormonal effects. The acting profile of Tibolone will then be the resultant of the sum of the different hormonal effects on the various target tissues and organs on which it acts. That is why Tibolone is being said to be a “Specific Tissue Acting” molecule.
Key Words: Tibolone, HRT, Specific tissue acting molecule, STA.
Especificidad Tisular de la Tibolona
1. Datos experimentales y clínicos
Los experimentos realizados en animales para evaluar la actividad hormonal de la tibolona indican que esta substancia tiene in vivo una triple débil acción estrogénica, progestagénica y androgénica.
Utilizando el test de Allen-Doisy, que determina la actividad estrogénica de una substancia en el epitelio vaginal de la rata, se ha observado que Org OD 14 posee una débil acción estrogénica a este nivel, del orden de un 10% con respecto a la del etinilestradiol1.
Así mismo, y mediante el test de transformación del endometrio del conejo se ha observado que la tibolona tiene actividad progestagénica a este nivel, y que esta actividad es menor que la de la noretisterona, ya su potencia es de aproximadamente una octava parte de la de esta última.
Adicionalmente y utilizando el test de Herschberger se ha observado que la tibolona en ratas machos castradas tiene actividad androgénica, y que esta actividad es unas veinte veces inferior a la de la metiltestosterona2.
En cuanto a los efectos hormonales de la tibolona a nivel óseo los experimentos realizados en ratas ovariectomizadas indican que inhibe la resorción ósea y mantiene la masa ósea dentro de límites normales de forma similar a como lo hace el etinilestradiol.
Este efecto parece deberse a que exhibe en el hueso una actividad estrogénica, ya que puede ser bloqueada por antagonistas estrogénicos pero no por antagonistas antiprogestagénicos o antiandrogénicos.
Además, se ha observado que la tibolona mejora la calidad del hueso de forma similar a como lo hace el etinilestradiol, lo que de nuevo indica que su efecto en este tejido es similar al de los estrógenos3.
A nivel endometrial:
Por el contrario, la tibolona no parece tener una acción estrogénica, ya que diversos estudios realizados en animales1,4 han demostrado que este esteroide, a diferencia del etinilestradiol, no estimula la proliferación del tejido endometrial.
Así mismo, y aunque se ha observado una cierta actividad en el epitelio uterino de las ratas tratadas con Org OD 14, menor que la producida por el etinilestradiol, no se ha observado patología endometrial entre dichas ratas y sí entre las que se les daba etinilestradiol4.
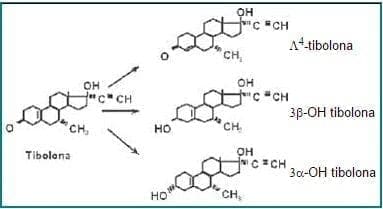
Figura 1. Estructura química de la tibolona y de sus principales metabolitos
Los datos clínicos indican que el perfil de actuación de la tibolona produce efectos que pueden ser de gran beneficio para la mujer postmenopáusica (Tabla 1):
Tabla 1. Efectos benéficos de la tibolona en la mujer postmenopáusica

• Efectos sobre la sintomatología vasomotora.
La tibolona se comporta como un estrógeno en cuanto a la sintomatología vasomotora de la mujer menopáusica, mejorándola y siendo, a dosis de 2.5 mg/día, tan efectiva como los estrógenos y más efectiva que el placebo en el tratamiento de dichos síntomas5.
• Efectos sobre la sintomatología psicológica.
Org OD 14 es capaz de estimular la producción de opiáceos endógenos, y específicamente la producción de b-endorfinas6-7.
Este aumento de opióides endógenos producido por su acción central no sólo mejorará el humor, sino también el sueño y la ansiedad.
Sin embargo, no está claro si éste es un efecto independiente de este esteroide, o si en realidad se debe a su efecto dominó, es decir a la sensación de bienestar que produce el alivio de la sintomatología vasomotora y que repercutirá positivamente en la percepción de los otros síntomas5,8.
• Efecto sobre la líbido.
La menopausia se acompaña en algunos casos de una disminución del deseo sexual, de la frecuencia de las relaciones sexuales, y de la capacidad de disfrutar con las mismas. En estos casos la tibolona producirá un efecto francamente positivo sobre la líbido debido a su efecto androgénico9.
• Efectos sobre la vagina.
Org OD 14 parece tener un efecto estrogénico significativo sobre el trofismo vaginal y el moco cervical. Según los resultados de un ensayo clínico controlado con placebo la administración de 2.5 mg/día de tibolona durante 2 años produce una mejoría significativa del índice cariopicnótico, y del índice de maduración vaginal. También se observó en ese estudio que en el grupo tratado con este compuesto se producía una mejoría subjetiva de la sensación de sequedad vaginal y de la dispareunia10.
• Efectos sobre el hueso.
También a nivel del hueso la tibolona parece tener un efecto estrogénico, ya que además de haberse observado en mujeres con menopausia reciente que la administración diaria de Org OD 14 a dosis de 1.5 y 2.5 mg durante 2 años produce un aumento significativo de la densidad mineral ósea (DMO) del hueso trabecular y cortical11, y que este esteroide parece ser tan efectivo como la THS clásica en la prevención de la osteoporosis postmenopáusica12,14, la tibolona a dosis de 2.5 mg/día parece aumentar gradualmente, y a diferencia del placebo, la DMO a nivel de la columna lumbar y de la cabeza femoral en mujeres con osteoporosis postmenopáusica15.
• Efectos sobre el aparato cardiovascular.
La tibolona no parece tener un efecto típicamente estrogénico sobre el perfil lipídico ya que se ha observado que disminuye los niveles plasmáticos de HDL-colesterol16,18, no modifica los niveles séricos de colesterol total, ni de LDL-colesterol17,18, y disminuye16 o no modifica17 los de los triglicéridos. Sin embargo, y respecto a la lipoproteína (a), sí que se comportaría como un estrógeno, ya que se han observado reducciones de sus niveles plasmáticos durante el tratamiento, entre un 26 y un 36%17,18, incluso mayores que con el estradiol oral.
Datos similares se han obtenido en un ensayo clínico recientemente publicado19, según el cual la tibolona se diferenciaría de la THS en cuanto a su efecto sobre el perfil lipídico en que disminuye la concentración plasmática de HDL colesterol, de apolipoproteína AI y de los triglicéridos.
En cuanto a la seguridad del tratamiento con este esteroide desde el punto de vista cardiovascular hay que recordar que la tibolona no parece afectar al sistema de la coagulación, ni al tiempo de protombina, ni al de hemorragia, y parece aumentar los niveles de antitrombina III, y de plasminógeno, y la actividad fibrinolítica, y parece disminuir los niveles de fibrinógeno16,20. Por otro lado, no parece modificar la tensión arterial, ni la frecuencia cardiaca, y parece aumentar el gasto cardiaco y mejorar la relajación del ventrículo izquierdo, lo que ayudaría a prevenir o al menos a retrasar la insuficiencia cardíaca21.
• Efecto sobre la mama.
Una de las principales limitaciones de la THS clásica es el posible aumento del riesgo de cáncer de mama que parece asociarse al uso prolongado de estrógenos22,23. En este sentido, y aunque hay pocos estudios disponibles que hayan examinado directamente la relación entre el uso de tibolona y el cáncer de mama en la mujer postmenopáusica, este tratamiento no parece aumentar el riesgo de cáncer de mama en mujeres con/sin antecedentes de patología mamaria24.
Por otro lado, hay que recordar que la sintomatología mamaria es un efecto adverso frecuente de la THS que puede afectar al cumplimiento. Sin embargo, la tibolona parece producir una baja incidencia de síntomas mamarios, y por tanto una baja tasa de abandonos por esta causa24,25.
Así mismo, y al comparar los efectos de Org OD 14 con los de la THS clásica se ha observado una menor incidencia de síntomas mamarios entre las usuarias de la tibolona que entre las usuarias de la THS convencional26,27.
Adicionalmente se ha observado que la tibolona, a diferencia de la THS clásica, no produce cambios en la densidad radiológica del parénquima mamario, lo cual respetaría la sensibilidad de la mamografía para detectar precozmente signos de cáncer mamario25,28. En conclusión, todos estos datos parecen indicar que la tibolona no estimula al tejido mamario.
• Efecto sobre el tejido endometrial.
La tibolona a nivel endometrial parece tener un efecto antiestrogénico, mediado por su actividad progestagénica, inhibiendo la proliferación endometrial. En los estudios realizados no se han observado cambios proliferativos en este tejido en el 90-96% de las mujeres que seguían este tratamiento29-31, lo cual se asemeja a los porcentajes de atrofia endometrial generalmente observados en las mujeres sin tratamiento. Incluso se han descrito regresiones de hiperplasia endometrial aparecidas durante el tratamiento con THS31.
Por otro lado, los sangrados vaginales son menos frecuentes con este tratamiento, y en comparación con la THS32, lo que repercutiría favorablemente en el cumplimiento.
En resumen, la tibolona parece producir la actividad hormonal que se precisa en cada órgano diana para obtener el correcto tratamiento de la sintomatología climatérica y la prevención de los efectos a largo plazo de la menopausia, sin producir los problemas derivados de las acciones hormonales no deseadas y mostrando una buena seguridad a nivel endometrial, mamario y cardiovascular.
2. Mecanismos sugeridos para la actividad tisular específica de la tibolona
Al intentar entender cómo la tibolona ejerce una actividad tisular específica hay que recordar en primer lugar que la acción tisular de las hormonas esteroideas se debe no sólo a su unión al receptor esteroideo y a las propiedades intrínsecas de la sustancia en cuestión para actuar de una forma u otra, sino también a la intervención de otros factores que van a regular la respuesta celular como son la afinidad de la sustancia por el receptor, la distribución y concentración de los distintos receptores esteroideos en los distintos tejidos, los cofactores, correpresores y los factores de transcripción específicos de cada tejido, y que también se deben en parte al metabolismo de dicha sustancia33.
Puede decirse por tanto que la especificidad tisular de Org OD 14 va a depender fundamentalmente de la interacción de dos mecanismos fisiológicos principales, uno bioquímico, el metabolismo de la tibolona, y el otro genético, a través de su unión con el receptor esteroideo (Figura 2).
Sin embargo, es posible que en cada tejido predomine un mecanismo. Por ejemplo el metabolismo parece jugar un papel de gran importancia en la especificidad de acción de la tibolona en el endometrio, mientras que en otros tejidos como en el hueso, en el que ejerce una acción fundamentalmente estrogénica, lo haría casi exclusivamente a través de la activación del receptor estrogénico
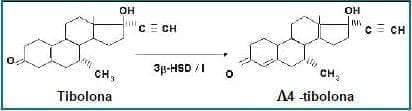
Figura 2. Conversión específica de la tibolona en el endometrio (34).
La tibolona tras su administración oral se metaboliza en el organismo en tres moléculas esteroideas diferentes, los metabolitos 3a-OH y 3b-OH, y el isómero 4 (Figura 1), que presentarán, al menos en teoría, una distinta especificidad y afinidad de unión al receptor esteroideo. Por lo tanto la acción de Org OD 14 dependerá no sólo de la interacción de la propia molécula de tibolona con el receptor, y de los otros factores anteriormente mencionados, sino también de la interacción de cada uno de estos metabolitos con el/los receptores a los que se unan.
Y lo que es más importante, ya que la tibolona puede ser también metabolizada a nivel del órgano diana, su acción en cada tejido dependerá en gran parte del metabolismo local y/o del metabolito predominante en ese tejido. Es decir, a nivel tisular se producirá un metabolismo específico que dará lugar a una respuesta tisular específica que determinará a su vez una respuesta clínica específica.
A continuación vamos a describir lo que se sabe sobre los mecanismos de especificidad de acción tisular a nivel endometrial y a nivel del tejido mamario, que son los más estudiados hasta el momento.
En el tejido endometrial la respuesta tisular específica se producirá a través de la combinación de un metabolismo local específico de la tibolona junto a sus propiedades intrínsecas de unión al receptor esteroideo.
Tang y colaboradores en un experimento realizado con células endometriales humanas identificaron al enzima 3b-hidroxiesteroide dehidrogenasa/isomerasa (3b-HSD/I) como la proteína que convierte local y específicamente la tibolona en el isómero 4 (Figura 2), metabolito que tiene una mayor potencia progestagénica y menor potencia estrogénica que Org OD 14.
Este enzima:
A través de la conversión local, tejido específica, de Org OD 14 sería en parte responsable de que los efectos estrogénicos de la tibolona y de sus hidroximetabolitos en el endometrio sean mínimos, ya que son contrarrestados por la actividad progestagénica del metabolito predominante en este tejido, el isómero
Adicionalmente contamos con los resultados del estudio in vitro realizado por Markiewicz y Gurpide, utilizando cultivos de células endometriales humanas, para conocer la actividad hormonal o potencia de la tibolona y sus metabolitos en comparación con los efectos del estradiol y de la progesterona. Según se observó en este experimento los metabolitos 3a-OH y 3b-OH de la tibolona tienen un efecto similar al estradiol sobre las células endometriales secretoras, que están bajo la influencia de la progesterona, mientras que la tibolona y el isómero 4 antagonizan los efectos de los estrógenos sobre dicho endometrio de una forma similar a como lo hace la progesterona.
También en el caso de un endometrio proliferativo, y por tanto bajo la influencia del estímulo estrogénico, la tibolona y su isómero 4 mostrarán una actividad similar a la de la progesterona, mientras que los metabolitos 3a-OH y 3b-OH no tienen ningún efecto.
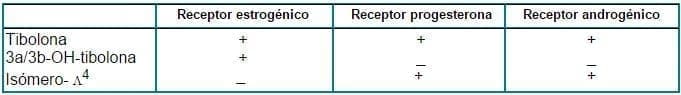
Por otro lado estos mismos autores 35 observaron que la afinidad de la tibolona y de su isómero 4 por los receptores esteroideos del tejido endometrial no parecía concordar del todo con la actividad hormonal previamente observada, ya que la tibolona presentaba una débil afinidad de unión al receptor estrogénico, al progestagénico y al androgénico, mientras que el isómero 4 no tiene ninguna afinidad por el receptorestrogénico y su afinidad de unión por los receptores progestagénicos y androgénicos es mayor que la de la propia tibolona (Tabla 2).
Tabla 2. Afinidad específica de unión de la tibolona y sus metabolitos por los receptores esteroideos (35).
En cuanto al efecto de la tibolona sobre el tejido mamario, es lógico preguntarse cómo actúa en este tejido y si tiene alguna actividad estrogénica que pudiese aumentar el riesgo de cáncer de mama.
Antes de intentar responder a estas preguntas es conveniente recordar los mecanismos que se han sugerido para explicar el posible papel de los estrógenos en el desarrollo del carcinoma mamario. Se ha propuesto que el estradiol estimularía la proliferación de las células mamarias al estimular la expresión de protooncogenes y factores de crecimiento36-38.
Así mismo también se ha observado que el estradiol estimularía la expresión de protooncogenes como el c-myc tanto en células mamarias sanas como en células mamarias cancerosas, lo que sugiere que una estimulación “anormal” de la proliferación celular podría ser uno de los múltiples pasos a través de los cuales una célula normal se convierte en cancerosa.
Otro posible mecanismo sería que el estradiol interferiría con la homeostasis celular, es decir con la diferenciación celular normal y con la apoptosis, actuando como promotor del cáncer de mama.
Ante estos resultados los autores sugirieron lo que posteriormente, y como se ha visto anteriormente, se confirmó, que las acciones estrogénicas y progestagénicas observadas de la tibolona y de sus metabolitos podrían estar influidas por el metabolismo intracelular del tejido endometrial.
Es decir, que la tibolona y el isómero 4 presenten una actividad progestagénica similar pero una muy distinta afinidad relativa de unión por el receptor progestagénico a nivel endometrial podría deberse a que en el endometrio el isómero 4 fuese el mayoritario gracias a una transformación local de la tibolona en este metabolito.
Sin embargo:
Los resultados de los estudios de Gompel y colaboradores con cultivos de células humanas sanas de epitelio mamario (HEM) y con líneas celulares de cáncer mamario hormonodependiente indican que tanto la tibolona como el isómero 4 disminuyen la tasa de proliferación y estimulan la diferenciación de las células sanas, y que por lo tanto se comportan en ese tejido como progestágenos.
Adicionalmente los metabolitos 3a-OH y 3b-OH no parecen tener ninguna actividad estrogénica sobre las células mamarias sanas, y muestran al igual que la tibolona y el isómero 4 una actividad proapoptótica sobre estas células.
Por otro lado y según los observado por Kloosterboer y colaboradores45,46 en modelos tumorales in vivo e in vitro la tibolona no tiene o, si acaso, tiene una muy débil actividad estrogénica (menor de un 1% con respecto a la del estradiol) estimulando el crecimiento de líneas celulares de tumores mamarios hormonodependientes (T47D y MCF-7). Esos autores también observaron que la tibolona no sólo tenía un efecto terapéutico, inhibiendo de forma dosis dependiente el crecimiento de tumores inducidos experimentalmente en ratas, sino que administrada a la vez que el inductor tumoral retrasaba y suprimía el desarrollo tumoral.
Por lo tanto la tibolona y sus metabolitos, y aunque pudiesen tener cierta actividad estrogénica sobre las líneas celulares tumorales, no parecen promover el crecimiento de los tumores preexistentes y parecen tener un efecto inhibitorio del desarrollo tumoral muy potente.
Efectos que podrían explicarse por la actividad progestagénica y/o androgénica de la tibolona y el isómero
Adicionalmente la tibolona y sus principales metabolitos parecen inhibir las enzimas implicadas en la síntesis de estradiol en las células mamarias humanas (Figura 3), sugiriendo un efecto protector del desarrollo de cáncer de mama.
En este sentido Gompel y colaboradores han observado que la tibolona aumenta la actividad de la 17b-hidroxiesteroide dehidrogenasa en las células HEM, y que por lo tanto estimula la conversión de estradiol en estrona, un derivado mucho más débil.
Además, la tibolona y sus metabolitos principales inhibirían la síntesis de estradiol en las células mamarias de los tumores hormonodependientes (MCF-7 y T47D), mediante la inhibición de la actividad de las enzimas sulfatasa y 17b-hidroxiesteroide dehidrogenasa en esas células, lo que sugiere una actividad como progestágeno similar a la del acetato de nomegestrol.
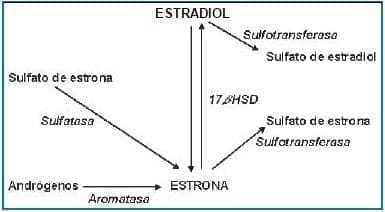
Figura 3. Transformación metabólica de los estrógenos en el tejido mamario (47).
En resumen la tibolona a nivel mamario parece actuar como un progestágeno. Esta actividad parece deberse también aquí a la presencia del isómero 4, el cual actuaría localmente mediante la interacción de al menos los siguientes mecanismos: interacción con el receptor progestagénico, por el que muestra una mayor afinidad que la propia tibolona, estimulando la proliferación y diferenciación de las células mamarias sanas, y bloqueando la síntesis local de estradiol.
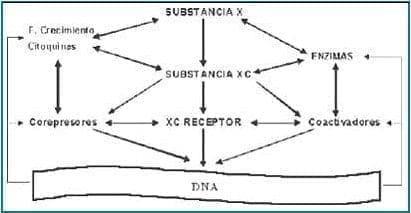
Figura 4. Mecanismos propuestos de acción tejido específica de la tibolona
Conclusión
La tibolona tiene un perfil de efectos clínicos que la hace ser una buena alternativa a la THS clásica, ya que ejerce efectos similares a los estrógenos allí donde estos efectos son necesarios y carece de dichos efectos donde podrían resultar perjudiciales. Esta adecuación de efectos clínicos de la tibolona a las necesidades de la mujer postmenopáusica se debe a la especificidad de acción que tiene la tibolona y sus metabolitos principales en los distintos tejidos en los que actúa.
Las actividades tejido específicas de la tibolona se explicarían por la interacción de una serie de mecanismos (Figuras 2 y 3), que variarán en tipo e importancia según el tejido, entre los que se encuentran la conversión en compuestos con distinta actividad biológica, un metabolismo local específico, la clásica interacción con los receptores esteroideos, la interferencia con el metabolismo local, y la estimulación de la diferenciación celular y de la apoptosis. Interacciones que como intenta mostrar la figura 4 son complejas, y hoy por hoy difíciles de entender en su totalidad.
Bibliografía
- 1. Pharmacological studies with (7 alpha,17 alpha) – 17-hydroxy – 7-methyl – 19-norpregn – 5(10) – en – 20-yn-3 -one(Org OD 14). Maturitas 1987; Suppl1: 15-24.
- 2. Herschberger LG, Shipley EG, Meryer RH. Myotrophic activity of 19-nortestosterone and other osteroids determined by the modified levator muscle method. Proc Soc Exp Biol Med 1953; 83; 175-80.
- 3. Ederveen AG, Kloosterboer HJ. Tibolone, a steroid with a tissue-specific hormonal profile, completely prevents ovariectomy-induced bone loss in sexually mature rats. J Bone Miner Res 1999; 14(11): 1963-1970.
- 4. Kloosterboer HJ. Tibolone and its metabolites: pharmacology, tissue specificity and effects in animal models of tumors. Gynecol Endocrinol 1997; 11 (Suppl 1): 63-68.
- 5. Ross LA, Alder EM. Tibolone and climacteric symptoms. Maturitas 1995; 21(2): 127-136.
- 6. Genazzani AR, Facchinetti F, Ricci-Danero M, Parrini D, Petraglia F, La Rosa R, D´Antona N. b-lipoprotein and b-endorphin in physiological and surgical menopause. J Endocrinol Invest 1981; 4: 375-378.
- 7. Taskin O, Gokdeniz R, Yalcinoglu A, Buhur A, Burak F, Atmaca R, Ozekici U. Placebo controlled cross-over study of the effects of tibolone on premenstrual symptoms and peripheral beta-endorphin concentrations in premenstrual syndrome. Hum Reprod 1998; 13(9): 2402-2405.
- 8. Ross LA, Alder EM, Cawood EH, Brown J, Gebbie AE. Psychological effects of hormone replacement therapy: a comparison of tibolone and a sequential estrogen therapy. J Psychosom Obstet Gynaecol 1999; 20(2): 88-96.
- 9. Palacios S, Menéndez C, Jurado AR, Castaño R, Vargas JC. Changes in sex behaviour after menopause: effects of tibolone. Maturitas 1995; 22: 155-161.
- 10. Rymer J, Chapman MG, Fogelman I, Wilson POG. A study of the effect of tibolone on the vagina in postmenopausal women. Maturitas 1994; 18: 127-133.
Referencias
- 11. Berning B, Kuyck C van, Kicovic P, Coelingh Bennink HJT, Fauser BCJM. Effects of withdrawal of HRT with tibolone on bone mineral density in early postmenopausal women. Data on Livial (tibolone). Presented at the 1996 World Congress on Osteoporosis, Asmterdam, The Netherlands.
- 12. Lippuner K, Hänggi W, Birhäuser MH, Jaegger Ph. Prevention of postmenopausal osteoporosis in a comparative study with tibolone, oral estradiol and transdermal estradiol. Data on Livial (tibolone). Presented at the 1996 World Congress on Osteoporosis, Asmterdam, The Netherlands.
- 13. Milner MH, Harrison RF. Bone mineral density changes during two years of treatment with Livial or Prempak-C, in postmenopausal women. Data on Livial (tibolone). Presented at the 1996 World Congress on Osteoporosis, Asmterdam, The Netherlands.
- 14. Beardsworth SA, Kearney CE, Purdie DW. Prevention of postmenopausal bone loss at lumbar spine and upper femur with tibolone: a two-year randomised controlled trial. Br J Obstet Gynaecol 1999; 106(7): 678-683.
- 15. Paulov PW, Ginsburg T, Kicovic PM, van der Schaaf DB, Prelevic G, Bennink HJ. Double-blind, placebo-controlled study of the effects of tibolone on bone mineral density in postmenopausal osteoporotic women with and without fractures. Gynecol Endocrinol 1999; 13(4): 230-237.
- 16. Kloosterboer HJ, Benedek-Jaszmann LJ, Kicovic PM. Long-term effects of Org OD 14 on lipid metabolism in postmenopasual women. Maturitas 1990; 12(1): 37-42.
- 17. Haenggi W, Lippuner K, Riesen W, Jaeger P, Birkhauser MH. Long-term influence of different postmenopausal hormone replacement regimens on serum lipids and lipoprotein(a): a randomised study. Br J Obstet Gynaecol 1997; 104(6): 708-717.
- 18. Bjarnason NH, Bjarnason K, Haarbo J, Bennink HJ, Chriatiansen C. Tibolone: influence on markers of cardiovascular disease. J Clin Endocrinol Metab 1997; 82(6): 1752-1756.
Fuentes
- 19. Castelo-Branco C, Casals E, Figueras F, Sanjuan A, Vicente JJ, Balasch J, Vanrell JA. Two-year prospective and comparative study of the effects of tibolone on lipid pattern, behaviour of apolopoproteins AI and B. Menopause 1999; 6(2): 92-97.
- 20. Walker ID, Davidson JF, Richards A, Yates R, MacEwan HP. The effect of the synthetic steroid Org OD 14 on fibrinolysis and blood lipids in postmenopausal women. Thromb Haemost 1985; 53(3): 303-305.
- 21. Prelevic GM, Beljic T, Ginsburg J. The effect of tibolone on cardiac flow in postmenopausal women with non-insulin dependent diabetes mellitus. Maturitas 1997; 27(1): 85-90.
- 22. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52 705 women with breast cancer and 108 411 women without breast cancer. Lancet 1997; 350: 1047-1059.
- 23. Kenemans P, Stampfer M. Hormone replacement therapy and breast cancer.European Journal of Obstetrics & Gynecology and Reproductive Biology 1996; 67: 1-4.
- 24. Ginsburg J, Prelevic G, Butler D, Okolo S. Clinical experience with tibolone (LivialÒ) over 8 years. Maturitas 1995; 21: 71-76.
- 25. Erel CT, Elter K, Akman C, Ersavasti G, Altug A, Seyisoglu H, Ertungealp E. Mammographic changes in women receiving tibolone therapy. Fertil Steril 1998; 69(5): 870-875.
- 26. Winkler UH, Helmond F, Coelingh Bennik H. Effects of Livial and Kliogest on climacteric symptoms and endocrinological parameters: a randomised double-blind study. Acta Obstet et Gynaecol Sacnd 1997; 76(Suppl 167: 5): 57 (Abstract P86.13).
- 27. Hammar M, Christau S, Nathorst-Böös J, Rud T, Garre K. A double-blind, randomised trial comparing the effects of tibolone and continuous combined hormone replacement therapy in postmenopausal women with menopausal symptoms. Br J Obstet Gynaecol 1998; 105(8): 904-911.
Referencias Bibliográficas
- 28. Valdivia I, Ortega D. A one year evaluation on mammary radiographic density (MxDx) changes with different HRTs regimens in climateric women. Acta Obstet et Gynaecol Scand 1997; 76 (Suppl 176: 2) (Abstract P48.8).
- 29. Genazzani AR, Benedek-Jaszmann LJ, Hart DM, Andolsek L, Kicovoc PM, Tax L. Org OD 14 and the endometrium. Maturitas 1991; 13(3): 243-251.
- 30. Ginsuburg J, Prelevic GM. Cause of vaginal bleeding in postmenopausal women taking tibolone. Maturitas 1996; 24(1-2): 107-110.
- 31. Meuwissen JH, Wiegerinck MA, Haverkorn MJ. Regression of endometrial thickness in combination with reduced withdrawal bleeding as a progestational effect of tibolone in postmenopausal women on oestrogen replacement therapy. Maturitas 1995; 21(2): 121-125.
- 32. Egarter C, Huber J, Leikermoser R, Haidbauer R, Pusch H, Fischl F, Putz M. Tibolone versus conjugated estrogens and sequential progestogen in the treatment of climacteric complaints. Maturitas 1996; 23(1): 55-62.
- 33. Receptores esteroideos y mecanismo de acción hormonal. Dirigido por Santiago Palacios. Ediciones Mirpal, Madrid 1996.
- 34. Tang B, Matrkiewicz L, Kloosterboer HJ, Gurpide E. Human endometrial 3 beta-hydroxystereroid dehydrogenase/isomerase can locally reduce intrinsic estrogenic/progestagenic activity ratios of a esteroidal drug (Org OD 14). J Steroid Biochem Biol 1993; 45(5): 345-351.
- 35. Markiewicz L, Gurpide E. In vitro evaluation of estrogenic, estrogen antagonist and progestagenic effects of a steroidal drug (Org OD-14) and its metabolites on human endometrium. J Steroid Biochem 1990; 35(5): 535-541.
- 36. Dubik D, Dembinski TC, Shiu RP. Stimulation of c-myc oncogene expression associated with estrogen-induced proliferation of human breast cancer cells. Cancer Res 1987; 47: 6517-6521.
- 37. Dickson RB, Lippman ME. Estrogenic regulation of growth and polypeptide growth factor secretion in human breast carcinoma. Endocr Rev 1987; 8(1): 29-43.
Fuentes Bibliográficas
- 38. Weisz A, Bresciani F. Estrogen induces expression of c-fos and c-myc proto-oncogenes in rat uterus. Molec Endocrinol 1988; 2(9): 816-824.
- 39. Leygue E, Gol-Winkler R, Gompel A, Louis-Sylvestre C, Soquet L, Staub S, Kuttenn F, Mauvais-Jarvis P. Estradiol stimulates c-myc proto-oncogene expression in normal human breast epithelial cells in culture. J Steroid Biochem Mol Biol 1995; 52(4): 299-305.
- 40. Santos GF, Scott GK, Lee WM, Liu E, Benz C. Estrogen-induced post-transcriptional modulation of c-myc proto-oncogene expression in human breast cancer cells. J Biol Chem 1988; 263(20): 9565-9568.
- 41. Dubik D, Shiu RP. Transcriptional regulation of c-myc oncogene expression by estrogen in hormone-responsive human breast cancer cells. J Biol Chem 1988; 263(25): 12705-12708.
- 42. van der Burg B, van Selm-Mitelnburg AJ, de Laat SW, van Zoelen EJ. Direct effects of estrogen on c-fos and c-myc proto-oncogene expression and cellular proliferation in human breast cancer cells. Mol Cell Endocrinol 1989; 64(21): 223-228.
- 43. Gompel A, Kandouz M, Siromachkova M, Lombet A, Thevenin D, Mimoun M, Poitout Ph. The effect of tibolone on proliferation, differentation and apoptosis in normal breast cells. Gynecol Endocrinol 1997; 11(Suppl 1): 77-79.
- 44. Gompel A, Kandouz M, Siromachkova M, Thevenin D, Lombet A, Rostene W, Poitout Ph. Tibolone (Org OD14) actions on normal and breast cancer cells. In: 16th World Congress on Fertility and Sterility and the 54th Annual Meeting of the American Society for Reproductive Medicine. San Francisco, California, 1998. (Abstract P-191).
- 45. Kloosterboer HJ, Schoonen WG, Deckers GH, Klijn JG. Effects of progestagens and Org OD14 in in vitro and in vivo tumor models. J Steroid Biochem Mol Biol 1994; 49(4-6): 311-318.
Otras Bibliografías
- 46. Kloosterboer HJ, Deckers GH. Effects of Tibolone (LivialÒ) and its metabolites on the growth of DMBA induced tumors in rats. Acta Obstet et Gynaecol Scand 1997; 76(Suppl167: 5): 59 (Abstract P86.23).
- 47. Pasqualini JR, Chetrite G. Control of estrone sulfatase activity in human breast cancer cells: effect of tibolone and its metabolites. Gynecol Endocrinol 1997; 11(Suppl.1): 69-75.
- 48. Chetrite G, Kloosterboer HJ, Pasqualini JR. Effect of tibolone (Org OD14) and its metabolites on estrone sulphatase activity in MCF-7 and T-47D mammary cancer cells. Anticancer Res 1997; 17(1A): 135-140.
- 49. Pasqualini JR, Kloosterboer HJ. Estrone sulfatase and 17b-hydroxysteroid dehydrogenase activities in human breast cancer. Inhibitory effect by tibolone and its metabolites. Acta Obstet et Gynaecol Scand 1997; 76(Suppl 167: 3): 35 (Abstract FC613.6).
- 50. Chetrite G, Paris J, Botella J, Pasqualini JR. Effect of nomegestrol acetate on estrone-sulfatase and 17beta-hydroxysteroid dehydrogenase activities in human breast cancer cells. J Steroid Biochem Mol Biol 1996; 58(5-6): 525-531.