Resultados en el uso actual de THM
A continuación, se resumen los hallazgos principales publicados en relación con los riesgos y beneficios en el uso actual de THM en relación con neoplasias malignas diferentes al cáncer de mama.
1.Cáncer de pulmón.
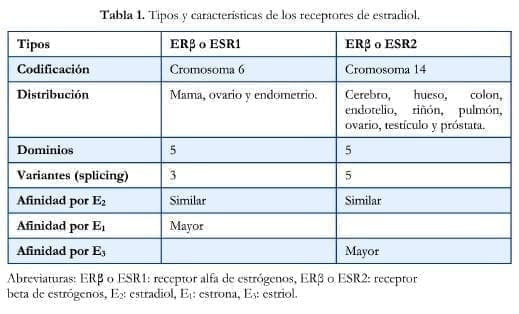
Se ha encontrado que el Ca de pulmón que se presenta en no fumadores es más frecuente en mujeres y que el tipo histológico predominante es el adenocarcinoma. En estos tumores se ha observado que predomina el receptor beta de estrógenos (ERb). En la tabla 1 se muestran las características de los receptores de estrógenos.
Los resultados de los estudios epidemiológicos sobre el riesgo de desarrollar Ca del pulmón han sido contradictorios. Algunos estudios sobre la mortalidad por Ca de pulmón han señalado aumento asociado al uso de THM.
Un análisis secundario del estudio WHI8 encontró que el uso previo de THM combinada por menos de 5 años disminuía el riesgo de todos los cánceres pulmonares (HR 0.84; IC95%: 0.78- 0.98) y que el uso de cualquier hormona por 5 a menos de 10 años disminuía el riesgo de Ca de células no pequeñas (HR: 0,84; IC95%: 0,71- 0,99). Un meta-análisis de 14 estudios de cohorte9 encontró que no hay aumento del riesgo de Ca de pulmón con el uso de THM (resumen del efecto estimado: 0,99; IC95%: 0,90-1,09).
2. Cáncer de esófago.
El adenocarcinoma de esófago es nueve veces más frecuente en hombres que en mujeres y la razón hombre/ mujer es particularmente alta en la edad reproductiva.
Un metaanálisis10 que incluyó dos estudios de cohortes, dos de casos y controles y uno que agrupaba cuatro estudios de casos y controles encontró que el uso alguna vez de THM disminuye el riesgo de adenocarcinoma de esófago (OR: 0,75; IC95%: 0,58-0,98) en comparación con el no uso de THM. Con base en ello se ha considerado como una de las oportunidades de prevención del adenocarcinoma de esófago11.
3. Cáncer de páncreas.
La incidencia de Ca de páncreas es discretamente mayor en hombres que en mujeres y la administración de hormonas sexuales a ratas castradas inhibe el desarrollo y crecimiento de lesiones preneoplásicas del páncreas.
Un análisis que agrupó 11 estudios de casos y controles del Consorcio Internacional de Casos-Controles de Cáncer Pancreático (PanC4)12 encontró que el uso de THM no modificaba el riesgo de Ca de páncreas (OR: 0,84; IC95%: 0,64-1,10), y que la histerectomía más uso de THM reducía el riesgo (OR: 0,64; IC95%: 0,48-0,84).
Así mismo, el Estudio Malmö de Dieta y Cáncer13, un estudio de cohorte prospectiva de base poblacional, encontró que el uso alguna vez de terapia estrogénica (TE) disminuyó el riesgo de Ca de páncreas (HR ajustado por edad: 0,21; IC95%: 0,05-0,87; HR ajustado por edad, fumar, consumo de alcohol e índice de masa corporal: 0,22; IC95%: 0,05-0,90); el uso alguna vez de THM disminuyó el riesgo ajustado solo por edad (HR: 0,47; IC95%: 0,23-0,97) y no se modificaron los riesgos ajustados con el uso de progestinas solas o de estrógenos más progestinas (tabla 2).
4. Cáncer colorrectal.
El Ca de colon es más frecuente en hombres en todos los grupos etarios y la mortalidad por Ca de colon es menor en mujeres, especialmente en mujeres premenopáusicas. El efecto protector de los estrógenos se ejercería previniendo la pérdida del ERb. En el estudio WHI se encontró una disminución del riesgo de Ca de colon (RR: 0,44; IC 95%: 0,38- 0,81). Un análisis secundario de este estudio14 mostró que la TE sola no modifica significativamente la incidencia (HR: 1,13; IC 95%: 0,83-1,58) ni la mortalidad por Ca de colon (HR: 1.46; IC 95%: 0,86-2,46).
Riesgo de Ca colorrectal y el uso actual de THM
Un estudio de una cohorte multiétnica15 encontró disminución del riesgo de Ca colorrectal con el uso previo (HR: 0,87; IC 95%: 0,78-0,97) y el uso actual de THM (HR: 0,75; IC 95%: 0,66-0,84) cuando se compara con el no uso. Así mismo, se encontró reducción del riesgo de Ca colorrectal con el uso de TE solo (HR: 0,85; IC 95%: 0,76- 0,94) y con THM combinada (HR: 0,76; IC 95%: 0,68-0,86) (tabla 3).
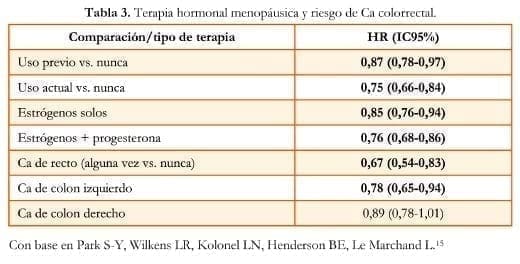
Ca de recto solo con el uso actual de THM
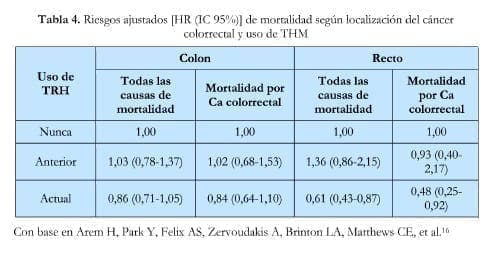
Por otro lado, el Estudio de Dieta y Salud NIH-AARP16 encontró reducción significativa de la mortalidad específica por Ca de recto solo con el uso actual de THM (HR: 0,48; IC 95%: 0,25-0,92), sin modificación del riesgo de mortalidad específica por Ca de colon o de recto con el uso anterior o del Ca de colon con el uso actual de THM (tabla 4).
5. Neoplasias linfoides y mieloproliferativas.
Se han encontrado receptores de estrógenos en células de origen linfoide y mieloide, así como de leucemia y linfoma. Los estrógenos son inmunomoduladores y tienen efectos sobre la diferenciación, división y apoptosis celulares, incluyendo al de las células hematopoyéticas, así como sobre la producción de citocinas. Se han publicado resultados contradictorios sobre la asociación entre THM y el riesgo de linfomas.
Un análisis post hoc del WHI17 no encontró asociación entre linfoma no Hodgkin y TE sola con estrógenos equinos conjugados (HR: 1,02; IC 95%: 0,74-1,39), TRH combinada con estrógenos equinos conjugados más acetato de medroxiprogesterona (HR: 0,98, IC 95%: 0,76-1,28) o ambas combinadas (HR: 1,00, IC 95%: 0,82-1,22) en comparación con placebo. Tampoco se encontró asociación entre THM y leucemia mieloide aguda del adulto (OR: 1,03, IC 95%: 0,67-1,57 para usuarias previas y OR: 0,80; IC 95%: 0,39-1,61 para usuarias actuales de TRH)18.
En cuanto al mieloma múltiple, un análisis agrupado de siete estudios de casos y controles encontró que no hay asociación con el uso de THM posmenopáusica (OR: 0,65; IC 95%: 0,37-1,15) aunque había heterogeneidad entre los estudios19.
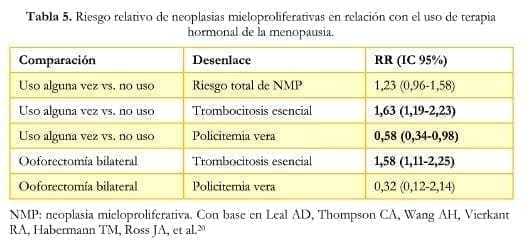
Un estudio de cohorte de base poblacional20 señala que la THM no modifica el riesgo total de neoplasias mieloproliferativas (RR: 1,23, IC 95%: 0,96-1,58), mientras que el análisis individual muestra que aumenta el riesgo de trombocitosis esencial (RR: 1,63, IC 95%: 1,19- 2,23) y disminuye el de policitemia vera (RR: 0,58, IC 95%: 0,34-0,98), reforzando la idea de que se trata de dos entidades de fisiopatología diferente (tabla 5).
6. Glioma.
La incidencia de gliomas es mayor en hombres que en mujeres. Se han encontrado receptores de hormonas sexuales en células gliales tanto benignas como malignas.
Un análisis que agrupó los resultados de tres estudios de casos y controles21 encontró no solo que el uso alguna vez de THM disminuye el riesgo de padecer glioma (OR: 0,55; IC 95%: 0,44-0,68) sino que existe una tendencia estadísticamente significativa de reducción del riesgo a medida que aumenta el tiempo de uso, así: uso por menos de un año: OR 0,83 (IC 95%: 0,57-1,20); uso entre uno y cinco años: OR: 0,60 (IC 95%: 0,43-0,83); uso entre seis y 10 años: OR: 0,55 (IC 95%: 0,37-0,80) y uso por más de 10 años: OR: 0,53 (IC 95%: 0,40- 0,72). (Tabla 6).

7. Meningioma.
La incidencia de meningioma es dos veces más alta en mujeres que en hombres y la tasa de crecimiento de estos tumores aumenta en la vida reproductiva. Se han identificado receptores de estrógenos y progesterona en los meningiomas y se ha reportado una asociación entre meningiomas y Ca de mama.
Un metaanálisis de estudios de cohorte y de casos y controles22, la mayoría estudios retrospectivos, encontró un discreto aumento del riesgo de meningioma con el uso de THM; RR: 1,19; IC 95%: 1,01-1,40); el riesgo fue mayor en el subgrupo de los cinco estudios prospectivos incluidos (RR: 1,27; IC 95%: 1,16-1,39), mientras que no se encontró asociación en el subgrupo de los nueve estudios retrospectivos (RR: 1,11; IC 95%: 0,83-1,48).
8. Cáncer de endometrio.
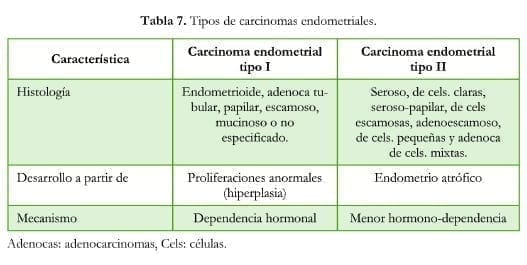
Existen dos tipos de carcinoma endometrial: el tipo I que se desarrolla a partir de proliferaciones anormales (hiperplasia endometrial) y tiene dependencia hormonal y el tipo II que surge en endometrios atróficos y tiene menor dependencia hormonal. Estos dos tipos de carcinomas también presentan diferencias histológicas (tabla 7).
El estudio de un millón de mujeres examinó la asociación entre TRH combinada y Ca de endometrio, encontrando una reducción del riesgo (RR: 0,71, IC 95%: 0,56-0,90)23.
Sin embargo, un estudio danés de cohorte24 encontró que la TRH combinada continua era la única que reducía el riesgo de carcinoma endometrial tipo II (RR: 0,45, IC 95%: 0,20-1,01), mientras que no modificó el riesgo del carcinoma tipo I (RR: 1,09, IC: 0,92-1,30). Como era de esperarse, la TE sola aumentó el riesgo de carcinoma tipo I (RR: 2,95, IC 95%: 2,61-3,33), sin modificar el riesgo del carcinoma tipo II.
La TRH combinada de ciclo largo se asoció con aumento del riesgo del carcinoma tipo I (RR: 3,25, IC 95%: 2,52- 4,29), sin modificar el del tipo II, mientras que la TRH combinada cíclica se asoció con aumento del riesgo de ambos tipos (tipo I: RR: 2.16, IC 95%: 1,94-2,10 y tipo II: RR: 1,81, IC 95%: 1,26-2,81). (tabla 8).
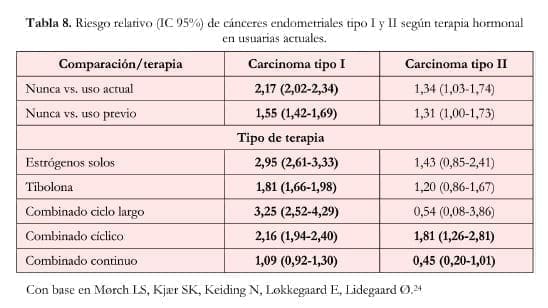
Además, un análisis de extensión del WHI[25] mostró que la TRH combinada con estrógenos equinos conjugados y acetato de medroxiprogesterona disminuyó el riesgo de carcinoma endometrial (HR: 0,65; IC 95%: 0,48-0,89).
9. Carcinoma de ovario.
Los estrógenos pueden aumentar la proliferación y transformación de células premalignas y malignas de ovario y podrían interactuar con variantes de susceptibilidad genética.
Un metaanálisis que incluyó 13 estudios de base poblacional mostró que la TE sola se asoció con aumento el riesgo de Ca de ovario (RR por cinco años de uso: 1,22; IC 95%: 1,18-1,27); así mismo, hubo un aumento del riesgo, aunque menor, asociado con la THM combinada (RR por cinco años de uso: 1,10; IC 95%: 1,04-1,16)26.
Otra investigación, que consolida datos de 10 estudios de casos y controles27, mostró que el uso de TE sola se asocia con aumento del riesgo de Ca de ovario (OR: 1,30, IC 95%: 1,06- 1,59) y que el uso actual/reciente de TE se asocia con aumento del riesgo de los tipos seroso (OR: 1,63, IC 95%: 1,27-2,09) y endometrioide de Ca ovárico (OR: 2,00, IC 95%: 1,17-3,41); en este estudio no hubo asociación significativa con los tumores mucinosos ni los de células claras (tabla 9).
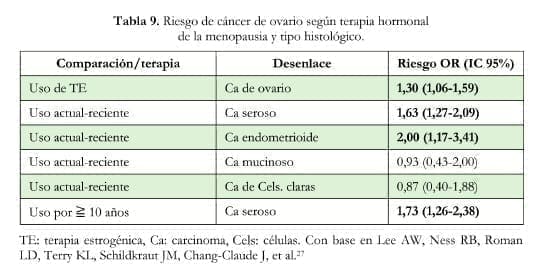
uso actual de THM y Ca de ovario
En este mismo sentido están los resultados de un metaanálisis de bases de datos de 52 estudios epidemiológicos28 que mostró una asociación positiva entre el uso actual de THM y Ca de ovario (uso tanto en los estudios prospectivos como en los retrospectivos; mientras que no hubo asociación significativa entre THM con estrógenos solos o con estrógenos más progestinas y el riesgo de tumores de células claras o de tumores mucinosos.
10. Cáncer de tiroides.
El Ca papilar de tiroides alcanza su pico de incidencia en el periodo reproductivo de la mujer. En los hombres, por el contrario, la incidencia de Ca papilar de tiroides aumenta con el incremento de la edad.
La incidencia es tres veces más alta en mujeres que en hombres. Se conoce, además, que los estrógenos y el receptor de estrógenos juegan un papel en el crecimiento de la glándula tiroides al estimular la secreción de TSH; así mismo, los estrógenos influyen en la proliferación e invasión de células malignas modulando vías de señalización de crecimiento y función tiroideas.
Una revisión sistemática que incluyó nueve estudios encontró que no hay una asociación estadísticamente significativa entre el uso de THM y el riesgo de Ca de tiroides (RR: 1,07; IC 95%: 0,91-1,25, para todos los estudios, y RR: 1,09; IC 95%: 0,89-1,25, para los estudios de cohorte)29.
11. Melanoma maligno.
Se han encontrado receptores estrogénicos en los keratinocitos y, de acuerdo con estudios preclínicos y clínicos, los estrógenos pueden estar relacionados con el desarrollo de cáncer de piel. En el estudio WHI se observó que la incidencia de Ca de piel de tipo no melanoma fue similar entre los grupos de THM combinada (HR: 0,95; IC 95%: 0,83- 1,07) o TE sola (HR: 1.03; IC 95%: 0,89- 1,18) y el grupo placebo.
De igual forma, tampoco hubo diferencias en la tasa de incidencia de Ca de piel tipo melanoma entre la THM combinada (HR: 0,96; IC 95%: 0,57-1,61) o la TE sola (HR: 0,85; IC 95%: 0,45-1,61) en comparación con el placebo30.
Riesgo de melanoma maligno con el uso actual de THM
Sin embargo, un estudio de cohorte realizado en Noruega que incluyó a 684.696 mujeres entre 45 y 79 años, que fueron seguidas desde 2004 hasta 2008 (en promedio 4,8 años de seguimiento), en el cual se identificaron 1.476 casos incidentes de melanoma maligno, encontró un aumento estadísticamente significativo del riesgo de melanoma maligno con el uso actual de THM (RR:1,19, IC 95%: 1,03-1,37), con la TE sola (RR: 1,49, IC 95%: 1,21-1,73), con la TE oral (RR: 1,45;,IC 95%: 1,09-1,93) y la TE por vía vaginal (RR:1,44, IC 95%: 1,14-1,84), mientras que no hubo asociación significativa con la THM combinada (RR: 0,91, IC 95%: 0,70-1,19) y hubo disminución del riesgo con la THM combinada con 10 mg/mes de la progestina (RR: 0,71, IC 95%: 0,57-0,89)31 (tabla 10).

Discusión y conclusiones
El efecto de la THM sobre el riesgo de diversas neoplasias malignas es un campo nuevo y fascinante de la investigación básica, epidemiológica y clínica.
Considerando la calidad de la evidencia primaria de una buena parte de los estudios incluidos en revisiones sistemáticas, las dificultades metodológicas, la baja incidencia de los desenlaces aquí planteados y los resultados controversiales de las investigaciones publicadas hasta el momento, el médico debe tener una actitud crítica ante los hallazgos, considerar que se trata de evidencia preliminar y estar atento a nuevas pruebas científicas acerca de las asociaciones entre TRH y diferentes tipos de cáncer. La tabla 11 resume la evidencia consultada.
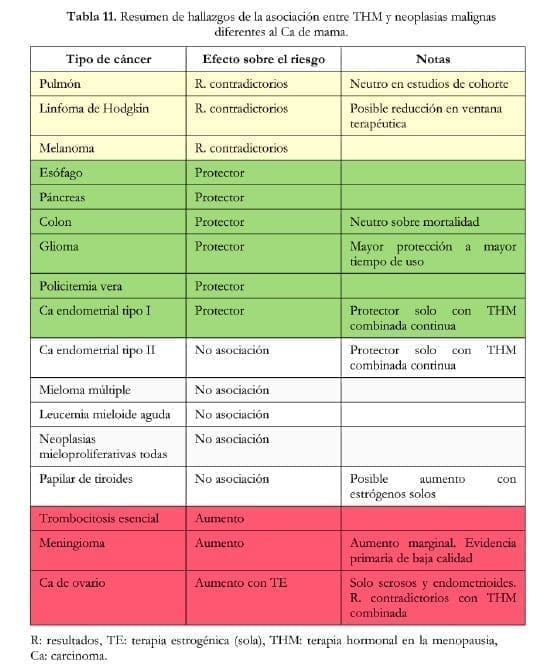
La prescripción de THM debe ser altamente particularizada teniendo en cuenta también factores de riesgo o protectores para diferentes neoplasias malignas.
El entendimiento de los mecanismos de acción de las hormonas sexuales permitirá el desarrollo futuro de nuevas intervenciones terapéuticas para neoplasias malignas de diferentes tipos, lo que sin duda formará parte de la medicina individualizada.
Conflicto de interés
Declaro no tenerlo.
Financiación
No hubo.
Agradecimientos
A la Universidad Nacional de Colombia por el tiempo disponible para llevar a cabo la revisión y por el uso de las bases de datos del Sistema Nacional de Bibliotecas.
Referencias
-
1 Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, Jackson RD, Beresford SA, Howard BV, Johnson KC, Kotchen JM, Ockene J; Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288(3):321-33.
-
2 Collaborative Group on Hormonal Factors in Breast Cancer*. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. www.thelancet.com Published online August 29, 2019 http://dx.doi.org/10.1016/S0140-6736(19)31709-X.
-
3 Karvinen S, Jergenson MJ, Hyvärinen M, Aukee P, Tammelin T, Sipilä S, et al. Menopausal status and physical activity are independently associated with cardiovascular risk factors of healthy middle-aged women: cross-sectional and longitudinal evidence. Front Endocrinol (Lausanne). 2019 Aug 30;10:589. doi: 10.3389/ fendo.2019.00589. eCollection 2019.
-
4 Shuster LT, Rhodes DJ, Gostout BS, Grossardt BR, Rocca WA. Premature menopause or early menopause: long-term health consequences. Maturitas. 2010;65:161-6.
-
5 Malek AM, Vladutiu CJ, Meyer ML, Cushman M, Newman R, Lisabeth LD, et al. The association of age at menopause and all-cause and cause-specific mortality by race, postmenopausal hormone use, and smoking status. Prev Med Rep. 2019 Jul 14;15:100955. doi: 10.1016/j.pmedr.2019.100955. eCollec tion 2019 Sep.
-
6 Farlay D, Bala Y, Rizzo S, Bare S, Lappe JM, Recker R, et al. Bone remodeling and bone matrix quality before and after menopause in healthy women. Bone. 2019; 128:115030.
-
7 Cobin RH, Goodman NF, on behalf if the AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College or Endocrinology Position Statement on Menopause 2017 Update. Endocr Pract. 2017; 23(7):869-1488.
-
8 Schwartz AG, Ray RM, Cote ML, Abrams J, Sokol RJ, Hendrix SL, et al. Hormone use, reproductive history and risk of lung cancer: The Women’s Health Initiative Studies. J Thorac Oncol. 2015; 10(7): 1004-13.
-
9 Bae J-M, Kim BE. Hormonal replacement therapy and the risk of lung cancer in women: an adaptive meta-analysis of cohort studies. J Prev Med Public Health. 2015; 48: 280-6.
-
10 Lagergren K, Lagergren J, Brusselaers N. Hormone replacement therapy and oral contraceptives and risk of oesophageal adenocarcinoma: a systematic review and metaanalysis. Int J Cancer. 2014; 135: 2183-90.
-
11 Maret-Ouda J, El-Serag HB, Lagergren J. Opportunities for preventing esophageal adenocarcinoma. Cancer Prevention Res. Published Online First September 13, 2016. DOI: 10.1158/1940-6207.CAPR-16-0170.
-
12 Lujan-Barroso L, Zhang W, Olson SH, Gao Yu-Tang, Yu Herbert, Baghurst PA. Menstrual and reproductive factors, hormone use and risk of pancreatic cancer: analysis from the International Pancreatic Cancer Case-Control Consortium (Pan4). Pancreas. 2016; 45(10): 1401-10.
-
13] Andersson G, Borgquist S, Jirström K. Hormonal factor and pancreatic cancer risk in women: The Malmö Diet and Cancer Study. Int J Cancer. 2018 Feb 9. DOI: 10.1002/ ijc.31302.
-
14 Lavasani S, Chlebowski RT, Prentice RL, Kato I, Wactawski-Wende J, Johnson KC, et al. Estrogen and colorectal cancer incidence and mortality. Cancer. 2015; 121:3261-71.
-
15 Park S-Y, Wilkens LR, Kolonel LN, Henderson BE, Le Marchand L. Inverse associations of dietary fiber and menopausal hormone therapy with colorectal cancer risk in the Multiethnic Cohort Study. Int J Cancer. 2016; 139(6): 1241-50.
-
16 Arem H, Park Y, Felix AS, Zervoudakis A, Brinton LA, Matthews CE, et al. Reproductive and hormonal factors and mortality among women with colorectal cancer in the NIHAARP Diet and Health Study. B J Cancer. 2015; 113: 562-8.
-
17 Kato I, Chlebowski RT, Hou L, WactawskiWende J, Ray RM, Abrams J, et al. Menopausal estrogen therapy and non-Hodgkin’s lymphoma: a post-hoc analysis of women’s health initiative randomized clinical trial. Int J Cancer. 2016; 138: 604-11.
-
18 Poynter JN, Fonstad R, Blair CK, Roesler M, Cerhan JR, Hirsch B, et al. Exogenous hormone use, reproductive history and risk of adult myeloid leukaemia. B J Cancer. 2013: 109: 1895-8.
-
19 Costas L. Lambert BH, Birmann BM, Moysich KB, De Rooss AJ, Hofmann JN, et al. A pooled analysis of reproductive factors, exogenous hormone use and risk of multiple myeloma among women in the International Multiple Myeloma Consortium. Cancer Epidemiol Biomarkers Prev. 2016; 25(1): 217-21.
-
20 Leal AD, Thompson CA, Wang AH, Vierkant RA, Habermann TM, Ross JA, et al. Hormonal and reproductive factors and risk of myeloproliferative neoplasms in postmenopausal women. Cancer Epidemiol Biomarkers Prev. 2016; 25(1): 151-7.
-
21 Krishnamachari B, Ilyasova D, Scheurer ME, Bondy M, Wrensch M, Davis F. A pooled multisite analysis of the effects of female reproductive hormones on glioma risk. Cancer Causes Control. 2014; 25(8): 1007-13.
-
22 Qi Z-Y, Shao C, Huang Y-L, Hui G-Z, Zhou Y-X, Wang Z. Reproductive and exogenous hormone factors in relation to risk of meningioma in women: a meta-analysis. PLoS One. 2013; 8(12): e83261.
-
23 Beral V, Bull D, Reeves G; Million Women Study Collaborators. Endometrial cancer and hormone-replacement therapy in the Million Women Study. Lancet (London, England). 2005; 365(9470): 1543-51.
-
24 Mørch LS, Kjær SK, Keiding N, Løkkegaard E, Lidegaard Ø. The influence of hormone therapies on type I and II endometrial cancer: a nationwide cohort study. Int J Cancer. 2016: 138: 1506-15.
-
25 Chlebowski RT, Anderson GL, Sarto GE, Haque SR, Runowicz CD, Aragaki AK, et al. Continuous combined estrogen plus progestin and endometrial cancer: The Women’s Health Initiative Randomized Trial. J Natl Cancer Inst. 2016; 108(3): djv350. DOI: 10.1093/ jnci/adv350.
-
26 Pearce CL, Chung K, Pike MC, Wu AH. Increased ovarian cancer risk associated with menopausal estrogen therapy is reduced by adding a progestin. Cancer. 2009; 115(3): 531-9.
-
27 Lee AW, Ness RB, Roman LD, Terry KL, Schildkraut JM, Chang-Claude J, et al. Association between menopausal estrogenonly therapy and ovarian carcinoma risk. Obstet Gynecol. 2016; 127(5): 828-36.
-
28 Collaborative Group on Epidemiological Studies of Ovarian Cancer. Menopausal hormone use and ovarian cancer risk: individual participant meta-analysis of 52 epidemiological studies. Lancet. 2015; 385(9980): 1835-42.
-
29 Wang P, Lv L, Qi F, Qiu F. Increased risk of papillary thyroid cancer related to hormonal factors in women. Tumor Biol. 2015; 36(7): 5127-5132.
-
30 Tang JY, Spaunhurst KM, Chlebowski RT, Wactawski-Wende J, Keiser E, Thomas F, et al. Menopausal hormone therapy and risks of melanoma and nonmelanoma skin cancers: women’s health initiative randomized trials. J Natl Cancer Inst. 2011;103(19):1469- 75.
-
31 Botteri E, Støer NC, Sakshaug S, GraffIversen S, Vangen S, Hofvind S, et al. Menopausal hormone therapy and risk of melanoma: Do estrogens and progestins have a different role? Int J Cancer. 2017. 1;141(9):1763-70.
Le puede interesar:
- Tipo y Momento de la Terapia Hormonal de la Menopausia y el Riesgo de Cáncer de Mama
- Terapia Hormonal de la Menopausia en el Año 2021
- Comunicado: Pronunciamiento de la Asociación Colombiana de Menopausia Respecto al Uso de Terapia Hormonal en la Menopausia. Noviembre de 2004
- La Terapia Hormonal en la Menopausia es Neutral en la Mortalidad por todas las Causas a Largo Plazo
- Terapia Hormonal en la Menopausia y Cánceres Diferentes al Cáncer de Mama. Riesgos y Beneficios