Deficiencia de 21á-hidroxilasa. A propósito de un caso
La hiperplasia suprarrenal congénita se define, como todas aquellas enfermedades de origen genético en las que se produce un error en la esteroidogénesis suprarrenal debido a la deficiencia en la actividad de algunas de las enzimas necesarias para la síntesis de cortisol 1.
El primer caso fue reconocido desde 1895, cuando el cirujano-anatomista Luigi de Crecchio, en Italia, encontró en la autopsia de un hombre de 40 años un pene de 6cm de longitud con hipospadias Grado I.
No halló testículos, pero si organos genitales femeninos y glándulas adrenales de gran tamaño lo que después se pudo correlacionar con una deficiencia de la enzima 21á-hidroxilasa 1.
Una serie de directrices sobre la hiperplasia suprarrenal congénita ha sido publicada; la mayoría se han centrado la hiperplasia suprarrenal congénita clásica (HAC).
Sin embargo, en muchos sentidos la hiperplasia suprarrenal no clásica (HACN) difiere significativamente de la HAC no solo por su presentación clínica posterior y disímil, sino también por la necesidad de consideraciones distintas con respecto a la terapia.
Caso clínico (Fig. 1)
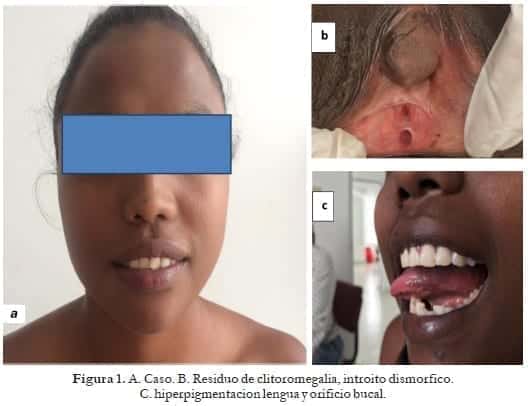
Se tiene una mujer joven de 19 años afrodescendiente, que se presenta al servicio de ginecología desde el 2014 con un cuadro clínico caracterizado por amenorrea secundaria, asociado a hipodesarrollo de caracteres sexuales secundarios y genitales externos ambiguos, con antecedente de clitoroplastia en 1988.
Al examen físico se encontró una llamativa hiperpigmentación en cara y mucosas; desarrollo mamario Tanner I; genitales externos con: clitoromegalia más hipoplasia vaginal. Se solicitan paraclínicos. Trae: una ecografía pélvica transabdominal: 28/ 08/2014 donde se evidencia un útero en AVF que mide 6.1×1.3×2.3 cm de aspecto prepuber sin evidencia de eco endometrial. Ovario derecho de 36x17x18 mm con múltiples folículos periféricos.
Ovario izquierdo de 25×14 mm; resonancia magnética nuclear de pelvis: útero disminuido de tamaño para la edad, con endometrio lineal, hallazgos compatibles con hipoplasia uterina, ambos ovarios visibles de tamaño normal con múltiples folículos. En la secuencia sagital T2 con saturación grasa, se identifica vagina en relación con el cuello uterino.
Se decide por lo anterior realizar un cariotipo dando como resultado 46XX.
Se toman pruebas hormonales: 17 OH hidroxiprogesterona: 248 ng/ml (<200ng/ml)testosterona total 17.7ng/dl,(2-47ng/dl), DHEA: 1,4mg/ dl(2,0-535 μg/dl) y aldosterona 32.59 ng/ml, (4- 31 ng/dL), se hace el diagnóstico de hiperplasia suprarrenal congénita y se inicia manejo con Prednisolona 15mg/día, Fluorocortisona 0.15mg/ día, Estrógenos conjugados 0.625mg/día y Medroxiprogesterona 5mg/día 10 días al mes, con lo cual la paciente ha logrado mejor desarrollo de caracteres sexuales secundarios.
Hiperplasia Suprarrenal Congénita
La hiperplasia suprarrenal congénita constituye la enfermedad metabólica hereditaria más frecuente.
La hiperplasia suprarrenal congénita no-clásica hiperandrogénica (HACN) puede estar asociada con tres defectos enzimáticos distintos: (a) defectos de 21-hidroxilasa (21-OH), catalizada por el citocromo P450c21A2, codificado por CYP21A2; (b) defectos de actividad 11â-hidroxilasa (11-OH), catalizado por el citocromo P450c11, codificado por CYP11B1; y C) defectos de la actividad 3â-hidroxiesteroide deshidrogenasa (3â-HSD), catalizada por el tipo II3â-HSD, codificado por HSD3B2 y de estas el déficit de la enzima 21á- hidroxilasa es la causa más frecuente lo que corresponde aproximadamente entre el 90% al 95% de los casos.
Se estima que la prevalencia en los afectados es de 1/15.000-1/20.0000, pero si tenemos en cuenta todos los portadores de la mutación la prevalencia podría ser tan alta como 1:50-1:60, especialmente en algunos grupos étnico como en las regiones remotas de Alaska donde encontramos la población más afectada1. En un metaanálisis reciente ha promediado de múltiples estudios, una prevalencia del 4.2%4.
La prevalencia estimada para HACN en judíos Ashkenazi de 3.7%m hispanos 1.9% y 0.1% en la población caucásica.
Genéticamente la deficiencia de 21á-Hidroxilasa es una enfermedad autosómica recesiva, por lo cual para expresar su manifestación clínica debe tener siempre los dos alelos (el materno y el paterno) afectados, de lo contrario será simplemente portador de la enfermedad.
Así mismo esto significa que el tener un hijo con hiperplasia suprarrenal congénita da un riesgo de hasta un 25% de tener un nuevo hijo afectado.
Desorden autosómico
La HACN es un desorden autosómico recesivo debido a la mutación del gen 21-hydroxylase (CYP21A2) resultando en una reducción del 30% al 50% de la actividad de la enzima.
Estudios a nivel del genoma humano han encontrado que mutaciones en el gen CYP21 (también llamado CYP21A2), localizadas en la región altamente polimórfica del complejo mayor de histocompatibilidad (HLA) en el cromosoma 6p21.3 serían las causantes de la enfermedad.
La genotipificación de individuos con hiperplasia suprarrenal congénita está llena de errores debido a la complejidad de las duplicaciones, deleciones y reordenamientos dentro del cromosoma 6.
Se conocen más de 100 mutaciones del gen CYP21A2; de importancia clínica se ha visto en aproximadamente 50% de las formas clásicas de la enfermedad grandes deleciones y mutaciones de empalme, como las del extremo del intrón 2, donde hay una sustitución de una citocina por una guanina, lo que provoca el empalme prematuro del intrón y un cambio en el marco de lectura translacional.
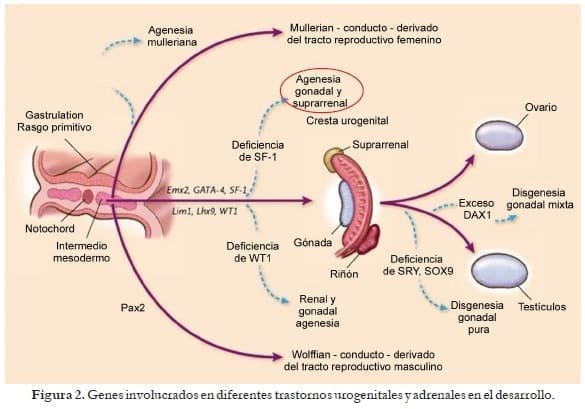
Podemos tener otros errores genéticos como la sustitución no conservativa de aminoácidos, como la presentada en aproximadamente 1% a 2% de la forma clásica virilizante simple en el exón 4 (sustitución de una Isoleucina 172 por una Asparagina) o las del exón 7 (Valina 281 Leucina) presentada en la forma no clásica y que permite conservar del 20% al 50% de la función enzimática1. Figura 2.
Hablando específicamente de la la deficiencia de 21á-Hidroxilasa ¿qué es lo que tenemos?
Recordemos que la síntesis de esteroides por la glándula suprarrenal se da a partir del colesterol, el cual, por una serie de reacciones enzimáticas, da origen a los mineralocorticoides, glucocorticoides y los esteroides sexuales.
Todo este proceso se genera específicamente en cada una de sus tres zonas, donde la zona glomerulosa se encarga de la síntesis de mineralocorticoides: aldosterona y deoxicorticosterona, la zona fasciculada de los glucocorticoides: cortisol y corticosterona, y la zona reticular de los esteroides sexuales: dehidroepiandrosterona, dehidroepiandrosterona sulfato y androstendiona.
Para que cada zona sea definida, se requiere de enzimas específicas, y en el caso de la 21á-hidroxilasa se encuentra tanto en la zona glomerulosa donde cataliza la conversión de progesterona a deoxicorticosterona que será el precursor de la aldosterona y en la zona fasciculada donde cataliza la conversión de 17OH–hidroxiprogesterona a 11–deoxicortisol que posteriormente por la 11â-hidroxilasa se convertirá en cortisol.
No se encuentra en la zona reticular por lo cual no tiene impacto sobre la síntesis de esteroides sexuales, de ahí que su deficiencia afecta básicamente la producción de glucocorticoides y mineralocorticoides y no la de los esteroides sexuales.
De hecho estos últimos sufren un aumento en su producción ya que se origina un aumento de todos los productos previos a dicho bloqueo, sustratos que se canalizan hacia la producción de esteroides sexuales. (Fig. 3)

Autores
*GUSTAVO GÓMEZ TABARES. Endocrinología Ginecológica. Departamento de OB-GIN. Profesor titular y distinguido. Universidad del Valle.
** ALEJANDRA VÉLEZ. Residente rotante por Endocrinología Ginecológica. Departamento de OB-GIN. Universidad del Valle.