3.1. Origen de los Síntomas Vasomotores. Teorías Actuales
La fisiopatología de los síntomas vasomotores propios del síndrome climatérico, se explica por un trastorno hormonal, que conlleva a un disbalance de neurotransmisores y neuroesteroide en el nivel del sistema nervioso central (SNC), que a su vez produce las reacciones autonómicas características de esta sintomatología.
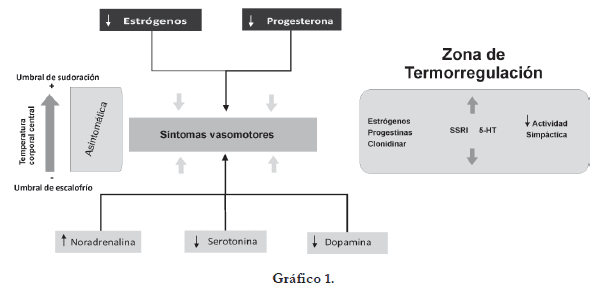
Es de vital importancia entender el concepto de la zona de termorregulación, la cual se encuentra comprendida entre el umbral de sudoración y el umbral de escalofrío.
En la paciente asintomática la zona de termorregulación es amplia, lo cual se traduce en que los cambios normales de la temperatura corporal central no activan los umbrales descritos; sin embargo, el disbalance hormonal estrógeno/progestágeno propio del climaterio produce un estrechamiento de la zona de termorregulación, lo cual se traduce en activación de los umbrales de sudoración con leves aumentos de la temperatura corporal central, desencadenando los síntomas vasomotores (fogajes y sudoración), que son una reacción autonómica originada en el nivel del hipotálamo a través de un disbalance entre los neurotransmisores: noradrenalina, serotonina y dopamina, los cuales activan los centros de regulación neurovascular y cardiovascular en el nivel del tallo cerebral, produciendo cambios en la reactividad vascular periférica, que llevan a vasodilatación de la microvasculatura de la piel.
Las terapias para el manejo de los síntomas vasomotores deben tener como objetivo ampliar nuevamente la zona de termorregulación, lo cual se logra corrigiendo tanto el disbalance hormonal como el de neurotransmisores (gráfico 1).
3.2. Cerebro y Estrógenos
Un estimado de 5.4 millones de estadounidenses de 65 años de edad o más tienen la enfermedad de Alzheimer, la causa más común de demencia y la sexta causa de muerte en los Estados Unidos. El número se elevará a 7,7 millones en el 2030, a medida que la generación del Baby Boom envejece, y habrá entre 11 millones y 16 millones en el 2050.
El gasto de este año por los programas federales de Medicare y Medicaid para las personas con Alzheimer se estima en $ 130 mil millones, según los Centros para el Control y Prevención de Enfermedades.
Los graves pronósticos del aumento del costo de la atención de la enfermedad de Alzheimer –que pueden superar los US $ 1 trillón para el 2050– han hecho que se exija una planificación en todos los niveles del gobierno de los Estados Unidos para la identificación de estrategias con miras a reducir los costos.
Entre el 10% y el 11% de personas de 70 a 89 años de edad sufren de demencia, de acuerdo con el Consejo Asesor de Investigación Cuidados y Servicios de Alzheimer (el nuevo panel encargado de desarrollar un plan Nacional de Alzheimer).
Los expertos dicen que la falta de los médicos de hacer o registrar se debe a la carencia de educación sobre el reconocimiento de deterioro cognitivo temprano, así como el estigma, el miedo y la desesperanza que provoca la demencia en los sectores públicos y en los médicos1.
A pesar del progreso sustancial durante las últimas décadas en la comprensión de las bases neuronales de las funciones de la memoria y cómo estas funciones cambian con la edad, este entendimiento no se ha traducido en intervenciones terapéuticas, para mejorar la función cognitiva.
La observación que une la acetilcolina con la memoria episódica llevó a los tratamientos con inhibidores de la colinesterasa en pacientes con enfermedad de Alzheimer. Los efectos terapéuticos de estos medicamentos son moderados, quizá porque la enfermedad de Alzheimer afecta a múltiples neurotransmisores.
No hay medicina para la pérdida de memoria asociada con la edad, aunque la Guanfacina se está probando actualmente en un ensayo clínico para el tratamiento de los déficit en la función cognitiva2. Las intervenciones farmacológicas, acompañadas por las intervenciones de entrenamiento cognitivo, pueden ser eficaces en la recuperación de la disminución de las capacidades cognitivas.
Al menos dos estudios han demostrado que la memoria puede mejorarse mediante el entrenamiento cognitivo y que hay cambios cerebrales detectables que acompañan esta mejoría4,5. Sin embargo, queda por ver si el tratamiento farmacológico y los enfoques cognitivo-formación tienen un efecto sinérgico, el uno puede sustituir al otro, o si uno podría eclipsar al otro.
Mientras tanto, Wang et al. han ofrecido ideas sobre los cambios fundamentales fisiológicos que se producen en el envejecimiento normal y sus correlatos moleculares subyacentes.
Su caracterización detallada de estos cambios en la corteza prefrontal, tal vez la región del cerebro humano más vulnerable a los cambios relacionados con la edad, es fundamental para la comprensión de las bases neuronales del envejecimiento cognitivo y el desarrollo de nuevos enfoques experimentales para el tratamiento de la pérdida de memoria asociada con la edad.
La patología de la enfermedad de Alzheimer incluye la hiperfosforilación de la proteína Tau y la formación de beta amiloide. Esta se produce a partir del péptido precursor de amiloide (APP) que entra a las células neuronales, microglia, astrocitos y neuronas e inicia una cascada de inflamación, excitotoxicidad, agregación de amiloide, inflamación y fosforilación de la proteína Tau, fenómenos de inflamación y neuritis que llevan al deterioro de la célula, aumentan la apoptosis y finalmente provocan la muerte celular.
La mitocondria también se ve afectada por el efecto del amiloide (A) que hace que sus paredes se debiliten aumentando el ingreso exagerado de calcio, y trastornando los ciclos de metabolismo de la citocromo oxidasa, el metabolismo de Krebs con consecuente inflamación y daño de DNA mitocondrial, con apoptosis, proteólisis y muerte celular3,4.
Los estrógenos han mostrado efectos benéficos neuroprotectores en la isquemia cerebral y en la promoción de crecimiento neuronal y espinas dendríticas.
Los EEC han mostrado in vitro aumento del número neuronal y la proliferación de ramas sinápticas en el hipocampo de ratas deprivadas y tratadas5.
Por otra parte, se ha demostrado la disminución de la isquemia cerebral en cerebros de ratas sometidas a isquemia, con recuperación neuronal mas rápida6 y la preservación de bcl2, un gen de la familia bcl que promueve la supervivencia celular en varios tejidos, incluyendo el cerebro6.
Los estrógenos también han mostrado mejoría en la conductividad neuronal a través de la fosforilación del receptor NMDA glutamato con consecuente aumento de paso de Ca+ intracelular5.
Los estrógenos, finalmente, han mostrado efecto benéfico en los vasos sanguíneos: cuando su endotelio está conservado en buen estado, a través de producción de óxido nítrico y su acción antiadherente, actúan como vasodilatadores, disminuyendo la actividad inflamatoria y la progresión aterogénica, y en el SNC influyen en neurotransmisores y neuromoduladores de procesos inflamatorios.
La acción estimulatoria o supresiva depende de la especificidad celular incluyendo tipo de RE, nivel de expresión, y del corregulador7.
Los estrógenos con su efecto neuroprotector modifican múltiples aspectos de la patogénesis de la enfermedad de Alzheimer:
1. Regulan la generación y toxicidad del amiloide.
2. Disminuyen el daño inducido por radicales libres generados por amiloide y microglia.
3. Protegen contra el insulto secundario inducido por excesivo paso de glutamato de neuronas dañadas con reducción de Ca intracelular.
4. Regulan la expresión de genes apoptóticos tales como el aumento de expresión de bcl-2.
5. Aumentan la captación de amiloide por la microglia, disminuyendo potencialmente la carga amiloide en el cerebro.
Sin embargo, los estudios clínicos, al contrario de los estudios en animales y en el laboratorio, no han sido tan concluyentes y más bien han sido indicativos de que, al menos en los grupos poblacionales de edad mayor, los estrógenos y los estrógenos más progestágenos son deletéreos para la capacidad cognitiva.
El HERS, un estudio de prevención secundaria cardiovascular, en el 2001 mostró, en un grupo de mujeres de edad promedio de 68 años y antecedente de un evento cardiovascular previo, un aumento del RR de ACV fatal, no fatal e isquemia transitoria (RR, 1.18; 0.83 – IC, 1.66; 1.61; RR, 0.73 – IC, 3.55; RR, 0.90; IC, 0.57-1.42, respectivamente), aunque no estadísticamente significante8.
En el 2003 el WHI TEP en mujeres de promedio de edad de 63 años y “relativamente sanas” mostró RR de ACV isquémico de 1.44 (IC, 1.09-1.90) (significante) y RR de ACV hemorrágico de 0.82 (IC, 0.43-1.56) (no significante) y las conclusiones: estrógenos más progestinas aumentan el riesgo de ACV isquémico en mujeres posmenopáusicas generalmente sanas9.
En el mismo 2003 se publicaron los resultados del WHI-MS (Women’s Health Initiative-Mental Study), un estudio ancilar del WHI que tuvo como objetivo determinar los efectos de los estrógenos más progestinas en la incidencia de demencia y trastorno cognitivo leve y los resultados no fueron muy alentadores: incidencia de demencia, RR, 2.05 (IC, 1.21-3.48) (significante) y el efecto del tratamiento de TH en el trastorno cognitivo fue de RR, 1.07 (IC, 0.74-1.55), es decir, no tiene efecto.
En conclusión, los estrógenos más progestinas aumentan el riesgo de probable demencia y no previenen el trastorno cognitivo.
Una rama del estudio anterior fue publicado acerca de la función cognitiva global en el mismo número de la revista de JAMA que concluye con los estrógenos progestinas disminución el resultado del Mini Mental State Examination y que en las posmenopáusicas de más de 65 años los estrógenos progestinas no mejoraban el estado cognitivo11.
Ya había aparecido un estudio randomizado controlado de estrógenos en enfermedad de Alzheimer leve o moderada en el cual los estrógenos ni mejoraban ni empeoraban la enfermedad12.
Por otra parte, la rama de estrógenos solos del WHI, que también fue suspendida prematuramente por aumento de la enfermedad cerebrovascular (RR, 1.39; IC, 95%; 1.10-1.77).
Por último, un estudio prospectivo de incidencia de demencia y TH en 1889 mujeres (también hubo hombres), el Cache County Study13, concluyó que las mujeres sufrían más de EA después de los 80 años que los hombres; que la mujeres usuarias de TH tenían un riesgo menor que las que no usuarias (RR, 0.59; IC, 0.36-0.96); que el riesgo variaba a favor a medida que aumentaba el uso de TH, y que después de los 10 años de uso el riesgo fue menor que en las no usuarias (RR, 0.41; IC, 0.17-0.87) y que en los hombres (RR, 0.77; IC, 0.31-1.67).
La razón de los resultados anteriores no está clara, pero lo que se sugiere, como en el caso de la enfermedad cardiovascular y la osteoporosis, es que la acción benéfica de los estrógenos se consigue usándolos a dosis bajas en la mujer menopáusica joven, cuando no se han instaurado procesos que pueden ser irreversibles como son el daño endotelial, la inflamación crónica, el trastorno conductivo neuronal y la muerte celular.
3.3. Terapia Hormonal, Función Cognitiva y Demencia
• La menopausia natural tiene poco efecto sobre la función de la memoria o sobre otras áreas de la función cognitiva. Sin embargo, durante la transición menopáusica algunas mujeres experimentan problemas transitorios, aunque su magnitud generalmente es pequeña.
• La terapia hormonal aumenta el riesgo de demencia si se inicia en mujeres mayores de 65 años. Recomendación B.
• Después de la menopausia la terapia hormonal no tiene un efecto importante sobre la función cognitiva de la edad madura. Recomendación B.
• No se puede recomendar la terapia hormonal a ninguna edad, con el propósito de mejorar la función cognitiva o para prevenir la demencia. Recomendación C.
3.4. Terapia Hormonal e Insomnio
No existe evidencia de mejoría de trastornos del sueño con terapia hormonal. Sin embargo, entendido el insomnio como un síntoma asociado a los síntomas climatéricos, es decir, aquel insomnio producto del efecto dominó que generan los sofocos en horas de la noche y que le impiden a la mujer climatérica mantener un sueño continuo y reparador, sí mejora con TH. Nivel de evidencia 1, recomendación B.
3.5. Terapia Hormonal y Depresión
La prevalencia de síntomas depresivos es similar antes y después de la menopausia. Sin embargo, el trastorno depresivo mayor puede incrementarse durante la etapa de transición de la menopausia.
Es fundamental diferenciar entre la presencia de síntomas afectivos derivados del hipogonadismo en la menopausia y los síntomas presentes en el trastorno depresivo mayor.
La evidencia clínica no confirma la eficacia de la terapia hormonal como tratamiento del trastorno depresivo mayor durante la menopausia. Nivel de evidencia 1, recomendación B.
La terapia hormonal mejora los síntomas afectivos del síndrome climatérico. Nivel de evidencia 1, recomendación A.
Las pacientes con trastorno depresivo mayor y síntomas derivados del hipoestrogenismo responden mejor a la terapia con psicofármacos y terapia hormonal concomitante que aquellas que solo reciben psicofármacos. Nivel de evidencia 2a, recomendación B.