I Parte
ONATRA W1, MENDOZA R2, LENIS C3,
FORERO G4, RODRÍGUEZ A5, PEÑA E6,
LAVERDE G7, GALLEGO C8, ESQUINAS PC9,
ZÚÑIGA M10, RUIZ A11, RÍOS MT12
Resumen
Introducción: la enfermedad cardiovascular (EC) es la principal causa de morbilidad y mortalidad en países desarrollados como en vía de desarrollo. Su etiología es multifactorial; uno de los factores es el consumo de grasas saturadas con efectos sobre las lipoproteínas y en la ateroesclerosis. Fue interés de los autores conocer el efecto de la dieta rica en grasa sobre el perfil lipídico en un modelo experimental como el conejo.
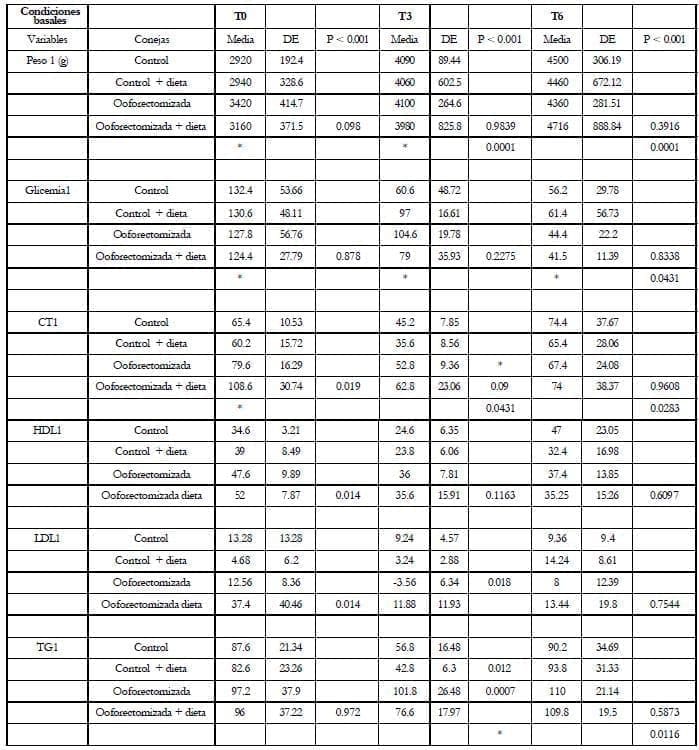
Material y métodos: se tomaron 20 conejas New Zealand de 2.500 a 3.000 Kg. de peso, las cuales se dividieron en dos grupos: Grupo I (n=10) 5 control (C), 5 control + dieta rica en grasa 1% (C+D) y el grupo II (n=10) ovariectomizadas, 5 control (O) y 5 con dieta rica en grasa 1% (O + D). Se evaluaron los siguientes parámetros a los tres y seis meses: peso, glicemia, colesterol total (CT), triglicéridos (TG), lipoproteínas HDL, LDL, estradiol (E2). En la evaluación estadística se utilizaron medidas paramétricas y no paramétricas, incluyendo la prueba de Kruskall-Wallis.
Resultados: el peso mostró un aumento progresivo en los cuatro grupos, siendo mayor en el grupo de los C + D (54%) (p < 0.001) y las O + D (61%) (p < 0.001). La glicemia produce un descenso progresivo a los tres y seis meses en los controles (-56%) (p < 0.002), siendo mayor en las conejas (O + D) (-64.67%) (p < 0.041). El CT presenta una tendencia a la disminución que es significativa en el grupo (O + D) (p < 0.043). Las HDL muestran una tendencia a la disminución sin diferencias significativas ni a los tres ni seis meses (P < 0.116 y p < 0.609). Las LDL calculadas si bien muestran una disminución, esta no fue significativa (p < 0.754). Los TG muestran un aumento el cual fue significativo (p < 0.011), siendo evidente a los tres meses en los C + D (p < 0.012) y las ovariectomizadas (p < 0.007). El estradiol en los controles presenta un aumento del 13% y en los C + D de un 93% (p < 0.001).
Conclusión: este modelo es útil en la evaluación del perfil lipídico con una dieta rica en grasa (1%), evidenciando severos efectos metabólicos en conejas ovariectomizadas.
Abstract
Introduction: Cardiovascular disease is the main cause of morbility and mortality in developed and underveloped countries around the World. Instead of that ethiology is multifactorial, one of the most important factor is the use of saturated fats and its effect on lipoproteins and atherosclerosis. The aim of the authors was to assess the effect of the fat rich diet on the lipid profile of a rabbit experimental model.
Methods: 20 female New Zealand rabbits with 2.500 t0 3 000 kg 0f weight were divided in two groups: Group I (n 10) : 5 controls (C) and 5 rich fat 1% diet (C+D) and group II (n 10) ovariectomized: 5 controls (O) and 5 rich fat 1% diet (O+D). At 3 and 6 months we avaluated the following parameters: weight, GLYCEMIA, total cholesterol TC, Triglycerides TG, HDL lipoproteins, low density lipoproteins LDL and estradiol E2. We use parametric and non parametric measures incluiding the Keuskall-Wallis tests to statistic evaluation.
Results: The weight increase progressively in all the 4 groups but higher in the C+D (54%) (p <0.001) y O+D (61%) (p<0.001). Glycemia decrease at 3 and 6 months in controls (-56%) (p<0.002) with a higher decrease in O+D group (-64.67%)(p<0.043). HDL shown a decreased trend with not significant differences at 3 or 6 months. (p0.116 an p<0.609). LDL shown a non statistic significant decrease (p<0.754). TG shown an significant increase (p<0.011) at 3 months in the C+D group(p<0.012) and in ovariectomized (p<0.007). Estradiol had an increase in controls of 13% and 93% in the C+D group (p<0.001).
Conclusion: This model is useful in assessing the lipid profile with a high-fat diet (1%) showing severe metabolic effects in ovariectomized rabbits.
I. Introducción
La enfermedad cardiovascular (EC) es la principal entidad que causa mayor morbilidad y mortalidad tanto en países desarrollados como en vía de desarrollo.1 Su etiología es multifactorial desde factores genéticos, nutricionales, ambientales y estilos de vida, atribuyéndole al consumo de grasa saturada un papel importante en el desarrollo de las dislipidemias y en la ateroesclerosis2. Una de las paradojas en este sentido ha sido la observación de que el consumo de grasas no saturadas recomendadas por la Asociación Americana del Corazón (AHA), la Asociación Americana de Diabetes (ADA) y la Asociación Americana de Nutrición (ANA) con frecuencia presenta una disminución en los niveles de las lipoproteínas de alta densidad (HDL).3 Estudios epidemiológicos como estudios en animales soportan la evidencia del papel protector de las HDL.4,5
El tejido graso era inicialmente mirado como un tejido de recubrimiento y protector de la piel. A medida que se fueron descubriendo sus funciones vemos que se trata de una unidad endocrina y paracrina que modula un sinnúmero de procesos metabólicos. El adipocito obtiene su energía a través de la beta-oxidación mitocondrial de los ácidos grasos y su exceso se almacena como triacilglicerol (TAG), permaneciendo como reserva dependiente de la lipoproteína lipasa (LPL) citosólica. Con el fin de almacenar, transformar y utilizar la energía existen dos clases de tejido adiposo; el tejido adiposo blanco (WAT de las siglas inglesas) con células uniloculadas de depósito y el tejido adiposo parto (BAT) que posee células multiloculadas productoras de calor. La función principal del WAT es el almacenamiento de lípidos y su liberación de acuerdo a losrequerimientos, a diferencia del BAT que posee un gran número de mitocondrias y un sistema enzimático que inicia una segunda conductancia que no genera ATP sino un desacoplamiento metabólico en estos organelos con producción de calor. La vascularización está aumentada y la relación volumen capilar/ volumen citoplasmático es mayor en el tejido graso que el muscular.
El control neuronal es de origen adrenérgico; sin embargo, el BAT posee receptores B3 membrana, los que inducen termogénesis y modificaciones en la eficacia que se utilizan los sustratos siendo un vía alterna para transformar la ganancia de peso por unidad de nutriente ingerido. Su localización es general con una distribución especial en la mujer y el BAT se encuentra en el cuello, región dorsal del tronco, axilar, suprarrenal, riñón y región inguinal.6,7
Su función es bien conocida como aislante térmico, protector de órganos y modulador del contorno corporal especialmente en la mujer, reservorio energético, recientemente demostrado que participa en el control del apetito, en el mantenimiento de peso corporal y como regulador global del metabolismo energético.8
La distribución grasa difiere en el hombre y la mujer y se ha considerado como una de las características sexuales secundarias. La distribución grasa se modifica durante situaciones fisiopatológicas como el embarazo, la menopausia o el transexualismo, sugiriendo un papel potencial de las hormonas esteroideas en sitios específicos de los depósitos grasos.9
Estudios epidemiológicos han encontrado la asociación entre la obesidad y aumento de la mortalidad de origen cardiovascular, cerebrovascular y diabetes.10 Se ha determinado que la obesidad está relacionada con la distribución grasa por género y el índice de masa corporal (IMC = Peso x Talla2), como indicadores de alteraciones metabólicas y cardiovasculares. La obesidad “androide”, distribución grasa en la parte superior del cuerpo, descrita por Vague11, se correlaciona con un incremento de la mortalidad en entidades como diabetes, hiperlipidemia, hipertensión, arteriosclerosis coronaria cerebral y periférica, a diferencia de la distribución ginecoide (parte baja del abdomen) propia de las mujeres, que las mantiene protegidas de estos eventos hasta cinco años después de la menopausia.12 La distribución de esta obesidad se ha correlacionado con un aumento de glucosa e insulina plasmática, disminución de las lipoproteínas de alta densidad (HDL), modificaciones en el IMC, conformando un complejo de síntomas y signos del síndrome metabólico (SM).13 Es por esto que fue interés de los autores conocer los efectos de la dieta rica en grasa sobre el perfil lipídico en un modelo experimental como el conejo.
II. Material y métodos
Tipo de estudio: estudio experimental en conejas New Zealand con peso de 2.500 a 3000 kg con una dieta rica en grasa al 1%.
Muestra: se tomaron 20 conejas maduras New Zealand de 3 Kilos de peso en condiciones de temperatura 21°C y ciclo normal de día y noche. Se dividieron en cuatro grupos:
Grupo A: conejas control: 1) Dieta normal (C) n = 5; 2) Dieta hiperlipidémica (C + D) n = 5.
Grupo B: conejas ovariectomizadas (O): 1) Dieta normal (O) n = 5; 2) Dieta hiperlipidémica (O + D).
Dieta: se utilizó una dieta rica en 1% de colesterol, enriquecida con 10% de aceites ricos en ácidos grasos saturados (palma (A)), monoinsaturados (oliva (B)) y poliinsaturados (maíz (C)).29
Laboratorio: durante este período se tomó muestra de sangre de la vena central de la oreja en cantidad de 10 ml, al inicio Tiempo 0.12 (T2) y 24 semanas (T3).
Diez conejas que se llevaron a ovariectomía, en las instalaciones de la Clínica Veterinaria de la UDCA. Bajo anestesia general, se llevó a cabo la laparotomía con extracción bilateral de la gónada. Con los cuidados postoperatorios de acuerdo a las guías existentes para estos casos.
1. Se evaluó el peso semanalmente y el promedio de aumento se consignó el día de la toma en el tiempo T0 (octubre, 2007), T2 (febrero, 2008) y T3 (mayo, 2008).
2. Química sanguínea: se determinó glicemia, colesterol total (CT), lipoproteínas de alta densidad (HDL), LDL * calculado y triglicéridos (TG). Estradiol (E2). Técnica: se utilizó el método ELISA30. Valores normales:31

3. Niveles de estradiol: los niveles de estradiol son un buen marcador de la función ovárica y su relación con el tejido graso; está documentada mostrando un aumento mayor y proporcional al aumento de tejido graso. La determinación se hizo por quimioluminiscencia.
Los niveles en conejas están entre 14 y 43 picogramos:
Análisis estadístico:
Manejo estadístico: se ha calculado que una muestra de cinco conejas podría ser requerida para que la prueba tenga una seguridad del 90% y un intervalo de confianza del 95% (Riesgo alfa 5%). El análisis se hará por el sistema Epi-Info 2.000 sofware estadístico (Center for disease Control and Prevention, Atlanta, GA.USA./ World Health Organization, Geneve, Switzerland). Los datos se presentarán con su desviación estándar (DS), el promedio de las diferencias y los intervalos de confianza en porcentaje. Los resultados se harán en porcentaje. La comparación se hará con la T de student, el test X2 para ambos grupos y la prueba de Kruskall-Wallis.
Se considera una prueba de significancia cuando p < 0.05.17
Instrumento de recolección: los datos se consignaron en formulario de Excel para su procesamiento.
Comité de Bioética: el estudio fue autorizado por el Comité de Bioética, Sección Experimentación animal de la UDCA, de acuerdo a la normatividad internacional existente en el manejo ético de animales en experimentación.
INSTITUCIÓN: Universidad de Ciencias Aplicadas y Ambientales (UDCA), Bogotá.
1 MD, MSc, Ginecólogo, Endocrinólogo U.N. Profesor Titular, Docente-Investigador, UDCA. wonatra@gmail.com, Celular: 310-2626771,
Teléfonos: 6108777-2323656-2876901
2 MVZ, PhD, Decano de Zootecnia UDCA.
3 QF. Docente Laboratorio Bioquímica UDCA.
4 MV. Cirujano, Profesor UDCA.
5 MV. Anestesiólogo Profesor UDCA.
6 MV. Ecografista. Profesora UDCA.
7 Bacterióloga. Gerente Laboratorio de Investigaciones Hormonales.
8 MV. Patóloga, Profesora UDCA.
9 MV. Patóloga, Fundación Santa Fe.
10 MV. Coordinador Bioterio. Profesor UDCA.
11 MD, MSc. Ginecólogo, Endocrinólogo, Epidemiólogo, Profesor Titular, Universidad Nacional de Colombia.
12 Estadística UDCA
