Actualidad Inmediata
Shelley R. Salpeter, Md; Judith M. E. Walsh, Md, Mph; Elizabeth Greyber, Md; Thomas M. Ormiston, MD; Edwin E. Salpeter, Phd J Gen Intern Med 2004; 19: 791–804
Introducción
En la evaluación del riesgo-beneficio de la terapia de reemplazo hormonal (TRH), los estudios clínicos observacionales han llegado aparentemente a resultados conflictivos. Los estudios grandes prospectivos de cohortes han mostrado que las mujeres que usaron TRH, la mayoría de las cuales comenzaron el tratamiento muy pronto después de la menopausia, tenían una reducción significativa de la mortalidad cardiovascular y la mortalidad total, comparada con las no usuaria1-8 . Los resultados son significativos aun después ajustar riesgos cardiovasculares tales como la edad, fumar y la tensión arterial. El más grande estudio aleatorizado de TRH, el Women’s Health Initiative (WHI), evaluó mujeres con edad promedio de 63 años y encontró que la TRH aumentaba el riesgo de eventos cardiovasculares, sin cambios en la mortalidad total o en la cardiovascular9.
Es posible que la reducción de mortalidad vista en los estudios observacionales se debiese a variables de confusión que no fueron adecuadamente ajustadas, como el estado general de salud o el acceso a cuidados de salud10-12.
Otra explicación es que cuando la TRH se inicia en mujeres jóvenes se ven verdaderos beneficios en la mortalidad. La mortalidad es un objetivo final raro, aun en estudios grandes.
Por ejemplo el WHI tenía aproximadamente 5 muertes por cada 1.000 pacientes al año9.
Un estimado más preciso del impacto de la TRH en la mortalidad puede hacerse si se juntan los resultados de muchos estudios. El objetivo de este estudio fue analizar los efectos de la edad en la mortalidad total y específica, asociada a TRH, realizando un metaanálisis de los estudios controlados y aleatorizados.
Métodos
Estrategias de búsqueda
Se buscó en MEDLINE, EMBASE y CINAHL, para identificar los estudios aleatorizados controlados entre 1966 y septiembre del 2002, en los cuales se evaluara la terapia de reemplazo hormonal en mujeres posmenopáusicas. Los términos usados fueron: climaterio, menopausia, perimenopausia o posmenopausia y estrógenos, terapia de reemplazo estrogénico, terapia de reemplazo hormonal, sustitución hormonal, progesterona, progestágeno, progestina o gestágeno.
Los estudios no fueron excluidos con base en este lenguaje. La búsqueda se aumentó escaneando ciertas revistas selectas a través de abril de 2003 y algunas referencias de los artículos identificados.
Selección de artículos
Dos investigadores por separado evaluaron los estudios para su inclusión, y los acuerdos interrelacionados se midieron usando la estadística.
Los estudios fueron incluidos si: 1) fueron estudios aleatorizados y controlados de mujeres posmenopáusicas que comparaban TRH con placebo o no ingesta de terapia hormonal, 2) que fueran de más de 6 meses de duración y 3) que reportaran al menos una muerte. Se hicieron intentos para contactar a los investigadores de los estudios de más de 6 meses, para obtener la información de las muertes durante el estudio.
Se recibieron del Department of Medicine, Santa Clara Valley Medical Center (SRS, EG, TMO), San Jose, Calif; Department of Medicine, Stanford University School of Medicine (SRS), Department of Medicine, Stanford, Calif; Department of Medicine (JMEW), University of California, San Francisco, Calif; and Center for Radiophysics and Space Research (EES), Cornell University, Ithaca, NY. Para estudios con múltiples publicaciones del mismo grupo de participantes, se eligió para la inclusión la publicación que contuviera la mayor información. Las intervenciones en los estudios incluyeron estrógenos solos transdérmicos u orales o en combinación con una progestina. Los grupos control recibieron placebo, no tratamiento o suplementación con calcio.
Extracción de datos
Dos revisores independientes extrajeron datos de los artículos seleccionados, reconciliando las diferencias por consenso. Los objetivos medidos fueron muertes totales y muertes por eventos cardiovasculares, cáncer y otras causas. Los pacientes que suspendieron el estudio por causa de eventos adversos y las muertes que fueron reportadas después de la suspensión del estudio fueron incluidas en el análisis.
De estudios cruzados, solo los datos del final de la primera fase fueron usados debido al efecto potencial continuado de la TRH. De estudios aleatorizados con extensiones abiertas no aleatorizadas, solo se incluyeron los datos del estudio aleatorizado. De estudios que aporten datos de otras intervenciones, tales como raloxifeno, sólo datos sobre las hormonas y el grupo control fueron incluidos.
Estudios de validación
La calidad de la metodología de cada estudio se determinó de acuerdo con los siguientes factores: 1) ¿fue la aleatorización y el estado ciego adecuado?, 2) ¿fueron los pacientes y los proveedores ciegos a la intervención?, 3) ¿se describieron las suspensiones y los abandonos, y el análisis se realizó en intento por tratar? Los estudios recibieron una A cuando cumplieron todos los criterios de calidad, una B cuando uno o más criterios se cumplieron parcialmente y una C cuando uno o más criterios no se cumplieron.
Dos revisores, independientemente, analizaron la calidad de los puntajes y la tasa de acuerdo se calculó usando la estadística. La calidad del análisis se usó para los análisis de sensibilidad.
Síntesis de los datos
Para cada estudio, la relación “muertessobrevivientes” se calculó para el grupo control y tratamiento para obtener el riesgo relativo. Los resultados netos de mortalidad se expresaron en riesgo relativo, RR, dividiendo el RR de tratamiento sobre el RR de los controles. Los resultados se mezclaron para obtener una suma del RR usando el modelo de efectos aleatorios para objetivos dicótomos, con intervalos de confianza (IC) programados a una significancia del 95%16.
El método de efectos aleatorios se escogió por su relación con el potencial de heterogeneidad interestudio. El análisis se realizó usando el Meta View 4.1 (Update Sofware, Oxford, UK). Sólo los estudios que reportaron al menos una muerte podrían ser usados en el estimativo del RR. Para probar la heterogeneidad interestudio, el valor y el valor Q se calcularon para la asunción de homogeneidad. En razón de evaluar el efecto de la edad en la mortalidad, los estudios se dividieron en aquellos con edad promedio de los participantes con línea de base menos que o más que 60 años. El punto de corte de 60 años se escogió arbitrariamente a priori, para dividir las participantes en grupo de edad más joven o más vieja. El punto de corte se consideró apropiado porque la tasa de eventos cardiovasculares se acelera a partir de esta edad, sugiriendo que el efecto primario protector de la TRH se podría perder o disminuir después de este tiempo17,18. Los resultados de los análisis se reportaronseparadamente para todas las edades y para los grupos más jovenes y más viejos. El resultado de los dos grupos de edad se compararon entre sí usando el logaritmo de los RR (log RR). Se realizó un análisis de sensibilidad para evaluar los efectos de usar diferentes puntos de corte de edad. El análisis de regresión lineal se realizó para evaluar el RR de mortalidad como una función lineal de la edad.
Se analizó un subgrupo comparando el uso de estrógenos sin oposición y tratamiento combinado con estrógenos y progestinas, para estudios que tenían información de tratamiento combinado y no combinado. Los datos de cada tipo de tratamiento se analizan por separado.
Resultados
Resultados de la búsqueda
Los resultados de la búsqueda electrónica identificaron 4.993 artículos, de los cuales 358 fueron potencialmente relevantes sobre TRH en mujeres posmenopáusicas. Después de escanear las revistas y las referencias de los artículos seleccionados, unos 12 artículos adicionales se identificaron. De estos 370 estudios, 30 llenaron los criterios de inclusión9,19,47. El puntaje para acuerdo intertasa en los estudios seleccionados fue 0,91 (IC 95%, 0,82 a 1,0). Se excluyeron los estudios por las siguientes razones: 98 no reportaron ninguna muerte, 110 proveyeron datos sobre pacientes ya incluidos en el análisis, 79 fueron de 6 meses de duración o menos, 26 no tuvieron grupo control y 27 no eran aleatorizados.
Características de los estudios
El análisis incluye 30 estudios, con un total de 26.708 participantes que fueron seguidas por 119.118 pacientes-año. El promedio de duración de los estudios fue de 4,46 años (rango 0,7 a 10 años), con un promedio de tamaño del estudio de 890 participantes (rango 52-16.608).
El promedio de edad de las participantes de base fue 62,2 ± 8,9 años, en el grupo tratamiento, y 63,4 ± 9,1 años, en el grupo placebo, con rango de edad de 36 a 87 años. La tasa promedio de abandono fue estimada en 11,5% en el grupo tratamiento y 10,6% en el grupo placebo. El puntaje para acuerdo intertasa en los puntajes de calidad de la metodología fue de 0,95 (IC 95%, 0,6 a 1,0). De los ensayos estudiados, 13 recibieron un puntaje de A, 10 uno de B y 7 un puntaje de C.
Mortalidad Total y Causa Específica
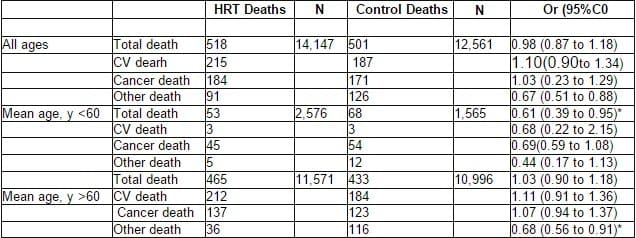
Para todas las edades combinadas, hubo 518 muertes en 14.147 participantes en el grupo tratamiento y 501 muertes en 12.561 participantes en el grupo control.
Table 2. Odds Ratio for Total, Cardiovascular, Cancer and, Other Mortality in Younger and OrderWomen Associated with Hormone Replacement Therapy
Stadistical significance
OR, Odds Ratio. CV Cardiovascular; HRT. Hormone Replacement Therapy.
El RR global para la mortalidad total asociada con TRH fue de 0,98 (IC 95%, 0,90 a 1,34), y para muertes por cáncer fue de 1,03 (IC 95%, 0,82-1,29), para notar que no hubo aumento en las muertes por cáncer de mama en aquellos estudios que reportaron la mortalidad específica para cáncer (RR 1,03; IC 95%, 0,29 –3,67). La TRH se asoció con un 33% de reducción de muertes por razones diferentes a enfermedad cardiovascular o cáncer (RR 0,67; IC 95%, 0,51-0,88); tabla 2. Las causas específicas de muerte en esta categoría incluyen enfermedades infecciosas, sepsis, accidente, falla renal, embolismo pulmonar, falla hepática, sangrado gastrointestinal y artritis reumatoide.
Hubo 19 estudios en grupos de edad jóvenes, con 4.141 participantes, seguidos por una duración promedio de 3,66 años. El promedio de edad en el grupo tratamiento fue de 53,9 ± 3,5 años y el grupo control fue de 53,7 ± 3,4 años. El RR de la mortalidad total en el grupo más joven fue de 0,61 (IC 95%, 0,39-0,95), indicando una reducción del 39% en mortalidad para aquellas que recibieron TRH (tabla 2, figura 1). El RR para mortalidad cardiovascular fue de 0,68 (IC 95%, 0,22 a 2,15), para cáncer la mortalidad fue de 0,69 (IC 95%, 0,59-1,08), y para otra mortalidad fue de 0,44 (IC 95%, 0,17-1,13).
Hubo 13 estudios en el grupo de edad más viejas, con 22.567 participantes, seguidas por una duración promedio de 4,66 años. La edad promedio del grupo tratamiento fue de 64,6 ± 7,2 y el grupo control 66,8 ± 7,0. El RR para mortalidad total asociada con TRH en el grupo mayor fue de 1,03 (IC 95%, 0,9-1,18; tabla 2, figura 2). Para este grupo no se afectó significativamente la mortalidad cardiovascular (1,11; IC 95%, 0,91-1,36) o mortalidad por cáncer (1,07; IC 95%, 0,84- ,37), pero se asoció con reducción en mortalidad por otras causas (0,68; IC 95%, 0,56-0,91). Cuando se compararon los resultados de los 2 grupos, la TRH se asoció con una significativa menor mortalidad en el grupo más joven cuando se comparaba con el grupo más viejo (p 0,03). Un análisis de sensibilidad mostró que la TRH se asoció aun con significantes reducciones en mortalidad en el grupo más joven usando como punto de corte el rango de 56 a 63 años. En un análisis de regresión lineal, los resultados de RR se analizaron en 3 grupos de edad, menos de 56 años (0,62; IC 95%, 0,39-1,0), 56 a 63 años (0,74; IC 95%, 0,47-1,16) y mayores de 63 años (1,05; IC 95%, 0,92-1,21). Se encontró una tendencia significativa en el RR de mortalidad en funcion de la edad, con un RR aumen aumentado por 0,024 (IC 95%, 0,003-0,038) por año (coeficiente de correlación 0,98) en un subgrupo de análisis; no hubo diferencia significativa en la mortalidad total para todas las edades combinadas cuando se compararon los estrógenos sólos (RR 0,96; IC 95%, 0,73-1,27) con tratamiento combinado (RR 1,0; IC 95%, 0,86-1,15). No hubo diferencias en los resultados de los dos tipos de intervención en el grupo de las más jóvenes o en el de las más viejas (p > 0,5).
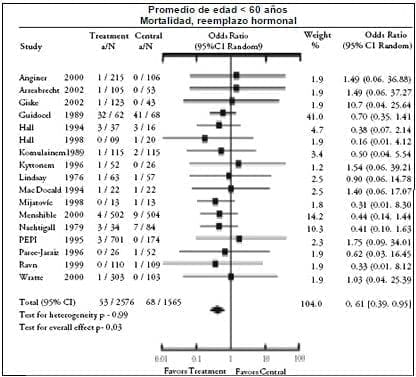
Figure 1. RR para mortalidad total asociada con terapia de reemplazo hormonal; promedio de edad de los participantes menores de 60 años.
Se realizó un análisis de sensibilidad para evaluar el efecto de incluir esos estudios con los más bajos puntajes, para la calidad metodológica. Cuando los estudios con puntaje C se incluyeron, el RR para mortalidad total cambió para menos de 0,1 puntos (p > 0,9) para todas las edades y para los dos grupos de edad.
No hubo evidencia para variación interestudios en ninguno de los análisis (p > 0,7). El valor Q fue calculado y se encontró compatible con la homogeneidad entre los estudios.
Discusión
Los datos de 30 estudios, con 26.708 mujeres posmenopáusicas seguidas por un promedio de 4,5 años, indican que la terapia de reemplazo hormonal no aumenta la mortalidad total. En el grupo más joven, con un promedio de edad de 54 años de base, la TRH se asoció con una reducción en la mortalidad total de 39%. En el grupo más viejo, con promedio de edad de 66 años, la TRH no se asoció con cambios en la mortalidad total. Se escogió una línea de corte de edad a los 60 años, aunque los resultados fueron todavía robustos cuando el punto de corte fue en el rango de 56 a 63 años. Dado que no hubo un sólo punto de corte sino más bien una relación lineal entre los grupos jóvenes y viejos, el análisis de regresión lineal fue realizado para demostrar una tendencia significativa entre el RR de mortalidad y el aumento de edad, con un coeficiente de correlación del 0,98.
Estos resultados pueden ayudar a explicar las discrepancias que se han visto entre los estudios observacionales y los ensayos aleatorizados. El Nurse’s Health Study fue un estudio prospectivo de cohorte de 20 años y 120.000 mujeres por debajo de 55 años, y el WHI fue un estudio de 5 años de 16.000 mujeres con un promedio de edad de 63 años. En ambos estudios, la TRH se asoció con aumentos similares en cáncer de mama, ACV y embolismo pulmonar, y reducciones reducciones similares en cáncer colorrectal y fracturas de cadera. Sin embargo, el WHI encontró un aumento en los eventos cardiovasculares sin cambios en la mortalidad cardiovascular y mortalidad total, mientras el Nurse’s Health Study encontró una reducción significativa de los eventos cardíacos como de la mortalidad cardiovascular y la total. El Nurse’s Health Study, después de ajustarse para potenciales variables de confusión, encontró que la usuarias actuales de hormonas, 80% de las cuales habían iniciado el tratamiento dentro de los 2 años de menopausia, tenían un riesgo de mortalidad de 0,63 (IC 95%, 0,56- 0,70) con relación a las no usuarias. Este metaanálisis encontró resultados similares de mortalidad total en las mujeres jóvenes (RR 0,61, IC 95%, 0,30-0,95) dando evidencia de que el beneficio en la mortalidad, visto en los estudios observacionales, puede ser un efecto real de la TRH cuando el tratamiento se inicia temprano en la menopausia. Los efectos benéficos de la TRH incluyen aumento en las lipoproteínas de alta densidad y reducción de las lipoproteínas de baja densidad, Lp(a), homocisteína, fibrinógeno, activador del plasminógeno, factores intrínsecos de coagulación, glucosa, peso, niveles de insulina y la incidencia de nuevos casos de diabetes mellitus, comparado con el placebo29,40,49,52. En la mujeres con diabetes mellitus, la TRH reduce la adiposidad central y aumenta el control glicémico y el funcionamiento físico59,60. La TRH también causa aumento sostenido de los niveles de óxido nítrico y reducción de la norepinefrina, actividad de renina y endotelina plasmáticas61,64. Estos cambios endoteliales se han asociado con vasodilatación, reducción de la presión sanguínea, aumento del flujo sanguíneo y aumento del gasto cardíaco65,69.
Se ha pensado que los estrógenos tienen propiedades protectoras contra la enfermedad cardiovascular en mujeres premenopáusicas, y que el riesgo de arteriosclerosis se incrementa en la posmenopausia70,71. Es posible que si la terapia se inicia en mujeres en la etapa posmenopáusica temprana, antes del desarrollo de arterioesclerosis, se puede alcanzar prevención primaria a través de esas mejorías en el metabolismo, homeostasis y función endotelial. De hecho hay alguna evidencia de que en estudios clínicos y en estudios en animales la TRH puede parar la progresión de arteriosclerosis si el tratamiento se inicia temprano en el curso de la enfermedad29,72,76.
No se han visto beneficios en la mortalidad de la TRH en las mujeres del WHI, la mayoría de la cuales no había tomado hormonas desde el inicio de la menopausia 10 años antes9. El WHI incluyó mujeres que eran menores de 60 años, pero los investigadores no dieron datos de mortalidad para esas mujeres por separado. De notar, un subgrupo de análisis de eventos cardíacos en el estudio encontró un RR de 0,89 para esas mujeres dentro de los 10 años de menopausia, 1,22 para aquellas entre 10-15 años de menopausia y 1,71 para las de más de 20 años de menopausia49. Los resultados demuestran una no significativa, pero a la vez sugestiva tendencia hacia la disminución de eventos en aquellas que iniciaron el tratamiento poco después de iniciarse la menopausia.
Este metaanálisis reunió los datos de 13 estudios en mujeres mayores y no encontró cambios en la mortalidad total (RR 1,03; IC 95%, 0,9-1,18).
Es de notar que un análisis de un subgrupo post hoc mostró que los estudios de mujeres con enfermedad cardiovascular conocida tenían el mismo RR de mortalidad cardiovascular (1,10; IC 95%, 0,86-1,41) que aquellos estudios de mujeres mayores sin enfermedad cardiovascular conocida (1,12; IC 95% 0,79- 1,58). Esto indica que puede haber progresión significativa de la arteriosclerosis en mujeres mayores sanas quienes han estado sin reemplazo hormonal durante muchos años, y que la prevención primaria de enfermedad cardíaca no es posible en este estado de mayor edad. La evidencia acumulada indica que, una vez se ha desarrollado la arteriosclerosis, la TRH no logra revertir el proceso27,46,76,77 . Cuando la TRH se inicia en mujeres mayores se ve una tendencia significativa en el tiempo: aumento de los eventos cardiovasculares en el primer año y luego disminución de éstos en los años siguientes 12,79.
Se ha demostrado que el tratamiento con estrógenos aumenta los niveles de proteína C reactiva y el factor de antígeno de Willebrand, y puede promover la trombosis arterial o la desestabilización de la placa en mujeres con arteriosclerosis establecida80,82. Pocos estudios han seguido pacientes por más de 5 años, por lo tanto no es posible decir si el tratamiento a largo plazo está asociado con beneficios o riesgos cardioavasculares netos en las mujeres mayores.
También se ha demostrado que el reemplazo hormonal afecta el riesgo de cáncer, pero su efecto en la mortalidad por cáncer es menos claro. En el WHI, la TRH aumenta la incidencia de cáncer de mama en 26% y reduce el cáncer de colon en 27%, sin cambiar el riesgo de mortalidad para ninguna de cada enfermedad 9,23 . Este metaanálisis no encontró cambios en la mortalidad por cáncer de mama o muertes totales por cáncer.
Estudios observacionales han encontrado TRH asociada con mortalidad aumentada para cáncer de mama y reducida para cáncer de colon24,25 .
El reemplazo hormonal tiene efectos benéficos en otras condiciones diferentes al cáncer y a la enfermedad cardiovascular, como una reducción del 35% en la incidencia de fracturas de cadera e inicio de nuevos casos de diabetes mellitus, y 60% de reducción en infecciones recurrentes del tracto urinario9,30,50,86. En este metaanálisis, el reemplazo hormonal disminu ye el riesgo de muertes por causas diferentes de enfermedad cadiovascular o cáncer. Es posible que esto se deba, en parte, a la reducción en la complicaciones de las fracturas de cadera, diabetes mellitus y sepsis.
Este análisis tiene varias limitaciones, algunas comunes a los metaanálisis27. Los resultados metaanalíticos estándar son inciertos cuando los eventos por estudio son pocos, como en el caso de la mortalidad. Hubo una marcada heterogeneidad de los estudios, aun cuando no se vio ésta en los resultados. Hubo un amplio rango en los tamaños de las muestras, la medicacion usada y los métodos de administración.
Los resultados para el grupo de edad mayor fueron principalmente de unos pocos estudios de alta calidad, con la mayoría de los datos provenientes de un estudio9. Los resultados del grupo de edad más joven provienen de varios estudios pequeños, y aproximadamente la mitad de las muertes fueron de un estudio de sobrevivientes de cáncer de ovario25. Sin embargo, cuando este estudio se excluyó del análisis, aún persistía una reducción significativa en la mortalidad (RR 0,56; IC 95%, 0,31-0,99).
Otra limitación del estudio es que la edad de los grupos se definió de acuerdo con el promedio de edad de las participantes en cada estudio y no basado en las características individuales de cada paciente, permitiendo algunas sobreposiciones de edad en los dos grupos.
La mayoría de los estudios no incluye la mortalidad como objetivo primario, por lo que no es claro cómo se averiguaron las muertes en cada estudio. Sin embargo, todos los estudios reportaron efectos adversos que incluyeron muertes, y los investigadores fueron contactados para tener mayor información acerca de la mortalidad. No parece que los reportes de muertes sean diferentes en los dos grupos de edad. No fue posible medir las tasas absolutas de mortalidad en este estudio, puesto que solo aquellos estudios que tenían al menos una muerte pudieron incluirse en el análisis. La búsqueda reveló otros 98 estudios que fueron excluidos porque no se reportaba ninguna muerte. Este análisis se basó solamente en la literatura publicada y por lo tanto está sujeta a sesgos de publicación. Sin embargo, el efecto de tamaños versus el error estándar de los estudios en este análisis no mostró evidencia de sesgo. Pocos estudios dieron datos acerca del tratamiento mayor de 5 años, por lo que no es posible medir el riesgo de mortalidad con tratamiento a largo plazo. A pesar de esas limitaciones creemos que este metaanálisis provee una evidencia de mucho valor, concerniente al riesgo de mortalidad asociada con TRH en mujeres jóvenes y viejas.
Las decisiones de tratamiento concernientes al reemplazo hormonal deben hacerse con base en la individualización, teniendo en cuenta la edad de la mujer, el grado de molestias por los síntomas posmenopáusicos y cualquier factor de riesgo de una enfermedad asociada.
Los resultados de este análisis indican que los beneficios de la TRH pueden sobrepasar los riesgos si el tratamiento se da a mujeres más jovenes, pero los riesgos pueden ser mayores que los beneficios si el tratamiento se inicia a edades tardías. Este estudio no pudo determinar la edad óptima de iniciación del tratamiento o la duración de tratamiento necesario para maximizar los beneficios y minimizar los riesgos.
Estudios con aleatorización más larga, que estudie mujeres más jovenes cerca del inicio de la menopausia, son necesarios para determinar adecuadamente estos tópicos. Se obtuvo apoyo financiero del Santa Clara Valley Medical Center y de la University of California, San Francisco.
Los autores agradecen a Hai Emily Huang y a Donald Miller por la asistencia técnica, y a Christopher Stave por la coordinación de la búsqueda de los estudios.
