José Ignacio Madero 1,2,3 , Óscar Eduardo Guerra 3, Gabriel Barbosa 3, Carlos Morán 4, Pilar Gaitán 2, 3, Mabel Ávila, 2,3, Jesús Alberto Ruiz 2,3
Resumen
Las modificaciones a la LH-RH nativa produjeron la aparición de los análogos: agonistas cuyas aplicaciones en la medicina reproductiva han sido ampliamente estudiadas y los antagonistas de reciente estudio y aparición.
Existen ciertas situaciones clínicas en las cuales lo que se necesita es una rápida supresión de la producción de las gonadotropinas endógenas. Y por el efecto estimulador inicial del análogo no se logra.
Los antagonistas causan una supresión inmediata de la producción de FSH y LH por un bloqueo competitivo de los receptores. Lo cual hace que su uso sea óptimo en los casos de inducción de ovulación mas técnicas de reproducción asistida.
Otras de la indicaciones potenciales serían los casos en los que se requiere una supresión de la producción endógena de esteroides sexuales como el caso de la hiperplasia benigna de próstata, el cáncer de próstata y el cáncer de ovario. En los cuales ha demostrado una promisoria utilidad.
Palabras Clave: LHRH/ GnRH/ Antagonistas de GnRH/ Estimulación ovárica/gonadotropinas/ tratamiento del cáncer/ miomatosis uterina.
Lea También: Desensibilización de la Secreción de Gonadotropinas
Abstract
The modifications to the native LH-RH produced the aparition of the analogs: agonist whose applications in the area of reproductive medicine has been shown to be safe and effective in the treatment of different diseases, and antagonist of recent studies and aparition.
There are special situations in which we need a fast suppresion of endogenous gonadotropin production, and by the initial stimulatory effect of the analog, it is not accomplished. The use of the LH-RH antagonist cause an immediate inhibition of FSH and LH by competitive blockade of the receptors, which makes their use optimal in the case of assisted reproduction technics and ovulation induction.
Other potential indications would be those cases in which an endogenous suppresion of the production of sex steroids is required, which is the case of benign protatic hiperplasia, prostate carcinoma, ovarian carcinomas in which they have demonstrated a promisory utility.
Key Words: LHRH/GnRH/ GnRH Antagonist/ ovarian stimulation/ cancer treatment/ gonadotropins/uterine miomas.
Introducción
La GnRH nativa juega un papel importante en el control de la funciones reproductivas de la mujer. Es liberada de manera pulsátil por las neuronas
hipotalámicas, se une a receptores específicos en los gonadotropos hipofisiarios y produce un control de la secreción de las gonadotropinas, LH y FSH. Las modificaciones a éste decapéptido hacen parte del armamento médico ya que interfiere con la producción de estas hormonas hipofisiarias y así de la acción en el sitio efector.
EL decapéptido GnRH fue aislado de extractos hipotalámicos y su secuencia de aminoácidos Pyro-Glu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-amide fue descrita por los grupos de Andrew Schally quien lo llamo LH-RH y Robert Guillemin quien la llamó LRF1-3. Actualmente hay una tendencia a llamarlo nuevamente LH-RH por la elevada frecuencia de confusión con la GH-RH4.
El reemplazo o deleción de diferentes aminoácidos dentro de la molécula original de GnRH, resultó en el descubrimiento de los agonistas de la GnRH que se caracterizan por su potencia para la liberación de las gonadotropinas.
Cuando los agonistas son administrados continuamente, luego de una estimulación inicial, se produce el efecto opuesto: inhibición de la secreción de gonadotropinas y de esteroides sexuales. Los mecanismos de este efecto están basados en una desensibilización de los gonadotropos (células productoras de gonadotropinas) y una regulación baja (down regulation) de los receptores hipofisarios, que conduce a una hipofisectomía médica selectiva.
Las modificaciones de la estructura del péptido GnRH:
Han conducido a la aparición de potentes agonistas que se utilizan en el tratamiento del cáncer de próstata, de mama, y en muchas aplicaciones en endocrinología reproductiva e infertilidad5. La utilización de los agonistas en la estimulación ovárica ha mejorado los resultados en éste campo al reducir el numero de ciclos cancelados debido a la aparición de los picos de LH cuando se realizaban inducciones de ovulación a base de gonadotropinas de orina de mujer menopaúsica (hMG) para la Fertilización In Vitro (FIV). Al mismo tiempo afectaban negativamente la calidad de los ovocitos y embriones y las subsecuentes tasas de embarazo6.
El uso de los agonistas de GnRH redujo la tasa de cancelaciones a menos del 2%, fue posible coordinar las inducciones de ovulación disminuyendo la tensión sicológica que se producía en los pacientes y en el equipo médico, y su empleo pasó a ser un esquema de primera línea en los programas de reproducción asistida7.
Actualmente se utilizan diferentes esquemas de administración de la GnRH en inducción de ovulación: el llamado protocolo largo. En el cual se inicia la aplicación desde la fase lútea del ciclo previo, entre los días 20 a 22 para conseguir una supresión total de la producción endógena de gonadotropinas. El protocolo corto y ultracorto que busca aprovechar el flare-up inicial de gonadotropinas para reclutar una mayor cantidad de ovocitos8. La estimulación ovárica utilizando los análogos de GnRH asociados a
gonadotropinas de origen urinario y mas recientemente de origen de técnicas de ingeniería genética (las llamadas recombinantes) ha demostrado ser altamente eficiente en los programas de técnicas de reproducción asistida9.
De otro lado la desventaja que tiene la aplicación del protocolo largo de GnRH:
Está en el mayor número de días de aplicación del medicamento así como el requerimiento de un mayor numero de ampollas de gonadotropinas (lo cual eleva los costos) y la obtención de un gran número de ovocitos al aspirar los ovarios.
Lo anterior y debido a la alta tasa de fertilización que se obtiene con la utilización de la inyección intracitoplasmática de espermatozoide (ICSI). Independiente de la morfología espermática, no justifica la utilización de este tipo de protocolo largo en todas las pacientes, y mucho menos en las que se conoce que tienen una pobre respuesta como antecedente.
Así mismo, la pregunta sería como disminuir la complejidad y los costos de la administración prolongada de estos medicamentos10. El reducir la cantidad de gonadotropinas y el numero de ovocitos maduros (metafase II) pueden ser la metas de los tratamientos de inducción de ovulación. Bajando los costos y los riesgos para los pacientes. Es aquí donde la introducción de los antagonistas de la GnRH o LH-RH abren nuevas posibilidades y opciones terapéuticas en el área de la endocrinología reproductiva.
Sin embargo, hay situaciones en las cuales se requiere de una supresión inmediata de la producción de las gonadotropinas, y no se logra, ya que existe un efecto negativo previo por la administración de los agonistas dado su efecto estimulante inicial y su relativo largo efecto en la exposición crónica (2-3 semanas) .
De otro lado, los antagonistas, por su mecanismo de acción pueden producir una inhibición inmediata de la liberación de gonadotropinas. Al unirse competitivamente a los receptores y bloquear la acción estimuladora tipo flare-up de la GnRH endógena en las células hipofisiarias , los convierten en una nueva alternativa .
Hace 20 años se empezaron las investigaciones para sintetizar los antagonistas:
Mediante modificaciones en la estructura molecular de la GnRH nativa en las posiciones 1, 2, 3, y 8, y 10, con el inconveniente de ser inicialmente lipofílicos y por consiguiente producían una reacción edematogénica o anafilactoide, causada por la liberación de histamina principalmente11.
La inclusión de nuevas sustituciones en los aminoácidos de la molécula de la GnRH ha conducido a la mejoría de los antagonistas. Sin los efectos indeseables de la liberación de histamina. Dos de estos compuestos, el Cetrorelix y el Ganirelix han sido probados en estudios clínicos y han demostrado seguridad y eficacia. Siendo su principal efecto la inhibición inmediata de la secreción de las gonadotropinas y así de la producción gonadal de esteroides sexuales12-15.
Química
En la actualidad los más utilizados son los de tercera generación, cuyos exponentes más representativos son el Cetrorelix y el Ganirelix.
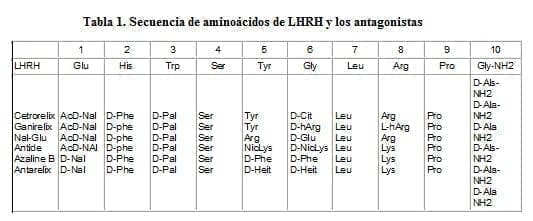
El Cetrorelix fué sintetizado en la Universidad de Tulane en 199011 y es el resultado de una modificación a la secuencia nativa de LHRH mediante la inclusión de 5 aminoácidos en las posiciones 1, 2, 3, 6, y 10 en el caso del Cetrorelix y una adicional en la 8, en el Ganirelix, los cuales están en una configuración no-D (Tabla 1). Los grupos terminales amino y acetil le dan estabilidad y son mandatorios para completar la actividad antagonista.
Hay una tendencia a la agregación y a la formación de gel, así como a los fenómenos de absorción en general. Los cuales fueron reducidos manejando el péptido en una solución acuosa para transferirlo antes de la liofilización15.
Estabilidad
Los péptidos están sujetos a hidrólisis, oxidación, foto descomposición, y proteolisis enzimática dentro de otros procesos. El Cetrorelix es un péptido estable a una temperatura ambiente a un pH de 7.0 durante 21 días, con una descomposición significativa a valores de pH mas altos o mas bajos. Es resistente a la oxidación con H2O2 en condiciones
neutras. Almacenada en refrigerador a una temperatura entre 2-8°C permanece estable hasta 3 años. Una vez reconstituida la solución permanece estable hasta dos días15. Además es altamente resistente a las enzimas degradantes como la quimiotripsina, pronasa y nargasa hasta por lo menos 50 horas a 37°C. Esta es una característica que lo diferencia de los agonistas que se degradan en pocas horas. Es debida a la presencia de Citrulina en la posición 616.
El Receptor y el Mecanismo de acción de la LHRH
La LHRH se une a receptores específicos en el gonadotropo hipofisiario, los cuales son regulados por la misma LHRH o por otras hormonas.
Esa regulación determina la actividad biológica de esas células. La activación de esos receptores conduce a la generación de diversas señales moleculares de transducción que inician la exocitosis de gonadotropinas y están involucradas en la expresión de RNAm de FSH y LH. Las modificaciones en ciertos aminoácidos de la LHRH nativa han conducido a la aparición de los agonistas y antagonistas17. Los estudios del receptor se han realizado clonando una línea de células gonadotrópicas alfaT3-1 de un ratón.
El Receptor-LHRH cDNA codifica una proteína de 327-328 aminoácidos con siete dominios putativos diseminados por la membrana, característico de la familia de los receptores que unen las proteínas G. El receptor LHRH pierde el carboxi terminal intracelular. La presencia de varias transcriptasas brindan la posibilidad de que existan otras formas funcionales alternativas de receptores de LHRH. Usando agonistas radiomarcados se ha podido caracterizar los sitios de unión específicos.
El análogo se une al receptor con una constante de disociación de 0.20nM en la rata y de 0.32 a 4.8 nM en el tejido hipofisiario humano. El total de número de sitios de unión es de 0.31 pM/mgr(18-20).
La regulación del número de receptores está dada por la presencia de LHRH dependiente de la dosis y el tiempo. Al inicio de su administración se produce una disminución inicial de los receptores, seguidas por un incremento prolongado. La exposición continua del gonadotropo a concentraciones elevadas de LHRH produce una disminución de los sitios de unión.
De otro lado, se ha postulado una regulación independiente del número de receptores y de los niveles de RNAm:
Lo cual sugiere una regulación post-transcripcional homóloga del receptor. Sin embargo, también se ha encontrado al mismo tiempo acciones de LHRH y de sus agonistas dependiente del tiempo y de la dosis en el numero de receptores y los niveles de RNAm19.
Una vez se une LHRH o sus análogos al receptor, el complejo es internalizado vía endocitosis, entra en disociación seguido por degradación del ligando y el reciclamiento parcial del receptor. En esto se diferencia del antagonista, que permanece unido a la superficie de la célula por largos periodos.
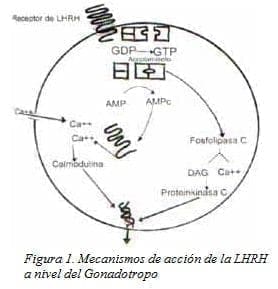
La endocitosis del complejo receptor ligando no es necesaria para la secreción inducida por LHRH. Además, la desensibilización del gonadotropo por los agonistas puede disociarse del proceso de internalización19 (Fig. 1).
La regulación del receptor puede ser heteróloga también, como se ha logrado demostrar en los cultivos de células de hipófisis anterior de animales. Donde se ha observado un incremento de los receptores en presencia de estradiol durante largos periodos, y una disminución luego de exposición por tiempos cortos.
Estos efectos pueden ser responsables de los efectos del estradiol en la secreción de gonadotropinas inducida de por la LHRH. De otro lado, la progesterona tiene un efecto estimulador en los receptores de LHRH, mientras que los esteroides ejercen una acción inhibidora.
Los péptidos gonadales activina A y folistatina son también reguladores de los receptores de la LHRH. La activina A puede modular la respuesta del gonadotropo a la LHRH. Mediante un aumento de la expresión de LHRH-R, acción que es antagonizada por la folistatina. Varias moléculas segundos mensajeros de las vías de transducción de las señales de LHRH, también están involucradas en la regulación del receptor.
Señales de Transducción de LHRH
Los mecanismos de acción de la LHRH se han podido entender gracias a los estudios realizados en las señales de transducción.
Una vez que llega la LHRH se activa el receptor incrementando la actividad de la Fosfolipasa C, que produce un rompimiento del fosfoinositol, lo cual genera fosfatos de inositol y diacilglicerol. La producción de fosfatos de inositol se encuentra modulada por estradiol y progesterona. Uno de los fosfatos de inositol, el 1,4,5-tri-fosfato se une a canales intracelulares específicos del receptor liberando Ca2++ del retículo endoplasmático.
De otro lado, LHRH induce un incremento bifásico de la concentración intracelular de calcio dosis/dependiente semejando la producción de los inositoles trifosfatos. A mayores niveles de llegada de LHRH se produce un aumento en la frecuencia de las oscilaciones del calcio, las cuales están influenciadas por la presencia de estradiol y progesterona. El mecanismo que media la acción de los esteroides ováricos sobre las señales de calcio se sitúa distalmente a la producción de fosfatos de inositol, ya que los efectos esteroideos sobre la producción de fosfatos de inositol inducidos por agonistas y los incrementos de calcio intracelular no son necesariamente paralelos21-23.
La LHRH produce un vuelco del fosfatidilinositol que resulta en la en la producción de fosfatos de inositol y diacilglicerol. El diacilglicerol activa la proteinkinasa C. Los activadores de la proteinkinasa C inducen la secreción de LH por parte del gonadotropo. Mientras que los inhibidores llevan a una respuesta secretoria reducida a la LHRH. Estudios en ratas han demostrado la expresión de diferentes izo enzimas de la proteinkinasa C en los gonadotropos, a saber, alfa, beta II, delta, epsilon y z. Alfa y beta median respuestas exocíticas.
La proteinkinasa C activa la expresión de genes para las fracciones beta de LH y FSH.
Los esteroides también influencian la actividad de la proteinkinasa C y la liberación de gonadotropinas inducida por los ésteres del forbol. Lo que indica que esta vía de transducción de la señal se encuentra involucrada en la modulación esteroidea de la exocitosis de los gonadotropos mediada por LHRH24-25.
Ha sido descrito el aumento de cAMP y cGMP en respuesta a la LHRH. A pesar de ser controversial, el cAMP parece tener un rol en la sensibilización del gonadotropo a la LHRH. La producción de cAMP puede aumentarse por el estradiol, y este efecto puede mediar la acción estimuladora del estradiol sobre la secreción de LH inducida por LHRH19.
Las proteinkinasas mitógeno activadas (MAPK) se encuentran involucradas en la transmisión de señales de crecimiento extracelular y señales de diferenciación dentro del núcleo celular. Ha sido recientemente demostrado que algunos receptores proteína G acoplados pueden activar MAPK y que MAPK puede estar también involucrada en señales no proliferativas. MAPK puede ser también activada por la proteinkinasa C, dado que la activación de MAPK inducida por LHRH se encuentra bloqueada en células depletadas de proteinkinasa C19.
El ácido araquidónico persé y sus metabolitos dependientes de la lipooxigenasa inducen la liberación de LH por parte del gonadotropo, teniendo así el ácido araquidónico y los leucotrienos funciones de segundos mensajeros22.


