Trabajos Originales
Presentación de casos y revisión de temas
JULIÁN DAVID MARTÍNEZ, MARIO HUMBERTO REY T., JUAN CARLOS MOLANO, MARTÍN ALONSO GARZÓN, LUIS GONZALO GUEVARA, JUAN CARLOS MARULANDA: UNIDAD DE GASTROENTEROLOGÍA, HOSPITAL UNIVERSITARIO DE LA SAMARITANA, BOGOTÁ, DC. RICARDO EMILIO AMAYA, UNIDAD DE GASTROENTEROLOGÍA, HOSPITAL SAN BLAS, BOGOTÁ DC.; SANDRA HENAO, UNIDAD DE INMUNOLOGÍA, HOSPITAL UNIVERSITARIO DE LA SAMARITANA, BOGOTÁ DC.
Resumen
La anemia perniciosa es considerada una enfermedad autoinmune, en la cual coexisten la anemia megaloblástica por deficiencia de vitamina B12 y la gastritis crónica atrófica corporal difusa (gastritis tipo A), asociándose frecuentemente con otros trastornos autoinmunes.
Es una entidad poco frecuente y subdiagnosticada.
Se presentan 10 casos de pacientes con anemia megaloblástica (siete mujeres, tres hombres), que consultaron al Hospital Universitario de la Samaritana y al Hospital San Blas, con diagnóstico definitivo de anemia perniciosa.
Palabras clave: anemia, perniciosa, célula parietal, anticuerpos, autoinmunidad.
Summary
Pernicious anemia is considered an autoimmune disease, in which vitamin B12 deficient megaloblastic anemia and atrophic diffuse chronic corporal gastritis (type A gastritis) coexist, often associated with other autoimmune disorders. It is an infrequent under-diagnosed entity. Ten cases of patients with megaloblastic anemia (seven women and three men) who presented for consultation at the Universitario de la Samaritana and San Blas Hospitals with a definitive diagnosis of pernicious anemia are reviewed.
Key words: anemia, pernicious, parietal cell, antibodies, autoimmunity.
Presentación de casos
Se presentan 10 casos de pacientes que asistieron a la consulta de gastroenterología del Hospital Universitario de la Samaritana y del Hospital San Blas, con diagnóstico de anemia megaloblástica, siete mujeres y tres hombres entre los 19 y 85 años de edad con un promedio de 52 años.
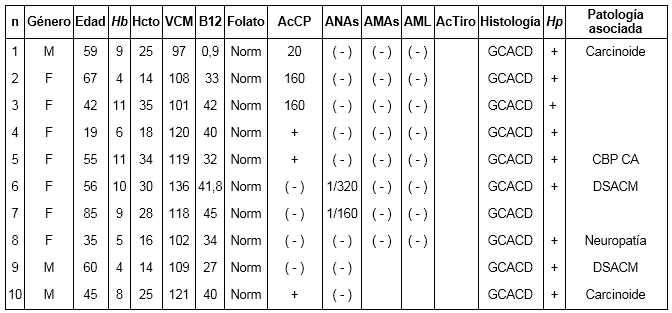
Se encontró gastritis crónica atrófica difusa corporal, en todos los pacientes. Seis de ellos tenían anticuerpos anticélulas parietales positivos (AcCP) y dos de los pacientes con AcCP negativo presentaron ANAs positivos.
Los niveles de vitamina B12 fueron bajos en todos los pacientes y el ácido fólico fue normal. Seis de los pacientes tenían patología asociada, dentro de las que se encontraron carcinoides gástricos en dos, degeneración subaguda combinada medular (DSACM) en dos, neuropatía periférica en uno, cirrosis biliar primaria más colangiopatía autoinmune en uno (Tabla 1).
Tabla 1. Descripción de los pacientes con anemia perniciosa
Los pacientes con anticuerpos anti célula parietal (AcCP) reportados (+), sin valor, es porque la técnica realizada para éstos fue cualitativa. ANAs: anticuerpos anti nucleares. AMAs: anticuerpos anti mitocondria. AML: anticuerpos anti músculo liso. Ac tiro: anticuerpos contra tiroides. Hp: Helicobacter pylori. GCAD: gastritis corporal atrófica difusa o tipo A. DSACM: degeneración subaguda combinada medular. CBP: cirrosis biliar primaria. CA: colangitis autoinmune.
La anemia perniciosa es una enfermedad en la que coexisten la anemia megaloblástica por deficiencia de vitamina B12 y la gastritis crónica atrófica corporal difusa (gastritis tipo A ). Se considera la causa más común de deficiencia de vitamina B12 (1).
La malabsorción de vitamina B12 (demostrada mediante el test de Schilling) es secundaria a la disminución o desaparición de las glándulas fúndicas con la subsiguiente disminución en la secreción del factor intrínseco.
Es considerada una enfermedad de base autoinmune. En los pacientes se detectan anticuerpos contra componentes de las células parietales, incluidos la H+ K+ ATPasa y el factor intrínseco (2, 3).
En la anemia perniciosa existen anticuerpos para tres antígenos de las células parietales gástricas.
Se han caracterizado dos de ellos en forma más completa, una glucoproteína llamada factor intrínseco y una lipoproteína de las microvellosidades del sistema canalicular de las células parietales. El tercero se encuentra en la membrana de la superficie de la célula parietal. Todos son específicos de estas células.
Los anticuerpos de las células parietales se encuentran en el suero del 90% de los enfermos con anemia perniciosa y los anticuerpos para el factor intrínseco en el 60% a 76% de ellos, según se ha determinado mediante técnicas de inmunofluorescencia.
Hay dos tipos de anticuerpos contra el factor intrínseco: el tipo I que bloquea el acoplamiento de la vitamina B12 con el factor intrínseco y el tipo II que reacciona con un sitio alternativo del factor intrínseco o con el complejo factor intrínseco-vitamina B12 impidiendo su unión a los receptores del íleon terminal.
Tradicionalmente se consideraba que los anticuerpos del tipo II, estaban presentes en 25% con respecto al tipo I y rara vez se presentaban en ausencia de éstos; pero, estudios realizados en la última década han informado su presencia solos o en combinación con los del tipo I, siendo más frecuente que lo informado, y los autores enfatizan la utilidad de las técnicas de laboratorio para detectar ambos tipos de anticuerpos.
Estos anticuerpos, son altamente específicos para la anemia perniciosa y pueden ser detectados en saliva, jugo gástrico y suero (4).
La evidencia demuestra que los anticuerpos:
Para el factor intrínseco son capaces de inhibir la absorción in vivo de vitamina B12 mediada por el factor intrínseco, y que el anticuerpo contra las células parietales canaliculares puede inhibir la secreción ácida liberada por las células parietales.
Además, se ha demostrado que en presencia del complemento, los anticuerpos de la clase IgG contra la superficie de la célula parietal poseen una citotoxicidad específica.
Los anticuerpos gástricos en el suero son primordialmente de la clase IgG, con algunos anticuerpos IgA y raramente IgM.
Los anticuerpos anticélulas parietales del sistema canalicular y los anticuerpos antifactor intrínseco, se encuentran en familiares en primer grado de consanguinidad anemia perniciosa, también se encuentran presentes frecuentemente en enfermos con tiroiditis, enfermedad de Addison, diabetes mellitus, vitiligo, todas éstas asociadas a la gastritis atrófica.
La frecuencia de los anticuerpos anticélulas parietales del sistema canalicular, aumenta con la edad en sujetos aparentemente sanos, y se puede detectar en el 5% de personas entre los 30 y 60 años y en el 15% de las mujeres mayores de sesenta años.
Estos anticuerpos rara vez son detectados, excepto en los pacientes con gastritis crónica. Su frecuencia aumenta con la edad (4-8).
Tanto la enfermedad como los anticuerpos anti células parietales, se asocian con alta frecuencia a otros trastornos autoinmunes tales como: tiroiditis autoinmune (de Hashimoto), enfermedad de Graves, diabetes mellitus tipo 1, enfermedad de Addison, falla ovárica primaria, hipoparatiroidismo primario, vitiligo, miastenia gravis, síndrome de Lambert Eaton, síndrome de Sjögren, lupus eritematoso sistémico y colitis ulcerativa (9-12).
Como otras enfermedades autoinmunes:
Ésta también parece tener una predisposición genética. El hallazgo de cambios atróficos del cuerpo gástrico y de anemia perniciosa en pacientes de una misma familia indica además que esta relación causal puede estar influenciada genéticamente.
Existen suficientes razones para creer que en estas familias interviene un mismo factor, probablemente genético, tanto en el desarrollo de la gastritis atrófica corporal difusa (tipo A) sin anemia perniciosa, como en la lesión gástrica de la anemia perniciosa manifiesta.
La enfermedad se asocia a los haplotipos del HLA A2, A3, B7 y B12, y al grupo sanguíneo A. La anemia perniciosa y los anticuerpos anticélulas parietales, se detectan más frecuentemente en familiares de los enfermos.
Estudios de biopsias gástricas demuestran atrofia de la mucosa en más del 30% de los parientes de enfermos con anemia perniciosa, la presencia de anticuerpos contra las células parietales en el 65% y anticuerpos contra el factor intrínseco en el 22% (13-15).
Inicialmente se consideró que la enfermedad estaba restringida a los ancianos de raza blanca del norte de Europa, en especial de Escandinavia, pero publicaciones posteriores han informado múltiples casos en mujeres jóvenes norteamericanas de raza negra,en habitantes latinoamericanos y en el sudeste asiático.
Se ha observado, que en mujeres negras y en latinoamericanas, la edad de presentación de la enfermedad es significativamente menor que la informada en Finlandia (64% de los pacientes son mayores de 60 años y el 32% de ellos mayores de 70 (16-18). Su prevalencia en Finlandia es del 0.16% al 1 % de la población.
En un estudio realizado en California en 729 personas mayores de 60 años, se encontró una prevalencia del 1.9 % de anemia perniciosa subdiagnósticada. La prevalencia calculada para las mujeres fue del 2.7% y para los hombres del 1.4% (20).
El fenómeno histopatológico básico de la anemia perniciosa:
Es la gastritis crónica atrófica (GCA) de la mucosa oxíntica. La atrofia progresiva causa desaparición de las células parietales (atrofia total), lo que desemboca en aclorhidia. La mucosa antral casi nunca desarrolla cambios atróficos y la aclorhidia aumenta sustancialmente la producción de gastrina por parte de las células G del antro por la pérdida de la retroalimentación negativa que normalmente ejerce el ácido.
Múltiples estudios han mostrado que la hipergastrinemia asociada a la anemia perniciosa induce la hiperplasia de células neuroendocrinas del fundus gástrico. La asociación de hiperplasia de células endocrinas y tumores carcinoides gástricos se ha descrito desde 1952, entre el 1% y 7% de los pacientes con anemia perniciosa bajo seguimiento endoscópico. Generalmente se presentan como pólipos pequeños únicos, aunque en el 10% de los casos son múltiples.
Generalmente son asintomáticos y se han informado metástasis a ganglios linfáticos y en menor frecuencia al hígado, hasta en el 20% de los casos (21, 22).
Se conoce la predisposición de los pacientes con anemia perniciosa a desarrollar adenocarcinomas gástricos. La aclorhidia, los cambios de metaplasia intestinal y la formación de sustancias carcinógenas como los componentes N-nitrosos, se han sugerido como posibles factores predisponentes.
Sin embargo, la prevalencia de adenocarcinoma gástrico no supera el 3% en las personas con anemia perniciosa y solo el 2% de los pacientes con adenocarcinomas gástricos se presentan concomitantemente con anemia perniciosa (23).
En un estudio de tamizaje en 56 pacientes con anemia perniciosa, realizado en Finlandia, se detectaron dos casos (3.6%) de adenocarcinomas gástricos tempranos y dos casos (3.6%) de tumores carcinoides en un lapso de tres años.
Los autores recomiendan la vigilancia endoscópica en los pacientes con anemia perniciosa en especial a los menores de sesenta años de edad (24).
El Helicobacter pylori ( H. pylori) es quizás:
La causa más frecuente de gastritis superficial en el antro y el cuerpo (25). La prevalencia de la infección en los humanos se incrementa con la edad, alcanzando más del 50% de prevalencia en la población mayor de cincuenta años en los países desarrollados y del 80% de los mayores de treinta años en países subdesarrollados (26).
En una población de riesgo, la prevalencia de gastritis atrófica se correlaciona directamente con la prevalencia del H. pylori en los jóvenes (25), lo que ha sugerido que la gastritis superficial asociada a la bacteria puede progresar a lo largo del tiempo hacia una gastritis atrófica (27).
Varis y cols han sugerido la posibilidad que el H. pylori esté involucrado en los estadios tempranos de la anemia perniciosa, iniciando una gastritis atrófica severa de la región fúndica (28), sin embargo varios estudios posteriores realizados en Europa y los EUA no han mostrado una clara asociación entre el H. pylori y la gastritis tipo A, en ellos la prevalencia de la infección por H. pylori encontrada en los pacientes con anemia perniciosa y en pacientes controles, fluctúa entre el 0% y el 21%, y 40% al 93%, respectivamente (29).
Además, un estudio realizado en Japón, país con alta prevalencia de infección por H. pylori y gastritis atrófica, y donde la anemia perniciosa es una enfermedad infrecuente, tampoco se encontró asociación estadística alguna (prevalencia de infección por H. pylori de 0% en pacientes con anemia perniciosa y de 67% en pacientes controles, p < 0.0001) (30).
A pesar de estos hallazgos se requieren estudios prospectivos que se inicien en estadios precoces de la gastritis atrófica corporal difusa, para precisar el verdadero papel del H. pylori en la anemia perniciosa.
Comentarios de la anemia perniciosa
En el grupo de pacientes informados hay un predominio de mujeres sobre hombres ( 7 : 3); llama la atención que el promedio de edad de 52 años sea bajo respecto al informado en Europa, pero similar a estudios norteamericanos y latinoamericanos.
La presencia de los anticuerpos contra las células parietales fue del 70%, situación que no contradice lo ya descrito por otros autores; se detectaron otros autoanticuerpos en cuatro pacientes, estando los antinucleares presentes en tres de ellos. En una paciente se realizó el diagnóstico de una hepatopatía crónica de etiología autoinmune.
La presencia del H. pylori en las biopsias gástricas se determinó en cinco pacientes (55%), cifra baja comparada con la prevalencia de esta bacteria en la población nacional, de más del 80% (31), pero es concordante con hallazgos realizados en otros países con características epidemiológicas similares para la infección por H. pylori como Japón, o también con el hecho conocido que este microorganismo no “gusta” de ambientes degradados (atróficos).
Se debe tener en cuenta que una de las principales causas de anemia megaloblástica, al descartarse origen alcohólico, es la anemia perniciosa sobre todo en mujeres.
Referencias
- 1. Toh J. Pernicious anemia. N Engl J Med1997, 337:1441.
- 2. Burman J. Pernicious anemia. Gastroenterology 1989; 96:1434.
- 3. De Aizpurua J. Pernicious anemia. N Engl J Med 1985; 313: 749.
- 4. Bardhan KD, Hall JR, Spray GH, Callender STE. Blocking and binding autoantibody to intrinsic factor. Lancet 1968; 2: 62-64.
- 5. Waters HM, Dawson DW, Howart JE, Geary CG. High incidence of type II autoantibodies in pernicious anaemia. J Clin Pathol 1993; 46: 45-47.
- 6. Irvine WJ. Immunologic aspects of pernicious anemia 1968; 273: 432 –435.
- 7. Taylor KB. Inmune aspects of pernicious anemia and atrophic gastritis. Clin Haematol 1976; (5): 497-500.
- 8. Taylor KB, Thomas H. Enfermedades del aparato digestivo e hígado. In: Sites D. eds, Basic & Clinic Immunology. Lange Medical Publications, 1984. p. 532-533.
- 9. Whittingham S, et al. Immunogenetics of pernicious anemia. In: Farid IR eds. The autoinmune diseases. Orlando, Fla. Academic Press, 1985: 243-266)
- 10. Doniach D Roitt MI, Taylor KB Autoinmune phenomena in pernicious anemia. Br Med J 1963; 1: 1374-76.
- 11. Pokorny G, Karacsony G, Lonovics J. Types of atrophic gastritis in patients with primary Sjögren‘s syndrome. Ann Rheum Dis 1991; 50:97-100.
- 12. Pedro-Botet J, Coll J, Tomas S. Primar Sjögren‘s syndrome asociated with chronic atrophic gastritis and pernicious anemia. J Clin Gastroenterol 1993; 16:146-148.
- 13. Siurala M, Varis K. Gastritis and pernicious anemia. In: Sircus W, eds, Scientific Foundations of Gastroenterology. Medical Books Ltd, London, 1983. p. 386-388.
- 14. Ungar B, Mathews JD, Tait BD. Cowling DC. HLA-DR patterns in pernicious anaemia . Br Med J 1981; 282: 768-770.
Bibliografías
- 15. Varis K, Ihamaki T, Harkonen M, et al. Gastric morphology, function, and immunology in first-degree relatives probands with pernicious anemia and controls. Scan J Gastroenterol 1979; 14: 129-132.
- 16. Carmel R. N Engl J Med 1978; 298: 647-50.
- 17. Carmel R, Johnson C, Weiner J. Pernicious anemia in latin americans is not a disease of the elderly. Arch Intern Med 1987; 147: 1995-1996.
- 18. Au WY, Hui CH, Chan LC, et al. Clinicopathological features of megaloblastic anaemia in Hong Kong: a study of 84 chinese patients. Clin Lab Haematol 1998; 20: 217-219.
- 19. Sipponen P. Atrophic gastritis as a premalignant condition. Ann Med 1989; 21: 287-89.
- 20. Carmel R. Arch Intern Med 1996; 156:1097-100.
- 21. Borch K, Renvall H, Liedberg G. Gastric endocrine cell hyperplasia and carcinoid tumors in pernicious anemia. Gastroenterology 1985; 88: 638-648.
- 22. Weekly. Clinicopathological exercises. Case 9 -1997. N Engl J Med 1997; 336: 861-867.
- 23. Stockbrugger RW, Menon GG, Beilby JOW, et al. Gastroscopic screningin 80 patients with pernicious anaemia. Gut 1983; 24:1141-1147.
- 24. Sjoblom SM, Sipponen P, Jarvinen H. Gut 1993; 34: 28-32.
- 25. Grahan DY, Adam E, Klein PD, Evans DJ, et al. Epidemiology of Campylobacter pylori infection. Gastroenterol Clin Biol 1989;13: 84B-88B.
- 26. Gutiérrez O, Sierra F, Gómez MC, Camargo H. Campylobacter pylori in chronic enviromental gastritis and duodenal ulcer patients (abstr) Gastroenterology 1989; 94: A163.
- 27. Karnes WE, Sanloff MI, Siurala M, Kekki M, et al. Positive serum antibody and negative tissue staining for Helicobacter pylori in subbjects with atrophic body gastritis. Gastroenterology 1991; 101:167-74.
Fuentes
- 28. Varis O, Valle J, Siurala M. Is Helicobacter pylori involved in the pathogenesis of the gastritis characteristic of pernicious anaemia? Scand J Gastroenterol 1993; 28: 705-708.
- 29. Perez-Perez GI. Role of Helicobacter pylori infection in the development of pernicious anemia. Clinical Infectious Diseases 1997; 25:1020-1022.
- 30. Haruma K, Komoto K, Kawaguchi H, Okamoto S, et al Pernicious anemia and Helicobacter pylori infection in Japan. Am J Gastroenterol 1995; 90: 1107-1110.
- 31. Gutiérrez O. Helicobacter pylori y enfermedad gastrointestinal. Instituto famacológico colombiano LTDA. ITALMEX. Primera edición, Bogotá, 1993. p.43-54.
Rev Colomb Gastroenterol 2002;16:176-179