Este es un estudio de tipo descriptivo de corte transversal.
Los criterios de inclusión fueron los siguientes:
- Pacientes adultos, mayores de 15 años,
- Ingreso a la Unidad de Gastroenterología para endoscopia de vías digestivas altas,
- Aceptación escrita por parte del paciente para entrar en el estudio,
- Diagnóstico confirmado de cáncer gástrico por estudio de patología del hospital, y
- Estudio y tratamiento en el hospital.
Los criterios de exclusión fueron los siguientes :
- Primero, Sin autorización por parte del paciente, existencia de contraindicación para realización de endoscopia o toma de biopsias,
- Segundo, Sin estudio de patología en el hospital o la suspensión del tratamiento por parte del hospital, y
- Tercero, Sin electroforesis por problema técnico o la práctica de algún tratamiento (cirugía, radioterapia o quimioterapia antes del ingreso al hospital.
El procedimiento llevado a cabo consistió en:
- Ingreso del paciente al estudio,
- Diligenciamiento del cuestionario sobre datos clínicos, estudios paraclínicos y datos quirúrgicos completos del paciente para la clasificación del estadio tumoral, y
- Realización de la endoscopia de vías digestivas altas, durante la cual se tomaron biopsias del tumor para el estudio de histología, 6 en promedio, otras 3 para el estudio de cimografía y 3 de tejido normal adyacente que sirvieron como control.
Las muestras del tumor para patología se incluyeron en formol y fueron enviadas para estudio histológico.
Lesiones ulceradas sospechosas de cáncer gástrico
Las tres muestras del tumor y las tres de tejido normal adyacente para cimografía,se colocaron inmediatamente en nitrógeno líquido y, posteriormente mantenidas congeladas a -70 º, hasta ser procesadas para la electroforesis. Adicionalmente, se investigaron tres pacientes con lesiones ulceradas sospechosas de cáncer gástrico endoscópicamente, en quienes el estudio histológico descartó cáncer; en ellos se realizaron biopsias para estudio de tejido histológico y actividad de metaloenzimas. Estos casos se utilizaron como controles adicionales.
Procesamiento de la muestra tisular para cimografía (Figuras 1, 2 y 3): Se retiraron las muestras del congelador a -70 °C y se dejaron llegar a temperatura ambiente.
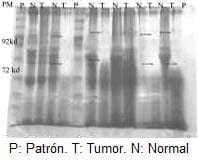
Figura 1. Electroforesis de proteínas. Comparación del patrón de pesos moleculares de tejido normal y tumoral.
A cada biopsia se le adicionó solución tamponada de Laemli (SDS al 0/1%, azul de bromofenol, TRIS-HCl 0,1 M, pH 0-8,8).
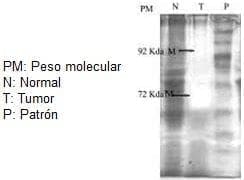
Figura 2. Caso de cáncer gástrico.
Comparación delpatrón de pesosmoleculares en tejido
normal y tumoral.
Luego, estas muestras se maceraron por ultra sonido durante 30 min en un sonicador Beckman, a máxima potencia, para disgregar y extraer las proteí nas solubles en el detergente.
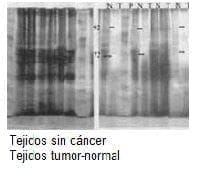
Figura 3. Comparación de la actividad de metaloproteinasas. Aspecto de la placa de siembras de tejido sin cáncer gástrico comparado con la placa de siembras adyacentes de tejido tumoral y normal.
Posterior al tratamiento,las muestras se sometieron a electroforesis en geles de poliacrilamida al 10%, que contenían gelatina al 1%, en condiciones parcialmente desnaturalizantes. Cada muestra se sir vió de la misma manera que los patrones de peso molecular de amplio rango (210 a 40 kDa). El proceso electroforético se realizó a 150 voltios.
Luego de la electroforesis, los geles obtenidos se lavaron con tritón al 2,5%. Posteriormente, se incubaron a 37 ºC por 18 horas con metales de cinc y calcio; este último activa las metaloenzimas.
Finalmente, los geles se tiñeron con azul brillante de Coomassie en metanol al 50%y las bandas de actividad se revelaron al desteñir con una solución de ácido acético, metanol y agua. Las zonas claras o transparen- tes del gel corresponden a la actividad enzimática de las metaloproteasas.
Métodos estadísticos: Las bases de datos fueron diseñadas en programas compatibles con computadoras IBM, los cuestionarios se digitaron por duplicado y en el programa Epiinfo se corrió el comando MERGE, para verificar errores; aquellos detectados se verificaron con el cuestionario.
Se utilizó Stata versión 6.0 y el programa Epiinfo 6.02 B de los Centers for Disease Control and Prevention, CDC, de Atlanta.
Las siguientes variables se consideraron como binarias: metaloproteinasas con peso molecular de 72 kda en tejido normal y tumoral, metaloproteinasas con peso molecular de 92 kda en tejido normal y tumoral, Helicobacter pylori y resecabilidad del tumor; como variables categóricas:estadio tumoral, patología y sexo; y, como continuas, fosfatasa alcalina, albúmina y la edad.
Para la comparación estadística, se utilizó el ji cuadrado y en los grupos de celdas con valores esperados menores de 5, se utilizó la prueba exacta de Fisher.
Se consideró como nivel de significancia, un P menor de 0,05.
Resultados
Se incluyeron dentro del estudio, 27 pacientes, de los cuales se analizaron 54 muestras, 27 de tejido tumoral y 27 de tejido normal adyacente, además de 6 muestras en las que inicialmente se sospechó cáncer y se descartó este diagnóstico por patología.
El número de mujeres fue 9 (33,3%)y el de hombres 18 (66,7%).
Los diagnósticos clínicos más frecuentes fueron: Síndrome pilórico, 15 paciente (55,6%), seguido de síndrome constitucional en 4 (14,8%), dolor abdominal en 4, (14,8%)y hemorragia de vías digestivas altas asociado a anemia en 4 (14,8%).
La edad mínima hallada fue de 47 años, con máxima de 78 y con promedio de 60 años.
Para los exámenes paraclínicos analizados:
La fosfatasa alcalina fue normal en 14 pacientes y elevada en 13. La albúmina fue normal en 16 casos y baja en 11; la prueba de ureasa para Helicobacter pylori se encontró positiva en todos los pacientes (100%). En cuanto al diagnóstico histológico, se encontró que el tipo intestinal fue el más frecuente, en 14 pacientes (51,9%), el tipo difuso se halló en 7 (25,9%) y el indiferenciado en 6 (22,2%).
Para el estadio tumoral, se encontró que la mayor parte de los pacientes tenían estados avanzados: 13 pacientes (48,1%) fueron estadio IV,8 pacientes estadio III B (29,6%) y 6 pacientes, estadio IIIA (22,2%); no se encontraron pacientes con estadios mas bajos. En relación a la resecabilidad fue posible en 12 pacientes (44,4%), y no lo fue en 15 (48%).
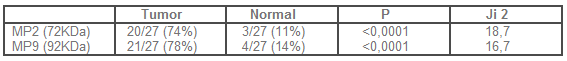
En el estudio de la actividad de las MP por electroforesis, se encontraron positivas dos enzimas que se encontraban con un peso molecular de 72 kD (MP 2) y otra de 92 KD (MP9).
Para la proteína encontrada con peso molecular de 72 (MP2, colagenasa tipo IV) en tejido normal, se encontró positiva sólo en 3(11,1%), y en 20 (74%) en tejido tumoral Pearson x 2 = 2 = 18,7, p<0,0001 (Tabla 2).
La proteína encontrada con peso molecular de 92 (MP 9, colagenasa tipo IV), se encontró positiva en tejido normal en 4 muestras (14,8%) vs. 21 muestras de tejido tumoral (77,8%). Pearson x 2 =16,7, p < de 0,0001 (Tabla 2).
Tabla 2. Actividad de metaloproteinasas 2
y 9 según tejido tumoral o normal.
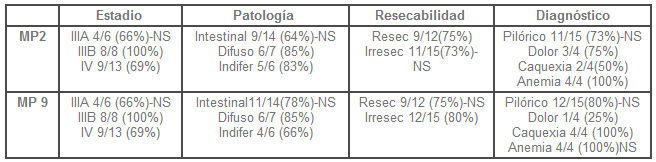
No se encontró diferencia significativa para la actividad de MP cuando se correlacionó la actividad de MP2 en tejido tumoral según el estadio: III A, 4 muestras de 6 (66%), IIIB, 8 muestras de 8 (100%) y para estadio IV, 8 de 13 (61%) p=0,22. Tampoco en la actividad de MP 9: IIIA 4, de 6(66%), IIIB, 8 de 8 (100%) y IV, 9 de 13 (69%), P=0,66 (Tabla 3).
No se encontró diferencia significativa de la actividad de MP2, según el tipo histológico: intestinal 9 de 14 (64%), difuso, 6 de 7 (85%) e indiferenciado, 5 de 6 (83%)x 2 =0,030, p=0,985; no para la MP 9, tipo intestinal, 11 de 14 (78%), difuso, 6 de 7 (85%) e indiferenciado, 4 de 6 (66%); x 2 = 0,97 p=0,61 (Tabla 3).
Tabla 3. Características clínicas en la actividad de MP2 y MP9.
En cuanto a la resecabilidad tumoral,tampoco se encontró diferencia para la actividad de MP2; con muestra tumoral positiva en 9 de 12 (75%) de los resecables y positiva en 11 de 15 (73%) en los no resecables; Pearson x 2 =0,011, p=0,9.No se encontró diferencia significativa según el diagnóstico para la actividad de MP2: síndrome pilórico, 11 de 15 (73%), dolor abdominal, 3 de 4 (75%), caquexia 2 de 4 (50%) y hemorragia digestiva y anemia, 4 de 4 (100%); Ji 2 =1,38, p=0,70, tampoco para MP9: síndrome pilórico, 12 de 15 (80%), dolor abdominal, 1 de 4 (25%), caquexia 4 de 4 (100%) y hemorragia digestiva y anemia, 4 de 4 (100%); x 2 = 4,33, p=0,22
En los tres pacientes con lesiones ulceradas y sospecha inicial de cáncer gástrico por endoscopia, en los cuales se descartó un diagnóstico histológico de cáncer, la actividad de las metaloproteínas para MP 2 y 9 fue negativa, tanto en tejido obtenido de la úlcera gástrica como en el tejido normal adyacente.
Conclusiones
La investigación de la actividad de las MP en el cáncer gástrico es uno de los aspectos más interesantes y de mayor proyección en el estudio actual de la conducta biológica de ésta, la lesión maligna más importante en nuestro medio.
Este es el primer trabajo al respecto que se realiza en el país y los resultados confirman que existe una diferencia significativa en la expresión de las MP en el tejido tumoral con respecto al tejido normal.
Este hallazgo sugiere que este tipo de enzimas debe participar de una manera importante en el comportamiento agresivo e invasor del cáncer gástrico. Los resultados no evidencian una diferencia entre el tipo histológico intestinal y el difuso que explique la mayor tendencia de este último a desarrollar invasión y metástasis; y, por esto, no excluye la posibilidad en el futuro de utilizar inhibidores de metaloproteinasas en ensayos terapéuticos en cánceres de estadio avanzado, independientemente del tipo histológico.
Referencias
- 1. Goodman S, Von Dermark K. Matrix metalloproteinases and tumor invasion. Seminars in Cancer Biology 1996; 7.
- 2. Stetler-Stevenson WG, et al. Tumor cell interactions with extracellu lar matrix during invasion and metastasis. Ann Rev Cell Biol 1993; 9: 541-73.
- 3. Ray JM, Stetler-Stevenson WG . The role of matrix metalloprotei- nases and their inhbitors in tumor invasion. Eur Resp J 1993; 7: 2062-72.
- 4. Pei D, Weiss SJ. Dependent intracellular activation of the human stromelysin-3 zymogen. Nature 1995; 375: 244-7.
- 5. Brown PD, Gavazzi R. Matrix metalloproteinases inhibition, a review of anti-tumoral activity, Ann Oncol 1995; 6: 967-74.
- 6. Henrick S, Rasmussen MC, Carrn P. Matrix metalloproteinases inhibition as a novel anticancer strategy. harmacol Ther 1997; 7: 69-75.
- 7. Birkedal-Hansen H, Moore WG, Bodden MR, et al. Matrix metalloproteinases a critical review. Rev Oral Biol Med 1997; 4: 197-250.
- 8. Brown PD, Gavazzi R. Matrix metalloproteinases inhibition: a review of antitumor activity. Ann Oncol 1995; 974-6.
- 9. Docherty AJ, et al. Sequence of human tissue inhibitor of meta lloproteinases and its identity to erithroid-potentiating activity nature. 1994; 318: 66-9.
- 10. Jalkanen S, Jalkanen M. Lymphocyte CD4 binds the coohterminal heparin binding domain of fibronectine. J Cell Biol 1992; 116: 817-25.
- 11. Basset P, et al. A novel metalloproteinase gene specifically expressed in stromal cells of breast carcinoma. Nature 1990; 348: 699-704.
- 12. Urbansky SJ, et al. Expression of metalloproteinases and their inhibi tors in primary pulmonary carcinomas, Br J Cancer 1993; 66: 1188-94.
- 13. Urbansky SJ, et al . Expression pattern of metalloproteinases and their inhibitor changes with the progression of human sporadic colorectal neoplasia. Diagn Mol Pathol 1994; 2: 81-9.
Bibliografías
- 14. Muller D, et al. Increased stromelysin 3 gene expression is associated with increased local invasiveness in head and neck squamous cell carcinoma, Cancer Res 1991; 53: 165-9.
- 15. Hiroyuki Y, et al, Relation of enhanced secretion of active matrix metalloproteinases with tumor spread in human hepatocellular carcinoma, Gastroenterology 1997; 112: 1290-6.
- 16. Stleter-Stevenson WG, et al. Tumor cell interactions with the extracellular matrix during invasion and metastasis, Ann Rev Cell Biol 1993; 9: 541-73.
- 17. Testa JE. Loss of the metastasic phenotype by a human epidermoid carcinoma cell line,hep-3 is accompanied by creased expression of issue inhibitor of metalloproteinases 2.Cancer Res 1992; 52: 5597 – 603.
- 18. Honda M, et al. Matrix metalloproteinases-7 expression in gastric carcinoma Gut 1996; 39: 444-8.
- 19. Yamashita-k A. Expression and tissue localization of 7 metalloprotei nase in human gastric carcinoma. Int J Cancer 1998; 79: 187-94.
- 20. Sakurai O, et al. Expression of interstitial collagenase in gastric can cers J Cancer Res 1997; 88: 401-6.
- 21. Endo K, et al. Eevated levels of serum and plasma meta lloproteinases in patients with gastric cancer Anticancer Res 1997; 17: 1253-8.
- 22. Mori M, et al. Analysis of MMT1-MMP y MMP 2 expression in human gastric cancers. Int J Cancer 1997; 74: 316-21.
- 23. Torii A, et al. Plasma concentration of matrix metalloproteinase 9 in gastric cancer. Br J Surg 1997; 84: 133-6.
- 24. Sier CF, Kubben FJ, Ganesh S, et al. Tissue levels of matrix metallopro einases MMP2 and MMP-9 are related to the overall survival of patients with gastric cancer. Br J Cancer 1996; 74: 413-7.
- 25. Parsons SL, Watson SA, Collin HM, et al. Gelatinase (MMP2 and MMP 9) expression in gastrointestinal malignancy. Br J Cancer 1998; 78: 1495-502.