Esquema de la Mayo Clinic y modificado por el Memorial Sloan -Kettering
4.5.1 Las ventajas potenciales de una radioterapia preoperatoria son:
Biológicas:
- Disminuye las siembras tumorales en el momento de la cirugía.
- lncrementa la radiosensibilidad debido a la mejor oxigenación celular.
- Mejor tolerada por el paciente (comparada con la postoperatoria).
Físicas:
- Hay menor fijación del intestino delgado a la pelvis en el momento de dar la radiación (menor enteritis).
- Disminuye el volumen tumoral (_desocupando la pelvis_) facilitando la disección cortante del recto.
- Hace más fácil el dejar márgenes laterales negativos.
- Aumenta los índices de resecabilidad.
Funcionales:
- Ocasionalmente, permite cambiar una resección abdomino-perineal por una resección anterior baja de recto.
- Remueve el recto irradiado, disminuyendo los síntomas de proctitis por radiación.
4.5.2 Desventajas:
- No es posible hacer una clasificación precisa TNM porque hay una regresión tumoral (downstaging) (figuras 5a y 5b).
- Se pueden sobretratar pacientes.
4.5.3 Estandarización de la técnica:
Criterios de elegibilidad (16):
- Karnofsky mayor de 60
- Leucocitos mayores de 4.000 mm3
- Hemoglobina mayor de 10
- Plaquetas mayor de 150.000 mm
- Creatinina menor de 1,5
- Bilirrubinas totales menores de 1,5
Se administran bajas dosis de Leucovorin (20 mg/m2) en infusión endovenosa por 30 minutos y, 20 minutos más tarde, 5FU, 325 mg/m2 en el preoperatorio y 425 mg/m2 en el postoperatorio, administrado en bolos endovenosos diarios por cinco días, cada mes, durante 12 ciclos y simultáneamente, la radioterapia pélvica, 4680 cGy dividida en 180 cGy cinco días a la semana administrada por los campos AP, PA y laterales que comprenden desde el aspecto inferior del orificio obturador hasta L5/S1, con un incremento de 360 cGy para completar 5040 cGy.
El segundo ciclo de quimioterapia se da concomitantemente con la quinta semana de radiación. Posterior a la cirugía, la quimioterapia se reinicia después de 5 semanas, si está indicada (16).
La toxicidad de la terapia fue evaluada con los siguientes parámetros:
Fatiga 0= ninguna
1= requiere sueño o descanso extra
2= más alterada su rutina diaria
Diarrea 0= ninguna
1= 1 ó 2 episodios en 24 h
2= > de 2 episodios en 24 h
3= > de 2 episodios en 24 h a pesar de recibir 8 pastillas de lomotil/día
4= sanguinolenta o requiere soporte parenteral.
Tenesmo 0= ninguno
1= presente pero no significante.
2= incomodidad significante
3= intolerable
Movimientos intestinales
0= 1 a 2 en 24 h
1= 3 a 6 en 24 h
2= 7 a 10 en 24 h
3= > de 10 en 24 h
4= incontinente
Disuria 0= ninguna
1= presente, pero no hay una significante incomodidad
2= significante incomodidad
3= significante incomodidad, no mejora con Piridium
Eritema 0= ninguno
1= moderado eritema
2= descamación seca
3= descamación húmeda.
Náuseas
Vómito
Estomatitis
(mucocitis) Inicia al 7° día y dura unos 7 días.
Hematológica
Toxicidad grado 4
Si el paciente requiere hospitalización.
La toxicidad grado 3 con este esquema es de 18% preoperatoria y de 53% postoperatoria (16).
4.5.4 Resultados:
Para esta terapia, se pueden tener índices de respuesta clínica completa de 30% (desaparición macroscópica del tumor) y respuesta histopatológica de 13% (desaparición histológica del tumor) (figura 5-b).
 FIGURA 5-a. Foto por colonoscopia de un tumor de tercio medio de recto (uT3).
FIGURA 5-a. Foto por colonoscopia de un tumor de tercio medio de recto (uT3).
 FIGURA 5-b. Regresión tumoral (Downstaging) del mismo tumor de la figura 5a, ocho semanas después de radio y quimioterapia neoadyuvantes. Respuesta del 90%.
FIGURA 5-b. Regresión tumoral (Downstaging) del mismo tumor de la figura 5a, ocho semanas después de radio y quimioterapia neoadyuvantes. Respuesta del 90%.
Las dehiscencias anastomóticas pueden ser de 13%.
El efecto local de la radioterapia, incrementado por la acción radiosensibilizante de la acción de la quimioterapia asociada, origina profundos cambios en la estructura biológica y molecular del tumor y de los tejidos normales adyacentes expuestos al esquema de inducción. Los cambios se manifiestan en el análisis histopatológico habitual como: regresión tumoral (downstagin), fibrosis, infiltración linfocitaria, necrosis tumoral, etc.
La quimiorradioterapia neoadyuvante:
Actualmente está indicada en el manejo de tumores que, bajo evaluación clínica y paraclínica, son catalogados como locorregionalmente avanzados (T3, T4). Los reportes de las series más significativas indican una regresión tumoral mayor de 50% con una respuesta histopatológica completa (ausencia de tumor) del 7 al 30%. Cuando se presenta una regresión parcial del tumor, es frecuente encontrar ausencia de tumor superficial (mucosa) con presencia de nidos tumorales aislados en las diferentes capas residuales de la pared rectal, asociado con infiltración linfocitaria y fibrosis.
Este fenómeno pone de manifiesto la incapacidad de la metodología de análisis de las clasificaciones histopatológicas usuales para predecir el comportamiento biológico del tumor y determinar un pronóstico (un tumor que inicialmente es catalogado como T3 y que posterior al esquema de inducción queda con residual confinado a la submucosa, es decir, T1, no puede ser evaluado ni clasificado de la misma manera que un tumor T1 sin esquema de inducción).
Para tratar de interpretar este fenómeno, se propone evaluar la pieza de patología en grados de porcentaje en relación con el tumor residual con un estudio minucioso del espesor total del tumor (cortes de 1 a 2 mm) y estudio de, por lo menos, tres niveles del bloque de parafina. Con esta metodología asociada a técnicas de aclaramiento linfático, se ha logrado determinar una correlación entre el porcentaje de tumor residual y el pronóstico del paciente.
(Lea También: Anticuerpos Monoclonales y Radioinmunoscintigrafía (RIS))
4.6 Pacientes tratados con resección local y radioterapia postoperatoria
Hay un gran interés en la utilización de la resección local y la radio postoperatoria con el fin de disminuir la morbimortalidad (infecciones, transtornos urogenitales, etc.) de las cirugías estándares como la resección anterior baja de recto y la resección abdominoperineal.
La resección local antes de la radiación tiene como ventaja que los detalles histopatológicos como los márgenes, la profundidad de penetración en la pared intestinal y otros detalles histológicos pueden ser bien caracterizados; si se utilizara la radioterapia preoperatoria, el downstaging de la neoadyuvancia no lo permitiría (79).
La técnica consiste en la resección local por vía transanal o por vía de Kraske, seguida de 4500 a 5000 cGy en 4 a 6 semanas, algunos combinados con 5FU. El abordaje de Kraske tiene una morbilidad muy alta dada por fístulas en 16%, dehiscencia e infecciones en 8% que requieren para su manejo una colostomía derivativa (79, 84). Los tumores in situ no requerirán terapia adyuvante.
Las experiencias iniciales utilizaron este tipo de tratamiento para tumores T1, T2 y T3 (81).
Se han tratado de establecer algunos criterios de buen pronóstico para poder escoger una población muy selecta en la cual se obtengan resultados aceptables (bajos índices de recurrencia local) con este tipo de terapia, estos son (79-84):
- Tumores exofíticos
- Móviles
- Bien o moderadamente diferenciados
- No mucoproductores
- Menores de 4 cm de diámetro
- Que ocupen menos del 30% de la circunferencia
- Localizados a menos de 6 cm del borde anal
- Que no tengan invasión a capilares linfáticos o sanguíneos.
- No sea una enfermedad transmural.
- Que no queden márgenes positivos microscópicos o macroscópicos.
Radioterapia menores
A pesar de ser poblaciones tan seleccionadas, las recurrencias locales son para los T1, 0 a 10%; T2, a 17%; T3, 20 a 33% (82-83). Pero, cuando los márgenes quedan positivos, la recurrencia local es de 56% con dosis de radioterapia menores de 5000 cGy y un poco menores con dosis de 6000 cGy (81, 83-84).
En 1998, el Memorial Sloan- Kettering CC (80) estableció que los factores pronósticos más significativos para la recurrencia y la mortalidad de tumores T1 y T2 manejados con cirugía radical, son: la invasión a los capilares sanguíneos, la mala diferenciación del tumor y el ser de sexo masculino con p<0,05 reportando una recurrencia a 5 años de 12% y una supervivencia a 5 años de 90%, factores predictores que tienen igual importancia en el manejo de los tumores con resecciones locales.
Los patrones de recurrencia fueron: 27% local; 54% a distancia y 18% combinada (local y a distancia). Los patrones de recurrencia local se pueden subdividir en dos, las recurrencia locales murales y las recurrencias perirrectales; las murales son las que tienen una mayor posibilidad de ser rescatados con una cirugía radical (84).
En 1999, el C.C. Anderson (84) concluyó que la excisión local está recomendada para los tumores Tis y T1, encontrándose altas tasas de recurrencia para los tumores T2 y T3 manejados con esta técnica, reportando en su serie de 90 pacientes una recurrencia local del 5% para los T1, 20% para los T2 y 27% para los T3, dándole una gran importancia como factor predictivo de recurrencia y supervivencia al estadio (T) del tumor.
¿La pregunta es si estos resultados en una población tan seleccionada son comparables con las cirugías tradicionales?
Otra desventaja de la resección local es que no permite estudiar el estado de los ganglios del mesorrecto y determinar en forma adecuada el estadio de los tumores y comparar los resultados estadio por estadio con respecto a la cirugía estándar o tradicional.
Al correlacionar el T con el estado de los ganglios, se han reportado que para los T1 hay 12% de metástasis ganglionares; los T2, 22% y para los T3 y T4, 58% (85).
Debido a que la mayoría de las series son pequeñas con una gran cantidad de variables clínicas, patológicas y terapéuticas es necesario esperar hasta que hayan trabajos aleatorizados controlados que permitan tener conclusiones más definitivas.
4.7 Manejo de la recurrencia locorregional pélvica
El valor de la cirugía en el manejo de las recurrencias locorregionales después de una cirugía con fines curativos de un tumor primario de recto ha sido controvertida por considerar que son procedimientos técnicamente difíciles, con un alto índice de morbimortalidad, alto costo y una limitada supervivencia (75).
Las recurrencias locales se han clasificado como: (S0), asintomáticas; (S1) sintomáticas sin dolor; (S2), sintomáticas con dolor (75).
Las recurrencias también se han clasificado de acuerdo con el grado de fijación a las estructuras vecinas, así: (F0), no adherida a ningún sitio; (F1), adherida a un sitio; (F2), adherido a dos sitios; (F3), adherido a tres o cuatro sitios (75).
Recurrencias locales
Las cirugías utilizadas para el manejo de las recurrencias locales se han dividido en:
- Limitada, si no hay necesidad de resecar órganos adyacentes;
- Extendida, cuando se reseca parcial o totalmente alguno de los órganos vecinos (vejiga, uréteres, vagina, útero, próstata, vesículas seminales, sacro, coccis, intestino delgado, colon, epiplón mayor o porciones pequeñas de las paredes laterales de la pelvis.
Se han tratado de establecer factores pronósticos para hacer una adecuada selección de pacientes candidatos a una reoperación (75-78):
- Pacientes con recurrencias limitadas a la pared intestinal después de resección anterior baja de recto;
- Recurrencias en la línea media anterior (compromiso de vagina o sobre la cicatriz de la piel de la abdominoperineal);
- Lesiones que no estén fijas a las paredes laterales de la pelvis;
- Lesiones que no tengan compromiso de la cavidad peritoneal.
Se han podido establecer algunos de los factores de mal pronóstico para que un paciente no sea sometido a una reoperación (75-78):
- Extensión a las paredes laterales de la pelvis,
- Compromiso del nervio ciático con dolor en el miembro inferior,
- Obstrucción uni o bilateral de los uréteres,
- Edema unilateral de un miembro inferior,
- Metástasis a ganglios aórticos,
- Compromiso del tumor de múltiples asas de intestino delgado,
- Metástasis a distancia,
- Ascitis maligna.
Estos criterios de selección son muy similares para seleccionar pacientes que deben ser llevados a una exanteración pélvica.
Pacientes candidatos para ser llevados a cirugía para la resección de una recurrencia local
Bajo los anteriores parámetros, se podrán seleccionar los pacientes candidatos para ser llevados a cirugía para la resección de una recurrencia local. En la serie de la Mayo Clinic (75), en la cual se seleccionaron 224 pacientes para resección de una recurrencia local, 21% tenía enfermedad extrapélvica; 47% se hicieron cirugías paliativas (márgenes positivos macroscópica o microscópicamente), 31% de las cirugías tuvieron fines curativos con márgenes libres de tumor. El porcentaje mayor de pacientes con recurrencias que pudieron ser llevadas a una resección con fines curativos fueron los pacientes que habían sido sometidos a una resección anterior baja, siendo menos posible reoperar las recurrencias después de una resección abdominoperineal.
Las complicaciones severas en la resección de recurrencias locales se presentaron para F0 en 14%, para F1 en 31% y para F2 o F3, 44%, demostrando cómo la fijación de la recurrencia y de la extensión de la cirugía tienen una relación directa con las complicaciones (75).
La supervivencia a 5 años para este selecto grupo de pacientes operados con fines curativos fue de 34%, pero para los pacientes operados con fines paliativos (márgenes positivos macro o microscópicamente), la supervivencia a 5 años fue de 8%. La recurrencia a distancia después de una resección de una recurrencia local se presenta en 62%, en un seguimiento de 5 años.
Los autores concluyen que los resultados anteriormente obtenidos han sido en pacientes llevados a una primera cirugía sin resección completa del mesorrecto y sin utilización de terapias neoadyuvantes, posiblemente, pacientes que hayan sido llevados a una resección completa del mesorrecto o hayan tenido una terapia neoadyuvante y que recurran en forma local serán de más difícil manejo y control.
4.8 Tratamiento paliativo del tumor rectal
Existe un grupo de pacientes que están fuera de cualquier modalidad de tratamiento curativo, ya sea, por enfermedades concomitantes asociadas que impiden efectuar los mismos o por intensa actividad tumoral sistémica. Este grupo de pacientes se pueden beneficiar de tratamientos locales para mejorar su estado general y no deteriorar su calidad de vida.
Nosotros actualmente en nuestro servicio, manejamos este grupo de pacientes con dilataciones hidroneumáticas con presiones que oscilan entre 20 y 50 PSI y calibres de 16-18 mm, más electrofulguración y o quimioterapia intraluminal asociada con 5 FU, con el objetivo de tener un control local del tumor y una permeabilidad intestinal evitando el uso de colostomía para no deteriorar la calidad de vida del paciente (86).
Además, se han asociado esquemas de quimioterapia de segunda línea como el oxaliplatín, con resultados muy alentadores (89-90).
5. Técnicas de Diagnóstico de Recurrencia
5.1 Clínica:
Dolor, masa palpable
5.2 Antígeno carcinoembrionario:
Valor mayor a 5 ng/ml o valores en ascenso progresivo.
5.3 Tomografía axial computarizada:
Si hay una masa sospechosa, se confirma con citología, con aguja fina o con biopsia tru-cut.
5.4 Tomografía con emisión de positrones
La aplicación de la (TEP) está basada en los trabajos de Warburg en los años 30 (58) que observó que los tumores tienen una tasa muy alta de glicólisis aeróbica y anaeróbicas. Es una técnica imagenológica no invasora que permite evaluar directamente el metabolismo celular de la glucosa usando el 18 fluoro-2-deoxiglucosa (18 FDG) como radiotrazador (54) y con un escanógrafo compuesto por miles de cristales detectores de radiación interconectados a un computador. El isótopo radioactivo emitidor de positrones debe ser preparado con un bombardeo de ciclotrones y, luego, incorporado al radiofármaco (55).
El FDG es un análogo de la glucosa y como tal es tomado por los mecanismos transportadores sufriendo una fosforilación a hexocinasa. A diferencia de la glucosa 6 fosfato, la (FDG)-6- fosfato no se metaboliza más allá ni se difunde fuera de la célula. En células de poca o ninguna actividad, la glucosa -6- fosfato (la gran mayoría de células tumorales) queda atrapada dentro de la célula (53).
Las imágenes de la TEP identifican y cuantifican el tejido tumoral calculando las curvas de tiempo-actividad. La utilización del trazador se expresa como la relación de absorción diferencial (RAD) que es calculada con la ecuación, RAD=concentración tisular (n Ci/gr) dividida por la dosis inyectada (nCi/Wgr).
Luego de inyectar, el 18 FDG es rápidamente tomado por el tumor, en cambio el tejido no maligno escasamente lo absorbe. La mejor RAD (tejido tumoral vs. no tumoral) se encuentra una hora después de la administración del 18 FDG cuando la relación es el doble (56).
Diferenciar lesiones hepáticas benignas de las malignas
La mayoría de estudios de CCR usando TEP están enfocados a diferenciar lesiones hepáticas benignas de las malignas, a detectar enfermedad recurrente y metastásica y, finalmente, a investigar aumentos inexplicados del antígeno carcinoembrionario (ACE) en pacientes en seguimiento luego de resección quirúrgica.
Delbeke et al. (54) sometieron a estudio con TEP y, posteriormente, a biopsia y/o cirugía a 110 pacientes a quienes se les habían detectado lesiones hepáticas por TAC por diferentes motivos. Luego del estudio anatomopatológico de las lesiones, se determinó que había 97 lesiones malignas y 23 benignas.
El TEP demostró acumulación (18 FDG) aumentada (el doble de lo normal) en 100% (66 pacientes) con metástasis hepáticas, en 100% (8 pacientes) con colangiocarcinoma y en 55% (13 de 23 pacientes) de carcinoma hepatocelular. En cuanto a las lesiones benignas, la TEP no mostró aumento del (18 FDG) excepto por 3 abscesos (2 aumento no concluyente y uno con marcado aumento).
Inicialmente, a la tomografía computadorizada (TC) se le atribuían unos índices de sensibilidad de 93 a 95% en la detección de tumores recurrentes; pero, recientemente, esta sensibilidad ha disminuido hasta 50 a 60%, básicamente debido a la dificultad de diferenciar una cicatriz de un tumor recurrente (56).
En un estudio con 55 pacientes, la TEP fue superior a la TC detectando recurrencia local pélvica con una sensibilidad de 91% y especificidad de 100%, mientras que la TC tuvo una sensibilidad de 52% y una especificidad de 80%. En cuanto a metástasis hepáticas, la TEP tuvo una sensibilidad y especificidad de 95 y 100%, respectivamente, mientras que la TC tuvo una sensibilidad de 74% y especificidad de 85%.
El papel potencial de la TEP:
En la detección de recurrencia en pacientes asintomáticos con concentraciones aumentadas del ACE (mayor de 5 ng/ml) y exámenes de extensión convencional (examen físico, endoscopia, TC) negativos demostrado por Flanagan et al. (57), en donde 22 pacientes con ACE aumentado inexplicado por exámenes convencionales fueron sometidos a TEP siendo anormal en 77% de los casos con un valor predictivo-positivo de 89% (15 de 17) y predictivo negativo de 100% (5 de 5).
Aunque la resolución de la TEP está limitada a que la detección tumoral está confirmada a lesiones mayores o iguales de 15 mm (56), en 8 estudios (52) con un total de 378 pacientes que han demostrado una mayor sensibilidad y especificidad de la TEP comparada a la TC para determinar los estadios de CCR recurrente, detectando metástasis no sospechadas en 27% de los pacientes y a un cambio en el manejo quirúrgico en 37% de los pacientes.
Se han propuesto unas aplicaciones potenciales de la TEP (58):
- Diferenciar tumores recurrentes de la cicatriz quirúrgica, anatomía post-quirúrgica alterada, etc.
- Determinar la extensión y la localización tumoral cuando es indetectable por otros medios.
- Monitorización de la respuesta tumoral a la terapia, cuantificando tumor viable.
- Medición tisular de localización, concentración y actividad metabólica de drogas anticancerosas.


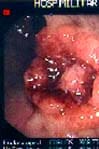 FIGURA 5-a. Foto por colonoscopia de un tumor de tercio medio de recto (uT3).
FIGURA 5-a. Foto por colonoscopia de un tumor de tercio medio de recto (uT3).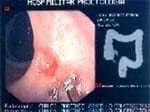 FIGURA 5-b. Regresión tumoral (Downstaging) del mismo tumor de la figura 5a, ocho semanas después de radio y quimioterapia neoadyuvantes. Respuesta del 90%.
FIGURA 5-b. Regresión tumoral (Downstaging) del mismo tumor de la figura 5a, ocho semanas después de radio y quimioterapia neoadyuvantes. Respuesta del 90%.