Respecto a la reducción de peso, se observó que la pérdida absoluta fue superior en la derivación gástrica, pero esto puede explicarse por el mayor peso que tenían los pacientes de este grupo antes de la cirugía. Por su parte, las pérdidas del exceso de peso fueron cercanas al 80 % en todos los pacientes y en ambos procedimientos por encima del 50 %, cifra a partir de la cual se define un procedimiento bariátrico como exitoso. Lo anterior sustenta la creciente frecuencia con la que se ofrece actualmente la manga gástrica como procedimiento bariátrico primario.
La pérdida acelerada de peso se produjo en el primer trimestre y casi siempre correspondió al 60 % de la pérdida que se logró al año. La mayor pérdida de peso se logró con ambas técnicas en los primeros tres meses y fue sucedida por una desaceleración a partir de este momento, de manera particular en el segundo semestre después de la cirugía. Estos resultados pueden constituir una referencia para proyectar el logro que se alcanzará al año de la cirugía, detectar aquellos pacientes con una pérdida de peso que se pueda considerar muy baja o desacelerada y realizar intervenciones oportunas durante el seguimiento.
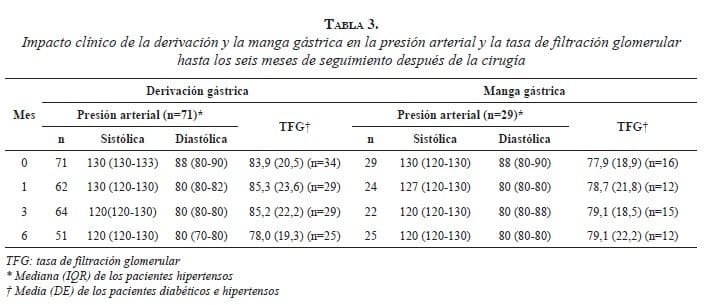
Los resultados en este estudio mostraron una caída de 10 mm Hg en la presión arterial sistólica y de 8 mm Hg en la presión arterial diastólica, al sexto mes de seguimiento. La mayor velocidad en el descenso se evidenció en las primeras consultas posquirúrgicas, siendo la reducción promedio de la tensión arterial por visita de 1 a 2 mm Hg superior en la derivación gástrica, logrando un control desde el primer mes después de la cirugía de la presión arterial diastólica (≤80 mm Hg) y desde el tercer mes la presión arterial sistólica (≤120 mm Hg) en ambos procedimientos. La magnitud de las caídas de la presión arterial coincide en el tiempo con la magnitud de la caída del peso, logrando su control al momento de la mayor pérdida de peso e inicio de su desaceleración. Se ha demostrado que 68 % de quienes se someten a procedimientos bariátricos presentan remisión o resolución de la hipertensión arterial 23, pero se ha reportado en algunos casos un retorno a las cifras prequirúrgicas después de dos años de seguimiento 24,25, por lo que el seguimiento de esta cohorte permitirá identificar la posibilidad de reversión de la hipertensión arterial en nuestra población.
Nuestros resultados sugieren que las modificaciones a favor del control de la tensión arterial se inician cuando el método permite una pérdida de peso de más del 10 % del peso prequirúrgico. Los estudios previos sugieren que este porcentaje es del 8 % 23,24. Sin embargo, en nuestra población la mayoría de los pacientes estaban en un programa de renoprotección para el control de la tensión arterial, por lo cual las cifras preoperatorias no eran muy altas; es posible que en estos casos se requiera mayor pérdida de peso para lograr iguales cambios en la tensión arterial. Asimismo, las diferencias en las poblaciones de estudio y en la definición del valor del control de la presión arterial sistólica, podrían explicar estas discrepancias.
Por otra parte, no se observaron cambios sustanciales en la tasa de filtración glomerular. Si bien los pacientes con manga gástrica mostraron una tendencia al incremento en la tasa de filtración glomerular, lo contrario sucedió en el grupo sometido a derivación gástrica, aunque sin llegar a cifras promedios inferiores a 60 ml por minuto por 1,73 m2. Como era de esperarse, los pacientes sometidos a la derivación gástrica tenían presiones más altas, eran más obesos y tenían mayor prevalencia de diabetes, lo que supone que funcionalmente estaban más comprometidos. Se ha encontrado que estos pacientes presentan hiperfiltración incluso antes de la cirugía (>140 ml por minuto) 26 y la disminución posquirúrgica puede implicar una mejoría de esta condición; por lo tanto, el seguimiento de esta cohorte permitirá evaluar el impacto de ambos procedimientos en la función renal en un mayor tiempo y con mayor cantidad de pacientes.
Se ha documentado que el estado de hiperfiltración inicial en obesos se produce por un desequilibrio proinflamatorio/antiinflamatorio dado por la mayor producción de leptina sobre las adipocinas, interleucina 6, proteína C reactiva y factor de crecimiento tisular B1. Este desequilibrio produce un daño cicatricial renal, semejante a la esclerosis por diabetes, con proliferación y disfunción mesangial, expresados clínicamente con hiperfiltración, proteinuria y microalbuminuria 27,28, a lo que contribuye la lipotoxicidad generada al riñón ante las grandes cantidades de triglicéridos y ácidos grasos libres no esterificados 29 y al incremento de la actividad del eje reninaangiotensina, con dilatación de la arteria aferente y contracción de la eferente 30. Aunque son necesarios estudios adicionales, se ha observado que después de la cirugía bariátrica en los obesos se revierte la condición de hiperfiltración, que es mayor si el obeso sometido a cirugía no tiene otras enfermedades concomitantes como diabetes o hipertensión 31,32.
Este es uno de los pocos estudios en que se evalúa el comportamiento de dos procedimientos bariátricos en el contexto del sistema de salud colombiano y que da cuenta de las molestias que, aunque son consideradas transitorias, pueden interferir en la observancia de los estilos de vida y en la calidad de vida de los pacientes en el seguimiento posoperatorio. Dada la alta frecuencia de dichas molestias, sobre todo las carenciales, en los futuros estudios se deben identificar alternativas preventivas que permitan mejorar las condiciones nutricionales del paciente antes del procedimiento o reforzar su manejo posterior.
Aunque este es uno de los estudios nacionales con mayor cantidad de pacientes, una de sus principales limitaciones es la menor proporción de individuos que habían concluido el primer año de seguimiento. En particular, no se analizó el comportamiento de los niveles de glucemia, debido a la pequeña cantidad de pacientes diabéticos sometidos a manga gástrica. Los ensayos clínicos futuros o una mayor ventana temporal de esta cohorte, podrían dar cuenta del mismo en nuestra población en el futuro.
Además, dado que no se calculó un tamaño de muestra para detectar diferencias en el control de los parámetros clínicos, no se hicieron análisis múltiples para identificar los factores asociados al logro del control de los mismos, por lo que los resultados tienen carácter exploratorio y la validez externa de sus resultados se limita a la ventana temporal posquirúrgica evaluada y a las características de la población estudiada. Por otra parte, no se evaluaron la observancia de los estilos de vida, el suplemento vitamínico, el estrato socioeconómico ni otros potenciales factores de confusión, como tampoco el impacto sobre el control de las glucemias, que podrán considerarse en futuros estudios.
En conclusión, nuestros resultados sustentan que los procedimientos bariátricos logran reducir en más del 50 % el peso corporal y, con ello, se obtiene reducción de la presión arterial diastólica y la sistólica que se inicia desde el primer mes posquirúrgico, llega a cifras de control a partir del tercer mes de seguimiento y coincide de manera directa con la pérdida de peso. La simplicidad técnica de la manga gástrica, el menor tiempo quirúrgico y la menor presencia de complicaciones con similares resultados en el control del peso y la presión arterial, sugieren que este procedimiento puede recomendarse como una opción terapéutica tan segura como la derivación gástrica en pacientes con obesidad mórbida en nuestro medio, lo cual podría ser evaluado en estudios clínicos de asignación aleatoria.
Agradecimientos
Al grupo de cirugía de la Clínica Amiga por el apoyo en la recolección de los datos, y a Margarita Velazco y el Grupo de Garantía de la Calidad, por el apoyo en el diseño de la base de datos.
Safety and effectiveness in weight control, blood pressure, and glomerular filtration following two bariatric procedures at a private clinic in Cali, Colombia
Abstract
Objective: a retrospective study was conducted on obese patients undergoing bariatric surgery in a health care institution in Cali, Colombia. The aim of this study was to describe two surgical procedures: sleeve and bypass, and the impacto weight loss, blood pressure, glomerular filtration rate and complications.
Results: the sleeve procedure showed shorter operating time and less postoperative complications (2.35% vs 9.79%) compared with bypass. The excess of weight loss was about 80% in all patients and it was similar between both procedures; this weight loss occurred mainly during the first 3 months after surgery. Control of diastolic blood pressure was achieved earlier than systolic, and sixth month after surgery a reduction of 8 mmHg and 10 mmHg, respectively was observed. The downward trend was statistically significant in the first and second control (coef. 1.9mmHg (IC95%: 2.8;1.1)) for systolic and also for diastolic (coef. 1.7mmHg (IC95%: 2.3;1.1)). Changes in the glomerular filtration rates were not statically significant.
Conclusions: Both bariatric procedures show successful reductions of the excess of weight and also an impact on blood pressure during the first year after surgery. The sleeve procedure, in our country, seems to be as safe as bypass. Further studies are needed to determine the impact on the glomerular filtration rate.
Key words: obesity, morbid; bariatric surgery; weight loss; hypertension; glomerular filtration rate.
Referencias
1. Mensah GA, Mokdad AH, Ford E, Narayan KM, Giles WH, Vinicor F, et al. Obesity, metabolic syndrome, and type 2 diabetes: Emerging epidemics and their cardiovascular implications. Cardiol Clin. 2004;22:485504.
2. World Health Organization. Observatory GH. Obesity: Situation and trends. Fecha de consulta: 20 de noviembre de 2012 Disponible en: https://www.who.int/gho/ncd/risk_factors/obesity_text.
3. Flegal KM, Carroll MD, Kit BK, Ogden CL. Prevalence of obesity and trends in the distribution of body mass index among US adults, 19992010. JAMA. 2012;307:4917.
4. Prentice AM. The emerging epidemic of obesity in developing countries. Int J Epidemiol. 2006;35:939.
5. Bautista LE, Casas JP, Herrera VM, Miranda JJ, Perel P, Pichardo R, et al. The Latin American Consortium of Studies in Obesity (LASO). Obes Rev. 2009;10:36470.
6. Instituto Colmbiano de Bienestar Familiar (ICBF), Instituto Nacional de Salud (INS), Ministerio de la Protección Social (MPS) y Asociación Probienestar de la Familia Colombiana (PROFAMILIA); 2010. Encuesta Nacional de Bogota; 2010. Fecha de consulta: 21 de noviembre de 2012. Disponible en: https://www.icbf.gov.co/portal/page/portal/PortalICBF/Norma tividadGestion/ENSIN1.
7. Wilson PW, D’Agostino RB, Sullivan L, Parise H, Kannel WB. Overweight and obesity as determinants of cardiovascular risk: The Framingham experience. Arch Intern Med. 2002;162:186772.
8. Jackson TD, Hutter MM. Morbidity and effectiveness of laparoscopic sleeve gastrectomy, adjustable gastric band, and gastric bypass for morbid obesity. Adv Surg. 2012;46:25568.
9. Helmiö M, Victorzon M, Ovaska J, Leivonen M, Juuti A, Jaser N, et al. SLEEVEPASS: A randomized prospective multicenter study comparing laparoscopic sleeve gastrectomy and gastric bypass in the treatment of morbid obesity. Preliminary results. Surg Endosc. 2012;26:25216.
10. Gastrointestinal surgery for severe obesity. NIH consensus development conference, March 257, 1991. Nutrition. 1996;12:397404.
11. Brolin RE. Update: NIH consensus conference. Gastrointestinal surgery for severe obesity. Nutrition. 1996;12:4034.
12. Shoker A, Hossain MA, KoruSengul T, Raju DL, Cockcroft D. Performance of creatinine clearance equations on the original CockcroftGault population. Clin Nephrol. 2006;66:8997.
13. Nevins M, Bright M. CockcroftGault formula for diagnosing moderate kidney failure. J Am Geriatr Soc. 2008;56:774.
14. Cai F, Ren L, Liu H, Fang Y, Jiang S, Xu X, et al. The relationship between the level of serum creatinine, modified diet and renal disease formula, CockcroftGault formula, and renal tubulointerstitial lesion. Ren Fail. 2012; 34:3347.
15. Angrisani L, Lorenzo M, Borrelli V. Laparoscopic adjustable gastric banding versus RouxenY gastric bypass: 5year results of a prospective randomized trial. Surg Obes Relat Dis. 2007;3:12733.
16. Howard L, Malone M, Michalek A, Carter J, Alger S, van Woert J. Gastric bypass and vertical banded gastroplasty –a prospective randomized comparison and 5year followup. Obes Surg. 1995;5:5560.
17. MacLean LD, Rhode BM, Forse RA, Nohr R. Surgery for obesity –An update of a randomized trial. Obes Surg. 1995;5:14550.
18. Himpens J, Dapri G, Cadière GB. A prospective randomized study between laparoscopic gastric banding and laparoscopic isolated sleeve gastrectomy: Results after 1 and 3 years. Obes Surg. 2006;16:14506.
19. Karamanakos SN, Vagenas K, Kalfarentzos F, Alexandrides TK. Weight loss, appetite suppression, and changes in fasting and postprandial ghrelin and peptideYY levels after RouxenY gastric bypass and sleeve gastrectomy: A prospective, double blind study. Ann Surg. 2008;247:4017.
20. Flum DR, Salem L, Elrod JA, Dellinger EP, Cheadle A, Chan L. Early mortality among Medicare beneficiaries undergoing bariatric surgical procedures. JAMA. 2005;294:19038.
21. Gagner M, Deitel M, Kalberer TL, Erickson AL, Crosby RD. The Second International Consensus Summit for Sleeve Gastrectomy, March 1921, 2009. Surg Obes Relat Dis. 2009;5:47685.
22. Podnos YD, Jiménez JC, Wilson SE, Stevens CM, Nguyen NT. Complications after laparoscopic gastric bypass: A review of 3464 cases. Arch Surg. 2003;138:95761.
23. Heneghan HM, MeronEldar S, Brethauer SA, Schauer PR, Young JB. Effect of bariatric surgery on cardiovascular risk profile. Am J Cardiol. 2011;108:1499507.
24. Sjöström CD, Lystig T, Lindroos AK. Impact of weight change, secular trends and ageing on cardiovascular risk factors: 10year experience from the SOS study. Int J Obes (Lond). 2011;35:141320.
25. Sjöström L, Peltonen M, Jacobson P, Sjöström CD, Karason K, Wedel H, et al. Bariatric surgery and longterm cardiovascular events. JAMA. 2012;307:5665.
26. Jerums G, Premaratne E, Panagiotopoulos S, MacIsaac RJ. The clinical significance of hyperfiltration in diabetes. Diabetologia. 2010;53:2093104.
27. Wisse BE. The inflammatory syndrome: The role of adipose tissue cytokines in metabolic disorders linked to obesity. J Am Soc Nephrol. 2004;15:2792800.
28. Esposito K, Giugliano G, Scuderi N, Giugliano D. Role of adipokines in the obesityinflammation relationship: The effect of fat removal. Plast Reconstr Surg. 2006;118:104859.
29. Abrass CK. Cellular lipid metabolism and the role of lipids in progressive renal disease. Am J Nephrol. 2004;24:4653.
30. Chagnac A, Weinstein T, Korzets A, Ramadan E, Hirsch J, Gafter U. Glomerular hemodynamics in severe obesity. Am J Physiol Renal Physiol. 2000;278:F81722.
31. Serra A, Granada ML, Romero R, Bayés B, Cantón A, Bonet J, et al. The effect of bariatric surgery on adipocytokines, renal parameters and other cardiovascular risk factors in severe and very severe obesity: 1year followup. Clin Nutr. 2006;25:4008.
32. Saliba J, Kasim NR, Tamboli RA, Isbell JM, Marks P, Feurer ID, et al. RouxenY gastric bypass reverses renal glomerular but not tubular abnormalities in excessively obese diabetics. Surgery. 2010;147:2827.
Correspondencia: Henry Francisco Baptiste, MD
Correo electrónico: baptistuta2912@gmail.com
Cali, Colombia
