Generalmente, para el estudio del reflujo se utilizan 300 ml de jugo de naranja marcado con radioisótopos. Se pueden utilizar maniobras para facilitar el reflujo. Su sensibilidad es de 15 a 59 % y su especificidad de 83 a 100 % 19. Su principal limitación está en que no permite determinar la causa. Podría utilizarse como prueba de tamización en situaciones en las que se sabe que la endoscopia de las vías digestivas altas es de poca utilidad diagnóstica, por ejemplo, cuando hay manifestaciones extraesofágicas. Lamentablemente, este examen no está entre las herramientas diagnósticas del Plan Obligatorio de Salud.
Con el análisis retrospectivo de los hallazgos endoscópicos y su correlación clínica, se puede lograr exactitud en el diagnóstico del paciente con enfermedad erosiva por reflujo grastroesofágico, tanto proximal como distal, pero aquéllos sin estas características y que sufren de reflujo gastroesofágico quedan sin tratamiento.
Otros exámenes necesarios para hacer el diagnóstico y tomar una decisión quirúrgica, pueden ser la manometría esofágica, la cinerradiología de vías digestivas altas, la gammagrafía esofágica y otras pruebas que evalúen el vaciamiento gástrico 20.
En este punto no hay consenso sobre cuáles son los exámenes necesarios y suficientes para tomar de manera segura la decisión de intervenir quirúrgicamente a un paciente y es en lo cual se ha centrado el análisis 21.
Por estas dificultades, se decidió analizar diferentes trabajos para lograr un orden en la toma de decisiones respecto a las pruebas diagnósticas y poder detectar los pacientes en los que la cirugía brinda un buen resultado.
Dicho análisis nos llevó a hacer énfasis en cinco preguntas esenciales en el estudio de los casos de reflujo gastroesofágico:
1. El esófago causante del problema de reflujo, ¿es por un trastorno de la motilidad o por incompetencia del tono del esfínter esofágico inferior?
2. ¿Hay un trastorno de la motilidad gástrica que dificulte la evacuación del contenido gástrico al resto del tubo digestivo?
3. ¿Es la causa del reflujo una combinación de los dos factores anteriores?
4. ¿Cuál es la técnica quirúrgica adecuada para el paciente?
5. ¿Existen otros factores que ocasionen los síntomas?
Para dilucidar estos interrogantes, se analizaron varios trabajos que ilustran la complejidad de la motilidad del tubo digestivo y, lamentablemente, no se obtuvo una solución única y sencilla para tomar la decisión.
Para entender el aspecto de la motilidad esofágica, hemos seleccionado el artículo de Ozin, et al., publicado en el World Journal of Gastroenterology 22. En un grupo de 550 pacientes con síntomas de enfermedad por reflujo gastroesofágico, se encontró que 43,8 % presentaba reflujo gastroesofágico proximal y distal, 17,6 % presentaba sólo reflujo distal y 12,7 % presentaba sólo reflujo proximal; además, 7,6 % presentaba esófago hipersensible (acidimetría negativa con índices sintomáticos positivos para reflujo ácido o no ácido) y en 18,2 % (n=100) la endoscopia fue normal y no presentaba síntomas.
A todos los pacientes se les practicó acidimetría de 24 horas y manometría para evaluar los resultados y compararlos con los hallazgos endoscópicos, y determinar si los síntomas se correlacionan con dichos resultados.
En este artículo se demuestra que de 20 a 50% de los pacientes con enfermedad por reflujo gastroesofágico presenta motilidad esofágica inefectiva, caracterizada por contracciones del cuerpo esofágico de amplitud menor de 30 mm de Hg, o un porcentaje mayor de 30 % de falta de transmisión de las ondas peristálticas con el inicio de la deglución de saliva.
La motilidad esofágica inefectiva tiene mayor prevalencia en los pacientes con reflujo proximal aislado y reflujo asociado a síntomas respiratorios.
No hubo diferencias en la amplitud de las contracciones del cuerpo esofágico entre los pacientes con reflujo distal aislado y los sanos, pero sí en la presión del esfínter esofágico inferior, la cual fue más baja en el primer grupo.
La enfermedad erosiva por reflujo, es decir, aquella en la que se encuentra algún grado de esofagitis, sí predispone a trastornos de la motilidad esofágica y genera desde disminución de la amplitud de las contracciones del cuerpo esofágico hasta ausencia de movimientos peristálticos, en 20 % de pacientes con esofagitis de grado B y en 50 % de aquellos con esofagitis de grado C y D.
Frazzoni, et al. 23, analizaron los efectos de diferentes grados de esofagitis sobre la motilidad y, en forma similar, encontraron que el promedio de la amplitud de las contracciones del cuerpo esofágico es menor en los casos de esofagitis complicada y enfermedad erosiva por reflujo, que en aquellos sin enfermedad no erosiva por reflujo. Además, no encontraron mayores diferencias en los diferentes grupos respecto a la tonicidad del esfínter esofágico inferior.
Lemme, et al. 24, estudiaron 110 pacientes con enfermedad por reflujo gastroesofágico, 70 con la forma erosiva y 40 con la no erosiva, y no encontraron diferencias en el número de contracciones de baja amplitud en el cuerpo esofágico. Concluyeron que la inefectividad de la motilidad esofágica por sí sola no es un prerrequisito para desarrollar esofagitis.
Otro grupo encabezado por Martinek (2008) 25, evaluó 110 pacientes con enfermedad no erosiva por reflujo, 77 moderada y 33 grave, y 99 pacientes sanos. La acidimetría y la manometría esofágicas no mostraron diferencias significativas en la presión del esfínter esofágico inferior y la presencia de inefectividad de la motilidad del esófago, entre los grupos de enfermedad erosiva y no erosiva 25,26.
Todos estos autores concluyeron que deben existir otros factores asociados, como genéticos, de defensa de la mucosa y de depuración del ácido, que influyen en la sensibilidad para desarrollar enfermedad erosiva por reflujo gastroesofágico. Estos resultados ponen de manifiesto que los trastornos de la motilidad esofágica pueden no ser la causa del reflujo, sino sólo una consecuencia del mismo.
Se analizó también el estudio de Anish, et al. 27, quienes presentaron una casuística de 46 casos de cirugía antirreflujo de tipo Nissen por laparoscopia. Operaron los pacientes sin manometría ni calibración esofágica y encontraron sólo un caso de afagia que necesitó una fundiplicatura parcial de tipo Toupet, dos días después de la operación inicial de Nissen. Se trató de un grupo de 44 pacientes, 29 con hernia hiatal entre 3 y 5 cm de tamaño, 4 con estenosis péptica y dilataciones previas, 9 con hernia hiatal complicada con hernia paraesofágica o con hernia hiatal gigante, y 2 con esófago de Barrett.
En todos los casos se practicó endoscopia de vías digestivas altas y, sólo en uno acidimetría, por tener síntomas de reflujo gastroesofágico, aunque su endoscopia fue normal. Estos autores concluyeron que, aun en pacientes con hernia hiatal –que la mayoría presentaba–, no se necesita practicar previamente la manometría de rutina para decidir qué tipo de procedimiento utilizar 27.
Lamentablemente, no aclararon las causas de la nueva intervención del paciente que requirió una cirugía de 270 grados: si experimentaba un problema motor primario antes de la cirugía o si la causa de su importante disfagia fue la técnica quirúrgica utilizada.
Haack, et al. 28, también evaluaron el papel de la motricidad esofágica en la producción del reflujo. Estudiaron 100 pacientes con motilidad esofágica inefectiva y 100 pacientes control y concluyeron que no existían diferencias significativas entre edad, sexo, prevalencia de dolor torácico y exposición al ácido, y los síntomas de reflujo gastroesofágico, al comparar entre sí los pacientes con motilidad esofágica inefectiva o al comparar estos pacientes con controles normales. Coinciden con los autores mencionados previamente, en que deben existir otros factores adicionales para la aparición de esofagitis y que la alteración de la motilidad por sí sola no es una causa principal.
Se puede concluir que la manometría es un elemento importante para aclarar los trastornos de la motilidad esofágica y evaluar el gradiente de presión del esfínter esofágico inferior, pero no debe practicarse de rutina en todo paciente que vaya a ser sometido a una cirugía antirreflujo, a menos que presente alguna enfermedad del colágeno o autoinmunitaria que produzca problemas serios de la motilidad esofágica, como el síndrome de Sjögren, lupus eritematoso sistémico o esclerodermia, o un trastorno del metabolismo de la glándula tiroides, sea hipotiroidismo o hipertiroidismo. También, debe practicarse en quienes refieran disfagia importante durante la anamnesis y si se sospecha un trastorno primario de la motilidad esofágica que amerite descartar acalasia o espasmo esofágico difuso.
El hecho de detectar un trastorno de la motilidad no obliga a cambiar la decisión de practicar una fundiplicatura completa en lugar de una incompleta, ante la sospecha de que el trastorno motor esofágico pueda ser secundario al reflujo y no su causa. Se excluyen de este concepto los trastornos motores primarios, como la acalasia, cuyo tratamiento es la fundiplicatura parcial.
Ahora consideremos el vaciamiento gástrico y la dispepsia funcional, para evaluar estos componentes dentro del problema del reflujo gastroesofágico 29,30,31. Cuando el alimento entra en el estómago, se genera un reflejo vasovagal mediado por el óxido nítrico y el péptido intestinal vasoactivo (Vasoactive Intestinal Peptide, VIP), con el fin de permitir el ingreso del alimento sin que se incremente la presión intragástrica. A medida que se distiende la pared gástrica, principalmente en la zona distal del estómago, se comienzan a generar fenómenos fisiológicos que involucran la sensación de saciedad.
En condiciones normales, el estómago entrega al intestino proximal una cantidad aproximada de 200 kcal por hora y se generan contracciones lentas, que se tornan más fuertes con el cierre sincrónico del píloro, para mezclar y triturar el alimento y convertirlo en quimo 32.
Inicialmente, durante el vaciamiento temprano de líquidos, el píloro presenta una apertura parcial que permite el paso de partículas con un tamaño de 2 a 3 mm. Por este efecto físico, la cantidad de contenido gástrico que pasa por el píloro depende del volumen ingerido, la solubilidad, la cantidad de líquido ingerido, la cantidad de ácido secretada, y el grado de mezcla y trituración alcanzado. El tiempo máximo de vaciamiento o de actividad “posprandial” es de 120 minutos.
La fase III del complejo motor migratorio, que tiene una duración de unos 10 minutos y cuya función principal es la de evacuar todo el contenido gástrico que ha quedado residual manteniendo relajado permanentemente el píloro para esta función, permanece a pesar de la sección de los nervios vagos y del plexo visceral.
También, existen mecanismos fisiológicos que inhiben el vaciamiento gástrico; por ejemplo, el incremento desmedido del paso al duodeno de contenido gástrico que no puede ser digerido adecuadamente, genera un impulso nervioso entérico que inhibe el vaciamiento.
Los factores más importantes que producen los reflejos que inhiben el vaciamiento gástrico, son:
• el grado de distensión duodenal;
• la irritación de algún grado de la mucosa duodenal;
• el grado de acidez y la osmolaridad del quimo;
• la presencia de subproductos de la digestión de proteínas y grasas, y
• la colecistocinina, la secretina y el péptido inhibidor gástrico.
En la fisiopatología de este proceso se conoce el término de “gastroparesia”, que consiste en el trastorno de la evacuación gástrica sin que exista un mecanismo obstructivo. Sus síntomas son plenitud “posprandial”, llenura precoz, náuseas y vómito; se producen por la dificultad para el vaciamiento gástrico de sólidos, por problemas neuropáticos, producidos por la vagotomía,o miopáticos, debidos a diabetes o esclerodermia. Enla población normal se encuentra una prevalencia de 4 % 33, que se incrementa hasta 30 a 50 % en pacientes diabéticos.
La gastroparesia es idiopática en 36 % de los casos. Otras causas de gastroparesia son: diabetes mellitus (29 %); intervenciones quirúrgicas, como vagotomía, cirugía bariátrica o cirugía antirreflujo por disfunción motora gástrica (13 %); enfermedad de Parkinson (7,5 %); enfermedades del colágeno; enfermedades metabólicas, como hipertiroidismo, paratiroidismo e insuficiencia suprarrenal; bulimia nerviosa y anorexia; manifestaciones paraneoplásicas por cáncer de esófago, estómago, mama, pulmón o páncreas (raros); pancreatitis crónica; estreñimiento primario (19 %).
Hay controversia sobre si Helicobacter pylori la puede causar 34, al igual que otras infecciones virales.
Hay reportes de asociación de la gastroparesia con reflujo gastroesofágico, hasta en 10 a 40 % de los casos.
El diagnóstico objetivo de la gastroparesia se hace con la gammagrafía, con comida sólida marcada con un radioisótopo como el tecnecio 99. Se considera positiva para gastroparesia cuando hay retención de 60 % del medio a las 2 horas o de 10 % a las 4 horas después de la ingestión.
En los pacientes con enfermedad por reflujo gastroesofágico y otras condiciones que pueden retardar el vaciamiento gástrico, se debe practicar esta prueba para evaluar este último. La cirugía antirreflujo puede no tener el éxito esperado si hay retardo del vaciamiento del estómago, el cual agrava el reflujo gastroesofágico. Cuando se comprueba, se debe adicionar el tratamiento farmacológico al quirúrgico o, si hay erosión por reflujo, agregar algún procedimiento quirúrgico que facilite el vaciamiento gástrico, como una piloroplastia.
Es necesario resolver algunas inquietudes sobre la necesidad de la acidimetría esofágica en los pacientes aquejados por reflujo gastroesofágico. Actualmente, la acidimetría es la prueba estándar para dilucidar si una persona tiene reflujo ácido o alcalino, y si éste es el causante de los síntomas de la enfermedad y de los hallazgos endoscópicos 35,36.
Sin embargo, últimamente se ha hecho énfasis en este examen para aquellos pacientes con enfermedad no erosiva por reflujo gastroesofágico o con hallazgos endoscópicos normales en la unión gastroesofágica 37. Muchos equipos de trabajo han tratado de optimizar los resultados de la acidimetría 38-43 y de correlacionarlos con los síntomas del reflujo, colocando los sensores convencionales a diferentes alturas del esfínter esofágico inferior o fijando cápsulas en la mucosa esofágica para monitorización inalámbrica. No obstante, no se ha logrado una correlación exacta ni establecer cuál es la altura ideal para evaluar los episodios de reflujo ácido y biliar, aunque se estima que el sensor para el pH ácido debe estar a cinco cm de la unión cardioesofágica. Además, la sensibilidad de esta prueba en la enfermedad no erosiva no es tan buena como en la erosiva 44,45.
Por estas razones, la recomendación final es tomar esta prueba con sonda multicanal y, cuando el modelo del aparato permita hacerlo, fijarla a un centímetro de distancia de la unión gastroesofágica.
Estas variables se analizaron en la Facultad de Medicina y se pusieron a consideración del grupo de cirujanos generales y gastrointestinales que practican los procedimientos antirreflujo.
Se buscó establecer un algoritmo lógico que no provocara una solicitud excesiva e innecesaria de exámenes y, a su vez, evitara al máximo no detectar pacientes que realmente los requieran. Los objetivos eran no practicar cirugías antirreflujo en pacientes que no las requieran y, además, establecer el tipo de fundiplicatura apropiada, teniendo en cuenta que la técnica de 360 grados es la más efectiva 3 cuando no hay un trastorno motor primario del esófago o cuando se trata de un paciente pediátrico.
En un estudio de Cuschieri, se compararon los resultados en 266 pacientes sometidos a fundiplicatura de tipo Nissen o fundiplicatura parcial de tipo Toupet, por por dos cirujanos expertos en laparoscopia, con seguimiento a seis años. Lo interesante de este estudio es que la escogencia del procedimiento se hizo según el gusto del cirujano en cada grupo, es decir, en un grupo se usó la fundiplicatura de 360 grados y, en el otro, la de 270 grados, sin tener en cuenta los síntomas del paciente. La disfagia posoperatoria fue similar en ambos grupos, a pesar de que casi la mitad de los pacientes presentaban síntomas de disfagia antes de la cirugía, con presiones del esfínter esofágico inferior que variaban entre 12 y 15 mm de Hg. La conclusión fue que la mejoría de los síntomas es mayor con la fundiplicatura completa que con la parcial, sin diferencias en la disfagia posoperatoria, aunque la fundiplicatura completa produjo más dificultad para eructar y para vomitar 46.
Considerando lo anterior y teniendo en cuenta al paciente con la sintomatología propia del reflujo gastroesofágico, resulta lógico iniciar el plan diagnóstico con la endoscopia de vías digestivas altas, por su gran sensibilidad para detectar la esofagitis, para descartar algún proceso de origen neoplásico, por su fácil realización y por estar dentro del Plan Obligatorio de Salud. En estos pacientes con clara sintomatología de reflujo, no consideramos necesaria la acidimetría.
Aproximadamente, 40 % de los pacientes con reflujo gastroesofágico no presentan erosión mucosa y, por ende, requieren la acidimetría, como se estableció en el algoritmo, la cual puede ser o no con impedancia para evaluar reflujo duodeno-pancreático.
En la evaluación de la motilidad esofágica y gástrica, se deben tener en cuenta los síntomas que refiere el paciente y los antecedentes de enfermedades asociadas, para luego practicar pruebas que permitan un adecuado tratamiento farmacológico, quirúrgico o ambos, de las alteraciones encontradas.
Por ello, en pacientes con diabetes y disfagia es prudente incluir la manometría esofágica y la gammagrafía, para estudiar la evacuación gástrica de sólidos y líquidos. Con la información obtenida se puede establecer acertadamente cual paciente debe someterse a cirugía.
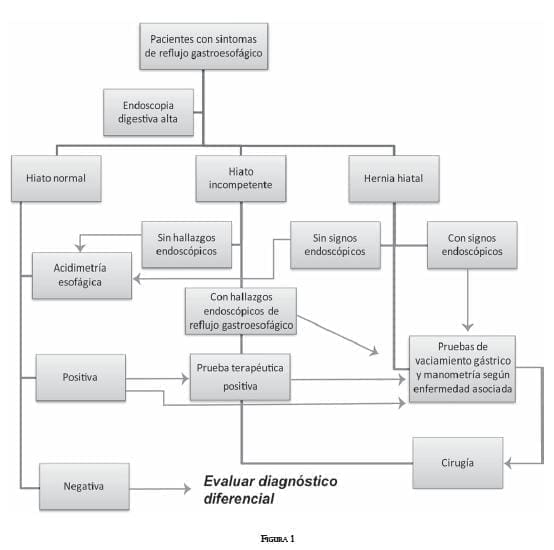
A continuación se presenta el algoritmo que resultó del ejercicio anteriormente expuesto y analizado (figura 1). Finalmente, se presenta el formato para introducir los datos del paciente con reflujo gastroesofágico y anexarlo a la historia clínica (figura 2).

Management of Gastroesophageal Reflux at Universidad Nacional de Colombia, Bogotá
Abstract
In our environment gastroesophageal reflux disease remains a problem that is managed medically, while surgical intervention is not fostered, especially by gastroenterologists. Patients are generally offered medical treatment, and the entity becomes chronic, while one could avoid the permanent prescription of medications with surgical intervention. This review is intended to indicate the manner for an early detection of patients with gastroesophageal reflux that can be benefitted from surgical correction.
Key words: gastroesophageal Reflux; esophagitis; esophageal pH monitoring; fundoplication; laparoscopy
Bibliografía
1. Molano J, Piñeros S, López C. Dispepsia y reflujo gastroesofágico en adolescentes escolarizados. Revista Colombiana de Gastroenterología. 2008;23:46-56.
2. Karhilas PJ, Hogan W. Gastroesophageal reflux disease. In: Sleisenger M, Fordtran J, editors. Gastrointestinal disease: Pathophysiology, diagnosis and management. Philadelphia: Saunders Company; 1993. p. 378-401.
3. Arango L, Ángel A. Reflujo gastroesofágico: conceptos actuales, evaluación y presentación de 50 enfermos intervenidos laparoscópicamente con seguimiento a 6 meses. Rev Colomb Cir. 1997;12:251-63.
4. Flook N, Jones R, Vakil N. Approach to gastroesophageal reflux disease in primary care. Can Fam Physician. 2008;54:701-5.
5. Flook N, Unge P, Agreus L, Karlson BW, Nilson G. Approach to managing undiagnosed chest pain. Could GERD be the caused?Can Fam Physycian. 2007;53:261-6.
6. Richter JE, Bradley LA, Castell DO. Esophageal chest pain: Current controversies in pathogenesis, diagnosis and therapy. Ann Intern Med. 1989;110:66-8.
7. Harding SM, Richter JE, Guzzo MR, Schan CA, Alexander RW, Bradley LA, et al. Asthma and gastroesophageal reflux: Acid suppression therapy improves asthma outcome. Am J Med. 1996;100:395-405.
8. De Caesteker J. ABC of the upper gastrointestinal tract. Oesophagus:Heartburn. BMJ. 2001;323:736-9.
9. American Society for Gastrointestinal Endoscopy (ASGE). The role of endoscopy in the management of GERD. Guidelines for clinical application. Gastrointest Endosc. 1999;49:834-5.
10. Talwar V, De Caesteker J. Hiatus hernia and gastro-oesophageal reflux disease. Medicine. 2007;35:194-8.
11. Fass R, Fennerty B, Vakil N. Nonerosive reflux disease –current conceps and dilemas. Am J Gastroenterol. 2001;96:303-14.
12. Patti MG. Advances in diagnostic testing for gastroesophageal reflux disease. World J Gastroenterol. 2010;16:3750-6.
13. Fiocca R, Mastracci L, Ridell R, Takubo K, Vieth M, Yerian L, et al. Development of consensus guidelines for the histologic recognition of microscopic esophagitis in patients with gastroesophageal reflux disesase: The Esohisto Project. . HumanPathology. 2010;41:223-31.
14. Hirano I, Richter JE, Practice Parameters Committee of the American College of Gastroenterology. ACG practice guidelines: Esophageal reflux disease. Am J Gastroenterol. 2007;102:668-85.
15. Katz PO. Review article: Intragastric and oesophageal pH monitoringin patients with gastro-esophageal reflux disease. AlimentPharmacol Ther. 2006;23(Suppl.1):3-11.
16. DeVault KR, Caastell DO. Update guidelines for the diagnosis and treatment of gastroesophaegeal reflux disease. Am J Gastroenterol. 2005;100:190-200.
17. Tutuian R, Castell DO. Review article: Complete gastrooesophage al reflux monitoring –combined pH and impedance.Aliment Pharmacol Ther. 2006;24(Suppl.2):27-37.
18. Sifrim D, Castell D, Dent J, Kharilas PJ. Gastro-oesophageal reflux monitoring: Review and consensus report on detection and definitions of acid, non-acid, and gas reflux. Gut. 2004;53:1024-31.
19. Galli J, Volante M, Parrilla C, Rigante M, Valenza V. Oropharyngoesophageal scintigraphy in the diagnostic algorithm of laryngopharyngeal reflux disease: A useful exam? J Otolaryngol Head Neck Surg. 2005;132:717-21.
20. Richter JE. Diagnostic test for gastroesophageal reflux disease. Am J Med Sci. 2003;326:300-8.
21. Hani A. Pruebas diagnósticas en enfermedad por reflujo gastroesofágico (ERGE). Revista Colombiana de Gastroenterología. 2009;24210-22.
22. Ozin Y, Dagli U, Kuran S, Sahin B. Manometric findings in patients with isolated distal gastroesophageal reflux. World J Gastroenterol. 2009;15:5461-4.
23. Frazzoni M, De Micheli E, Savarino V. Different patterns of oesophageal acid exposure distinguish complicated reflux disease from either erosive reflux oesophagitis or non-erosive refluxdisease. Aliment Pharmacol Ther. 2003;18:1091-8.
24. Lemme EM, Abrahao-Junior LJ, Manhaes Y, Shechter R, Carvalho BB, Alvariz A. Ineffective esophageal motility in gastroesophageal erosive reflux disease and in nonerosive reflux disease: Are they different? J Clin Gastroenterol. 2005;39:224-7.
25. Martinek J, Benes M, Hucl T, Drastich P, Stirand P, Spicak J. Non-erosive and erosive gastroesophageal reflux diseases: No difference with regard to reflux pattern and motility abnormalities. Scand J Gastroenterol. 2008;43:794-800.
26. Ho SC, Chang CS, Wu CY, Chen GH. Ineffective esophageal motility is a primary motility disorder in gastroesophageal refluxdisease. Dig Dis Sci. 2002;47:652-6.
27. Nagpal AP, Soni H, Haribhakti S. Is oesophageal manometry a must before laparoscopic fundoplication? Analysis of 46 consecutive patients treated without preoperative manometry. J Minim Access Surg. 2010;6:66-9.
28. Haack HG, Hansen RD, Malcolm A, Kellow JE. Ineffective oesophageal motility: Manometric subsets exhibit differentsymptom profiles. World J Gastroenterol. 2008;14:3719-24.
29. Patiño JF. Reflujo gastroesofágico. En: Patiño JF. Lecciones de cirugía, Primera edición, Bogotá; Editorial Médica Panamericana; 2000. p. 421-32.
30. Camilleri M, Thompson DG, Malagelada JR. Functional dys pepsia. Symptoms and underlying mechanism. J Clin Gastroenterol. 1986;8:424-9.
31. Greydanus MP, Vassallo M, Camilleri M, Nelson DK, Hanson RB, Thomforde GM. Neurohormonal factors in functional dyspepsia: Insights on pathophysiological mechanisms. Gastroenterology. 1991;100:1311-8.
32. Rodríguez A, Zuleta J. De la fisiología del vaciamiento gástrico al entendimiento de la gastroparesia. Rev Col Gastroenterol. 2010;25:219-25.
33. Abell TL, Bernstein RK, Cutts T, Farrugia G, Forster J, HaslerWL, et al. Treatment of gastroparesis: A multidisciplinaryclinical review. Neurogastroenterol Motil. 2006;18:263-83.
34. Koskenpato J, Korppi-Tommola T, Kareima K, Farkkila M. Long term follow up study of gastric emptying and Helicobacter pylori eradication among patients with functional dyspepsia. Dig Dis Sci. 2000;45:1763-8.
35. DeVault KR, Castell DO. Guidelines for the diagnosis and treatment of gastroesophagal reflux disease. Arch Intern Med. 1995;155:2165-73.
36. Kahrilas PJ, Quigley EMM. Clinical esophageal pH recording: A technical review for practice guideline development. Gastroenterology. 1996;110:1982-96.
37. Bansal A, Wani S, Rastogi A. Impact of measurement of esophageal acid exposure close to the gastroesophageal junction on diagnostic accuracy and event-symptom correlation: A prospective study using wireless dual pH monitoring. Am J Gastroenterol.2009;104:2918-25.
38. Shay S, Tutuian R, Sifrim D, Vela M, Wise J, Blaji N, et al. Twenty-four hours ambulatory simultaneous impedance andpH monitoring: A multicenter report of normal values from 60 healthy volunteers. Am J Gastroenterol. 2004;99:1037-43.
39. Sifrim D, Castell D, Dent J, Kahrilas PJ. Gastro-oesophageal reflux monitoring: Review and consensus report on detection and definitions of acid, nonacid, and gas reflux. Gut. 2004;53:1024-31.
40. Pandolfino JE, Richter JE, Ours T, Guardino JM, Chapman J, Kahrilas PJ. Ambulatory esophageal pH monitoring using a wireless system . Am J Gastroenterol. 2003;98:740-9.
41. Mekapati J, Knight LC , Maurer AH, Fisher RS, Parkman HP. Trans-sphincteric pH profile at the gastroesophageal junction. Clin Gastroenterol Hepatol. 2008;6:630-4.
42. Pandolfino JE, Zhang Q , Ghosh SK, Post J, Kwiatek M, Kahrilas PJ. Acidity surrounding the squamocolumnar junction in GERD patients: ‘Acid pocket’ versus ‘acid film’. Am J Gastroenterol. 2007;102:2633-41.
43. Wenner J, Hall M , Hoglund P, Johansson J, Johnsson F, Oberg S. Wireless pH recording immediately above the squamocolumnar junction improves the diagnostic performance of esophageal pH studies. Am J Gastroenterol. 2008;103:2977-85.
44. Bredenoord AJ, Weusten BL, Timmer R, Conchillo JM, Smout AJ. Addition of esophageal impedance monitoring to pH monitoring increases the yield of symptom association analysis inpatients off PPI therapy. Am J Gastroenterol. 2006;101:453-9.
45. Wenner J, Johnsson F, Johansson J, Oberg S. Acid reflux immediately above the squamocolumnar junction and in the distal esophagus: Simultaneous pH monitoring using the wireless capsule pH system. Am J Gastroenterol. 2006;101:1734-41.
46. Sgromo B, Irvine LA, Cuschieri A. Long-term comparative outcome between laparoscopic total Nissen and Toupet fundoplication: Symptomatic relief, patient satisfaction and quality of life. Surg Endosc. 2008;22:1048-53.
