Recomendaciones
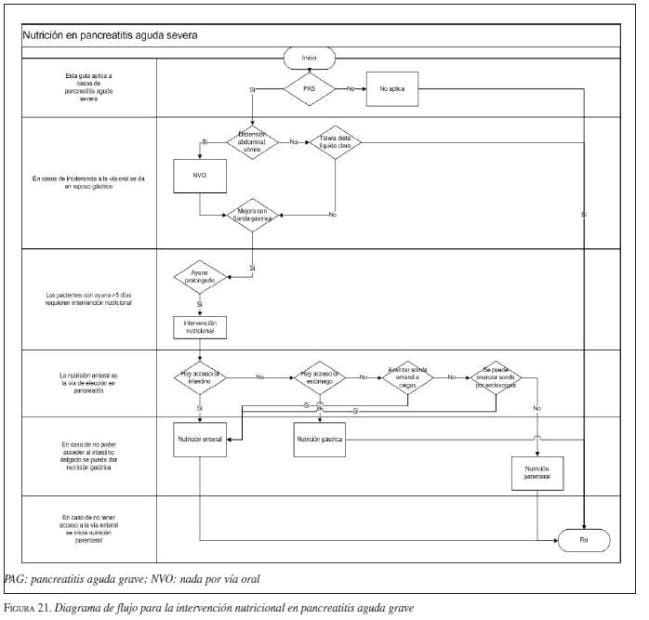
1. Soporte nutricional. Los pacientes con pancreatitis aguda grave deben recibir soporte nutricional cuando se anticipa una ingestión inadecuada por vía oral por 5-7 días. En los casos de desnutrición previa y enpancreatitis necrosante el beneficio es mayor (evidencia Ia, Ib y IIa, recomendación A).
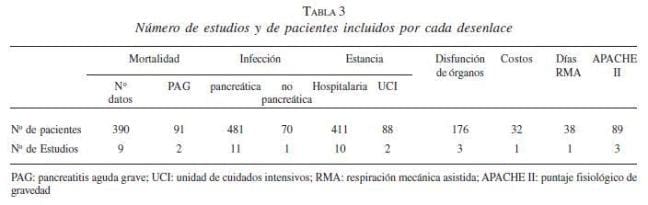
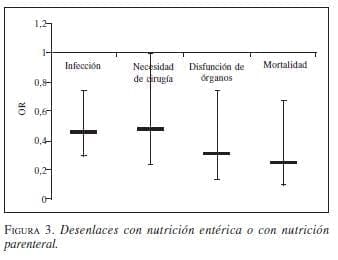
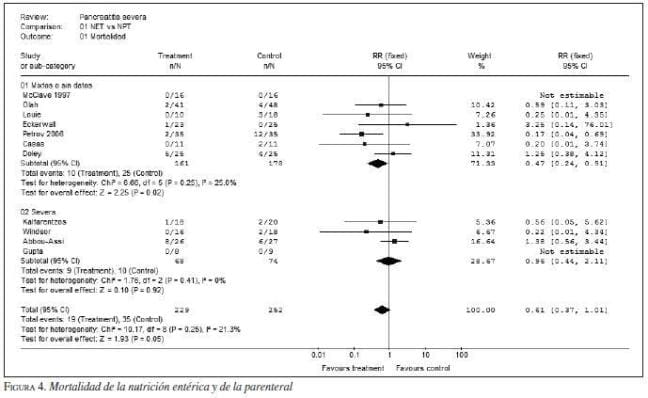
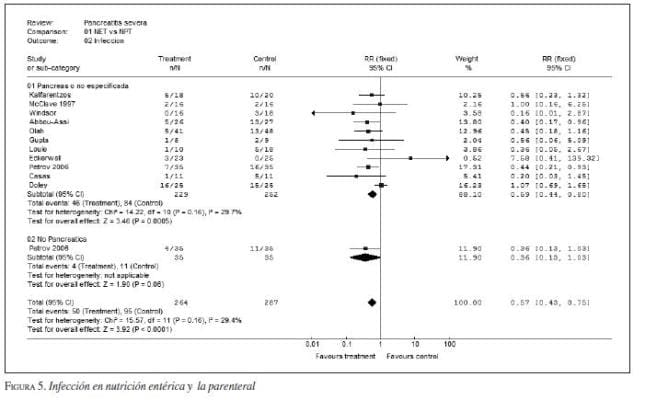
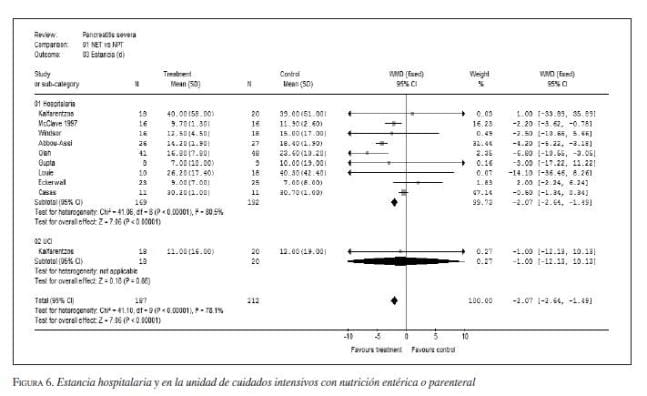
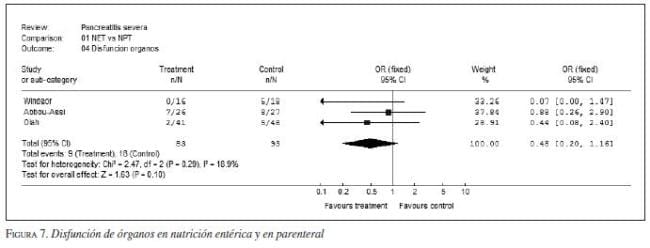
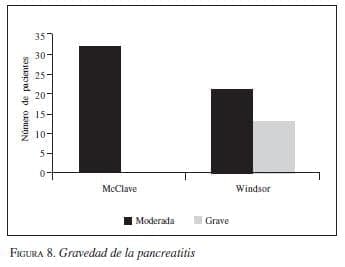
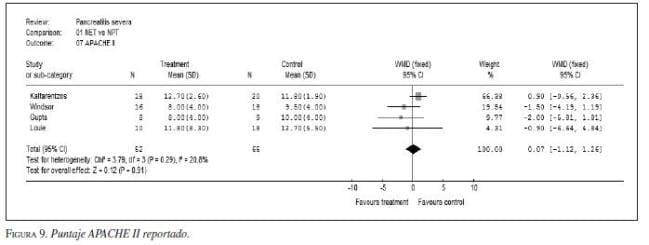
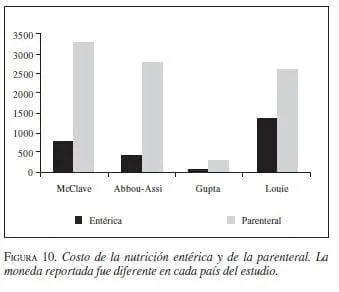
2. Vía de la nutrición. Tres metanálisis demuestran que la nutrición entérica disminuye la morbilidad, la estancia hospitalaria (3,94 días; IC95 2,02-5,86; p<0,0001) y la mortalidad en pacientes con pancreatitis grave (figura 3, figura 4*, figura 5, figura 6, figura 7). La vía entérica es de elección en el soporte nutricional en pancreatitis aguda grave (evidencia Ia y IIa, recomendación A) (43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59), aunque algunos de los estudios tuvieron sesgos de selección al no definir apropiadamente la población de estudio por gravedad (figura 8 y figura 9). Además, la nutrición entérica tiene en promedio cinco veces menor costo que la nutrición parenteral (figura 10).
La nutrición parenteral está indicada en caso de haber limitaciones para el uso de la vía entérica, como en las siguientes situaciones:
• obstrucción intestinal,
• intolerancia a la nutrición entérica,
• fístula entérica, o
• cuando el aporte por vía entérica no sea suficiente (mixta).
3. Tiempo de inicio. Hay una tendencia a disminuir la mortalidad cuando la nutrición entérica se inicia tempranamente (RR=0,26; IC95 0,06 – 1,09; p=0,06). Se recomienda iniciar tempranamente la nutrición una vez se haya logrado la reanimación del choque (evidencia Ib y IIa, recomendación A) (60,61,62,63).
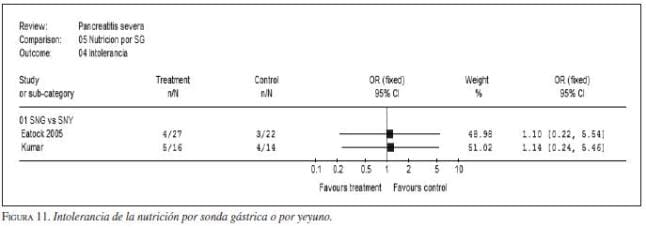
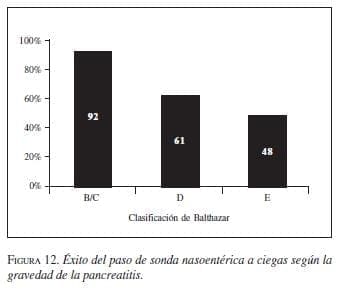
. Sonda avanzada. La nutrición con sonda gástrica no está contraindicada si el paciente la tolera (figura 11, figura 12) (evidencia IIa, recomendación A) (64,65,66). La sonda nasoentérica se puede pasar a ciegas y permitir su avance asistido con metoclopramida en la mayoría de los casos (evidencia IIa, secomendación A) (67,68).
 Las siguientes medidas podrían mejorar la tolerancia de la nutrición entérica:
Las siguientes medidas podrían mejorar la tolerancia de la nutrición entérica:
A. Minimizar el íleo con el inicio de la nutrición entérica temprana (evidencia IIa y IIb, recomendación A).
B. Cuando la sonda no avanza con las medidas anteriores, se debe avanzarla con endoscopia para infusión distal (evidencia IV, recomendación C)
C. Uso de aminoácidos esenciales en lugar de dieta entera (evidencia IV, recomendación C).
D. Dieta con triglicéridos de cadena ramificada (evidencia IV, recomendación C).
E. Infusión continua (evidencia IV, recomendación C).
5. Se recomiendan los siguientes aportes de calorías y macronutrientes:
A. Calorías:
i. 15-20 kcal/kg al día (evidencia III, recomendación B), (15,69,70). Estos aportes hipocalóricos son mejor tolerados (71,72).
ii. Los aportes calóricos mayores de 25 o 30 kcal/ kg al día (hipercalóricos) podrían aumentar la mortalidad y no se recomiendan (evidencia III, recomendación B) (12).
B. Proteínas:
i. Se recomienda una ingestión diaria, por lo menos de, 1,3-1,5 g/kg (evidencia IIa, recomendación A).
ii. Se recomienda el uso de dieta oligomérica al usar la vía entérica (evidencia IV, recomendación C).
iii. Se recomienda que el suministro incluya, al menos, 0,2-0,4 g/kg de glutamina (evidencia IIa y IIb, recomendación A).
iv. Cuando se administra nutrición entérica se debe considerar la administración de glutamina parenteral suplementaria <0,3 g/kg en dipéptido Ala-Gln (evidencia IIa, recomendación A).
v. Control bisemanal del balance nitrogenado con muestra de orina (evidencia III, recomendación B). No se recomienda la valoración nutricional con albúmina en los pacientes críticos.
C. Carbohidratos:
i. Se recomiendan 3 a 6 g/kg al día (evidencia IV, recomendación C).
ii. Se prefiere como la principal fuente de energía por su bajo costo y con el fin de disminuir la gluconeogénesis (evidencia IV, recomendación C).
iii. Evitar la hipoglucemia/hiperglucemia (evidencia IV, recomendación C).
iv. Se sugiere el control continuo de la glucometría para evitar grandes fluctuaciones (evidencia IV, recomendación C).
v. La meta es mantener glucemias menores de 10 mmol/L (180 mg/dL), (evidencia IV, recomendación C) (73,74).
vi. En caso de hiperglucemia, se debe corregir coninsulina exógena (evidencia IV, recomendación C).
D. Grasas:
i. Se recomienda 0,8 a 1,5 g/kg de lípidos (evidencia IV, recomendación C).
ii. En casos de requerir nutrición parenteral, la restricción de los lípidos no está indicada si el nivel de triglicéridos es normal (evidencia IV, recomendación C).
iii. Suspender la infusión temporalmente si los triglicéridos persisten mayores de 12 mmol/L (400 mg/dl) por más de 72 horas (evidencia IV, recomendación C).
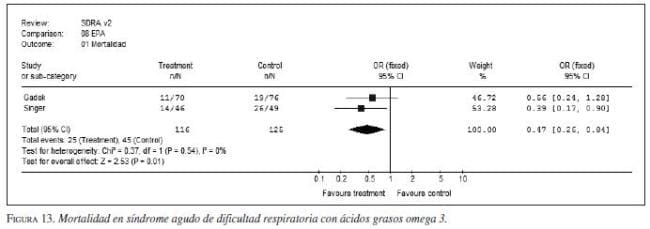
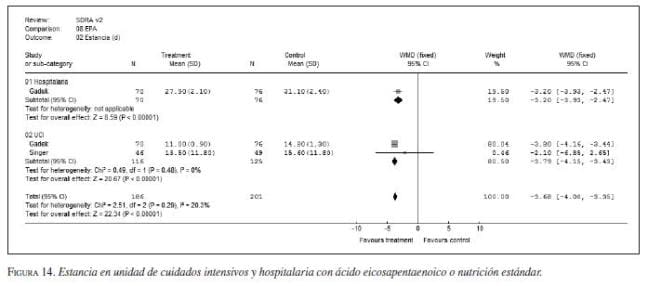
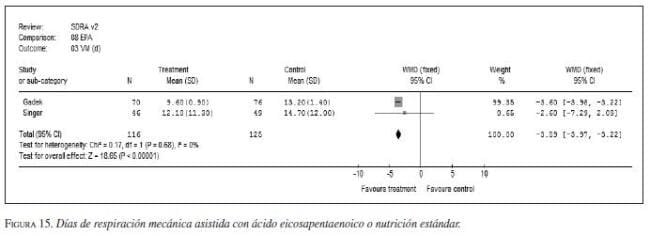
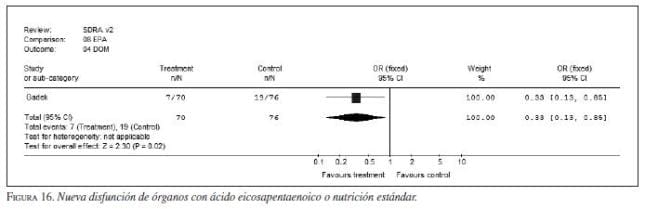
iv. Ácidos grasos poliinsaturados: los ácidos grasos omega 3 (Oxepa®) han demostrado disminuir la mortalidad y mejorar la oxigenación en pacientes críticos con patologías específicas como síndrome agudo de dificultad respiratoria y sepsis (figura 13, figura 14, figura 15, figura 16) (75,76,77). Sin embargo, se encontraron pocos estudios en pancreatitis para hacer una recomendación (78). No se recomienda aún el uso rutinario de dieta con ácido eicosapentaenoico-ácido gammalinoleico en pacientes con pancreatitis (evidencia IV, recomendación C) aunque pudiera ser de utilidad en casos de sepsis poco grave (APACHE<15) (evidencia IIa, recomendación A).
v. Tipo de triglicéridos: las preparaciones actuales de nutrición traen mezclas de triglicéridos de cadena media y larga.
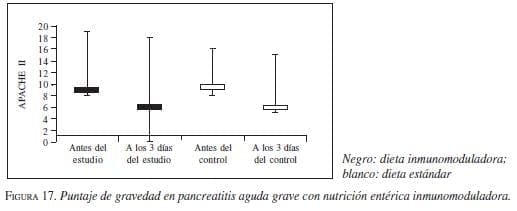
6. Inmunomodulación. Varios estudios han analizado el impacto de las dietas inmunomoduladoras en el modelo animal. No hubo diferencias estadísticamente significativas en la disminución del puntaje de gravedad para los grupos de estudio al tratarlos con dieta inmunomoduladora (p=0,2), pero sí hubo un descenso en los índices de gravedad al tercer día con ambos tipos de dieta.
7. Negro: dieta inmunomoduladora; blanco: dieta estándar
8. Un estudio comparó la dieta estándar con la inmunomoduladora que incluía glutamina, arginina y omega 3 en pacientes con pancreatitis y no encontró diferencias estadísticamente significativas en los desenlaces (figura 17) (79). No se encontraron estudios que evaluaran de forma independiente estos nutrientes a fin de conocer el impacto individual de cada uno.
En conclusión, no hay suficientes datos para recomendar un tipo de dieta inmunomoduladora en la pancreatitis grave. Se recomienda iniciar tempranamente una dieta estándar (evidencia I, recomendación A).
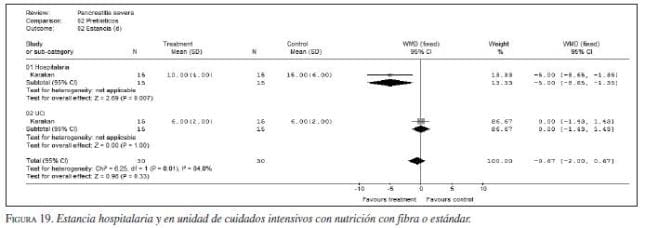
9. Prebióticos y probióticos. Aunque ha habido entusiasmo por demostrar sus efectos benéficos los resultados de los estudios no soportan aún esta teoría (80,81,82,83,84). No se recomienda el uso de probióticos de forma rutinaria en pancreatitis (evidencia IIb, recomendación A) (figura 18, figura 19, figura 20).


Conclusiones
El soporte metabólico y nutricional es un pilar importante en el manejo médico actual del paciente con pancreatitis grave no sólo como un método para disminuir el riesgo de desnutrición asociado al ayuno prolongado a que se somete en ocasiones a estos pacientes, sino como una intervención terapéutica que tiene la posibilidad de disminuir las complicaciones infecciosas y la mortalidad. Por ello, el enfoque de la farmaconutrición permite visualizar mejor la importancia de esta herramienta terapéutica con énfasis en el espectro terapéutico de cada uno de sus componentes de forma dosificada no sólo de los macronutrientes, sino también de los micronutrientes en la medida en que los hallazgos vayan arrojando mayor claridad al impacto que pueden ejercer en cada patología. No es sólo un problema de hambre, también es un enfoque inmunomodulador hasta llegar a ocupar el lugar preponderante que, en ocasiones, se le quiere dar a los antibióticos de manera injustificada como en la profilaxis de la infección en pancreatitis grave.
En los pacientes críticos con esta patología se debe establecer una estrategia de intervención nutricional de forma temprana a fin de disminuir el impacto proinflamatorio de la pancreatitis y reducir el riesgo de infección pancreática y pulmonar con un aporte proteico adecuado y vigilancia continua que coarte las tendencias hiperglucémicas asociadas y, en caso de requerirse, el control con insulina probablemente no tan estricto (<180 mg/dl).
No se encontraron estudios sobre el papel de los fructooligosacáridos como fuente de carbohidratos a fin de modular la respuesta hiperglucémica. Faltan estudios que arrojen luces sobre el posible papel de los lípidos con ácidos grasos de pescado omega 3 (ω3) por la vía del ácido eicosapentaenoico y docosahexaenoico.
Hay limitaciones para hacer recomendaciones en algunos aspectos debido a la escasez de estudios, como son la necesidad de nutrientes específicos de forma individual (glutamina, arginina, omega 3, probióticos) que se han realizado en pacientes críticos con otras patologías pero no en pancreatitis.
Este informe es una primera propuesta a fin de poder unir esfuerzos con las sociedades científicas interesadas en el tema y propender por guías en consenso a nivel nacional.
Agradecimientos
A Saúl Rugeles y Guillermo Ortiz por la revisión del manuscrito.
Conflictos de intereses
Los autores declaran que esta revisión no ha sido patrocinada por la industria farmacéutica. Norton Pérez ha sido conferencista en congresos médicos patrocinados por Abbott y Baxter. Liliana Echeverri ha sido patrocinada por Abbott, Baxter y Lafrancol para asistir a congresos. Todos los autores revisaron el manuscrito final y están de acuerdo con los resultados.
Nutrition in the Patient with Severe Acute Pancreatitis: Clinical Management Guideline
Abstract
Objective: to propose a clinical practice guideline of nutrition for patients with severe acute pancreatitis derived from the best available evidence.
Design: systematic review and clinical practice guideline.
Setting: critically ill patients at the intensive care unit.
Patients: with severe acute pancreatitis.
Intervention: enteral or parenteral nutrition. Glutamine or no glutamine. Arginine or no arginine. Omega 3 fatty acid or control.
Outcome: mortality, pulmonary, catheter associated or pancreatic infection, sepsis, ICU or hospital length of stay.
Methodology: medical database online search.
Results: 765 initial references were filtered with key words and 69 remained. 5 other articles in Spanish were considered pertinent.
Conclusions: patients with severe acute pancreatitis benefit from nutritional support, and isocaloric early enteral route is of choice during the first 3 days. Nutritional intervention could be a determinant in lowering the high morbidity and mortality rates linked with this entity, but well designed trials that elucidate the true individual effect of each constituent are scarce.
Key words: pancreatitis; enteral nutrition; parenteral nutrition, total; glutamine; arginine; probiotics.
Referencias
1. Heinrich S, Schafer M, Rousson V, Clavien PA. Evidence-based treatment of acute pancreatitis: a look at established paradigms. Ann Surg. 2006;243:154-68.
2. Braunschweig CL, Levy P, Sheean PM, Wang X. Enteral compared with parenteral nutrition: a meta-analysis. Am J Clin Nutr. 2001;74:534-42.
3. Counsell C. Formulating questions and locating primary studies for inclusion in systematic reviews. Ann Int Med. 1997;127:380-3.
4. Tonsi AF, Bacchion M, Crippa S, Malleo G, Bassi C. Acute pancreatitis at the beginning of the 21st century: the state of the art. World J Gastroenterol. 2009;15:2945-59.
5. Baron TH, Morgan DE. Acute necrotizing pancreatitis. N Engl J Med. 1999;340:1412-7.
6. Bradley EL 3rd. A clinically based classification system for acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis, Atlanta, GA, September 11 through 13, 1992. Arch Surg. 1993;128:586-90.
7. Carrasquilla G, Bossert T, Espinosa JQ, Alviar KM, Carvajal RG, Pedraza RS, et al. Elaboración de guías de práctica clínica basadas en la evidencia, evaluaciones económicas de guías de práctica clínica y del impacto de la implementación de las guías en el POS y en la unidad de pago por capitación del Sistema General de Seguridad Social en Salud Colombiano: guía metodológica. Bogotá: Ministerio de la Protección Social, Colciencias: 2009. Fecha de consulta: 8 de noviembre de 2009. Disponible en: https://www.colciencias.gov.co/portalcol/ downloads/archivosSoporte Convocatorias/ 2557.pdf.
8. Heyland DK, Heyland RD, Jones NE, Dhaliwal R, Day AG, Jian X, et al. Creating a culture of clinical excellence in critical care nutrition: The Critical Care Nutrition Best of the Best Award. JPEN J Parenter Enteral Nutr.: Disponible en: nutritioncare.org. Consultado el 23/06/2010.
9. Jain MK, Heyland D, Dhaliwal R, Day AG, Drover J, Keefe L, et al. Dissemination of the Canadian clinical practice guidelines for nutrition support: results of a cluster randomized controlled trial. Crit Care Med. 2006;34:2362-9.
10. Orbuch M. Optimizing outcomes in acute pancreatitis. Fam Pract. 2004;6:607-29.
11. De Campos T, Parreira JG, Utiyama E, Rasslan S. A Brazilian survey regarding the management of acute pancreatitis. Rev Col Bras Cir. 2008;35:304-10.
12. Bozzetti F, Forbes A. The ESPEN clinical practice guidelines on parenteral nutrition: present status and perspectives for future research. Clin Nutr. 2009;28:359-64.
13. Gianotti L, Meier R, Lobo DN, Bassi C, Dejong CH, Ockenga J, et al. ESPEN Guidelines on parenteral nutrition: pancreas. Clin Nutr. 2009;28:428-35.
14. August D, Teitelbaum D, Albina J, Bothe A, Guenter P, Heitkemper M, et al. Guidelines for the use of parenteral and enteral nutrition in adult and pediatric patients. JPEN J Parenter Enteral Nutr. 2002;26:1-138SA.
15. Albina JE, Albright RC, Jr Apovian C, August DA, Beindorff ME, Brody R, et al. Specific guidelines for disease – adults. JPEN J Parenter Enteral Nutr. 2002;26:61SA-96SA.
16. Martindale RG, McClave SA, Vanek VW, McCarthy M, Roberts P, Taylor B, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine and American Society for Parenteral and Enteral Nutrition. Crit Care Med. 2009;37:1757-761.
17. McClave SA, Martindale RG, Vanek VW, McCarthy M, Roberts P, Taylor B, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (ASPEN). JPEN J Parenter Enteral Nutr. 2009;33:277-316.
18. United Kingdom guidelines for the management of acute pancreatitis. British Society of Gastroenterology. Gut. 1998;42(Suppl.2):S1-13.
19. Gurusamy KS, Farouk M, Tweedie JH. UK guidelines for management of acute pancreatitis: is it time to change? Gut. 2005;54:1344-5.
20. UK guidelines for the management of acute pancreatitis. Gut. 2005;54(Suppl.3):iii1-9.
21. Heyland DK, Dhaliwal R, Drover JW, Gramlich L, Dodek P, the Canadian Critical Care Clinical Practice Guidelines Committee. Canadian Clinical Practice Guidelines for nutrition support in mechanically ventilated, critically ill adult patients. JPEN J Parenter Enteral Nutr. 2003;27:355-73.
22. Nathens AB, Curtis JR, Beale RJ, Cook DJ, Moreno RP, Romand JA, et al. Management of the critically ill patient with severe acute pancreatitis. Crit Care Med. 2004;32:2524-36.
23. Hurtado-Andrade H, Blancas-Valencia JM, Cadena-Díaz J, Esquivel-Priego JL, Mier, Terán-Suárez J, Pérez-Manauta J, et al. Clinical guidelines for the diagnosis and treatment of acute pancreatitis. Treatment. Rev Gastroenterol Mex. 2007;72:393-6.
24. GRADE profiler [program]. Version 3.1. Grade Working Group, 2007.
25. Review Manager [program]. Version 4.2.8. Copenhagen: Cochrane Collaboration; 2005.
26. Scottish Intercollegiate Guidelines Network (SIGN). SIGN guidelines – an introduction to SIGN methodology for the development of evidence-based clinical guidelines. Edinburgh: SIGN secretariat, Royal College of Physicians of Edinburgh; 1999.
27. Ranson JH, Rifkind KM, Roses DF, Fink SD, Eng K, Spencer FC. Prognostic signs and the role of operative management in acute pancreatitis. Surg Gynecol Obstet. 1974;139:69-81.
28. Knaus WA, Zimmerman JE, Wagner DP, Draper EA, Lawrence DE. APACHE – acute physiology and chronic health evaluation: a physiologically based classification system. Crit Care Med. 1981;9:591-7.
29. Balthazar EJ, Ranson JHC, Naidich DP, Megibow AJ, Caccavale R, Cooper MM. Acute pancreatitis: prognostic value of CT. Radiology. 1985;156:767-72.
30. Balthazar EJ, Robinson DL, Megibow AJ, Ranson JH. Acute pancreatitis: value of CT in establishing prognosis. Radiology. 1990;175:331-6.
31. Vriens PW, Linde Pvd, Slotema ET, EWarmerdam P, Breslau PJ. Computed tomography severity index is an early prognostic tool for acute pancreatitis. J Am Coll Surg. 2005;201:497-502.
32. Doley RP, Yadav TD, Wig JD, Kochhar R, Singh G, Bharathy KGS, et al. Enteral nutrition in severe acute pancreatitis. JOP. J Pancreas. 2009;10:157-62.
33. Casas M, Mora J, Fort E, Aracil C, Busquets D, Galter S, et al. Total enteral nutrition vs. total parenteral nutrition in patients with severe acute pancreatitis. Rev Esp Enferm Dig. 2007;99:264-9.
34. Marik PE, Zaloga GP. Meta-analysis of parenteral nutrition versus enteral nutrition in patients with acute pancreatitis. BMJ 2004;328:1407-13.
35. Petrov MS, Kukosh MV, Emelyanov NV. A randomized controlled trial of enteral versus parenteral feeding in patients with predicted severe acute pancreatitis shows a significant reduction in mortality and in infected pancreatic complications with total enteral nutrition. Dig Surg. 2006;23:336-44.
36. Louie BE, Noseworthy T, Hailey D, Gramlich LM, Jacobs P, Warnock GL. Enteral or parenteral nutrition for severe pancreatitis: A randomized controlled trial and health technology assessment. Can J Surg. 2005;48:298-306.
37. Gupta R, Patel K, Calder PC, Yaqoob P, Primrose JN, Johnson CD.A randomized clinical trial to assess the effect of total enteral and total parenteral nutritional support on metabolic, inflammatory and oxidative markers in patients with predicted severe acute pancreatitis (APACHE II > or = 6). Pancreatology. 2003;3:406-13.
38. Abou-Assi S, Craig K, O’Keefe SJ. Hypocaloric jejunal feeding is better than total parenteral nutrition in acute pancreatitis: results of a randomized comparative study. Am J Gastroenterol 2002;97:2255-62.
39. Olah A, Pardavi G, Belagyi T, Nagy A, Issekutz A, Mohamed GE. Early nasojejunal feeding in acute pancreatitis is associated with a lower complication rate. Nutrition. 2002;18:259-62.
40. Kalfarentzos FE, Karavias DD, Karatzas TM, Alevizatos BA, Androulakis JA. Total parenteral nutrition in severe acute pancreatitis. J Am Coll Nutr. 1991;10:156-62.
41. Kalfarentzos F, Kehagias J, Mead N, Kokkinis K, Gogos CA. Enteral nutrition is superior to parenteral nutrition in severe acute pancreatitis: results of a randomized prospective trial. Br J Surg. 1997;84:1665-9.
42. McClave SA, Greene LM, Snider HL, Makk LJ, Cheadle WG, Owens NA, et al. Comparison of the safety of early enteral vs parenteral nutrition in mild acute pancreatitis. JPEN J Parenter Enteral Nutr. 1997;21:14-20.
43. McClave SA, Chang WK, Dhaliwal R, Heyland DK. Nutrition support in acute pancreatitis: a systematic review of the literature. JPEN J Parenter Enteral Nutr. 2006;30:143-56.
44. Windsor ACJ, Kanwar S, Li AG, Barnes E, Guthrie JA, Spark JI, et al. Compared with parenteral nutrition, enteral feeding attenuates the acute phase response and improves disease severity in acute pancreatitis. Gut. 1998;42:431-5.
45. Petrov MS, van Santvoort HC, Besselink MG, van der Heijden GJ, Windsor JA, Gooszen HG. Enteral nutrition and the risk of mortality and infectious complications in patients with severe acute pancreatitis: a meta-analysis of randomized trials. Arch Surg. 2008;143:1111-7.
46. Marik PE, Zaloga GP. Meta-analysis of parenteral nutrition versus enteral nutrition in patients with acute pancreatitis. BMJ 2004;328:1407-13.
47. Al-Omran MGA, Wilke D. Enteral versus parenteral nutrition for acute pancreatitis. Cochrane Database Syst Rev. 2002. 48. Al-Omran M, Groof A, Wilke D. Enteral versus parenteral nutrition for acute pancreatitis (Cochrane Review). The Cochrane Library, 2005:12.
49. Jiang K, Chen X-Z, Xia Q, Tang W-F, Wang L. Early nasogastric enteral nutrition for severe acute pancreatitis: A systematic review. World J Gastroenterol. 2007;13:5253-60.
50. Petrov MS, Correia MI, Windsor JA. Nasogastric tube feeding in predicted severe acute pancreatitis. A systematic review of the literature to determine safety and tolerance. JOP. J Pancreas. 2008;9:440-8.
51. Petrov MS, Loveday BP, Pylypchuk RD, McIlroy K, Phillips AR, Windsor JA. Systematic review and meta-analysis of enteral nutrition formulations in acute pancreatitis. Br J Surg. 2009;96:1243-52.
52. Kumar A, Singh N, Prakash S, Saraya A, Joshi YK. Early enteral nutrition in severe acute pancreatitis: a prospective randomized controlled trial comparing nasojejunal and nasogastric routes. J Clin Gastroenterol. 2006;40:431-4.
53. Eatock FC, Brombacher GD, Steven A, Imrie CW, McKay CJ, Carter R. Nasogastric feeding in severe acute pancreatitis may be practical and safe. Int J Pancreatol. 2000;28:23-9.
54. Eatock FC, Chong P, Menezes N, Murray L, McKay CJ, Carter CR, et al. A randomized study of early nasogastric versus nasojejunal feeding in severe acute pancreatitis. Am J Gastroenterol. 2005;100:432-9.
55. Eckerwall GE, Axelsson JB, Andersson RG. Early nasogastric feeding in predicted severe acute pancreatitis: A clinical, randomized study. Ann Surg. 2006;244:959-67.
56. Heiselman DE, Hofer T, Vidovich RR. Enteral feeding tube placement success with intravenous metoclopramide administration in ICU patients. Chest. 1995;107:1686-8.
57. Joubert C, Tiengou LE, Hourmand-Ollivier I, Dao MT, Piquet MA. Feasibility of self-propelling nasojejunal feeding tube in patients with acute pancreatitis. JPEN J Parenter Enteral Nutr. 2008;32:622-4.
58. Patiño JF. Soporte metabólico hipocalórico del paciente en estado séptico. In: Patiño JF, editor. Infección quirúrgica. Bogotá: Centro Médico de los Andes; 1989. p. 161-72.
59. Patiño JF, de Pimiento SE, Vergara A, Savino P, Rodríguez M, Escallón J. Hypocaloric support in the critically ill. World J Surg. 1999;23:553-9.
60. Pérez N, Echeverry L, Forero A, García N, Vega S, López O, et al. Nutrición en pacientes críticos de la Orinoquia colombiana. Acta Colombiana de Cuidado Intensivo. 2009;9:206-13.
61. Pérez N. Soporte metabólico y nutricional en sepsis. Tópicos en Medicina Intensiva 2003;2:221-7.
62. The NICE-SUGAR Study Investigators. Intensive versus conventional glucose control in critically ill patients. N Engl J Med. 2009;360:1283-97.
63. Griesdale DEG., Souza RJd, Dam RMv, Heyland DK, Cook DJ, Malhotra A, et al. Intensive insulin therapy and mortality among critically ill patients: a meta-analysis including NICE-SUGAR study data. CMAJ. 2009;180:821-7.
64. Gadek JE, DeMichele SJ, Karlstad MD, Pacht ER, Donahoe M, Albertson TE, et al. Effect of enteral feeding with eicosapentaenoic acid, gamma-linolenic acid, and antioxidants in patients with acute respiratory distress syndrome. Enteral Nutrition in ARDS Study Group. Crit Care Med. 1999;27:1409-20.
65. Singer P, Theilla M, Fisher H, Gibstein L, Grozovski E, Cohen J. Benefit of an enteral diet enriched with eicosapentaenoic acid and gammalinolenic acid in ventilated patients with acute lung injury. Crit Care Med. 2006;34:1033-8.
66. Pontes-Arruda A, Aragão AM, Albuquerque JD. Effects of enteral feeding with eicosapentaenoic acid, gamma-linolenic acid, and antioxidants in mechanically ventilated patients with severe sepsis and septic shock. Crit Care Med. 2006;34:2325-33.
67. Lasztity N, Hamvas J, Biró L, Németh E, Marosvölgyi T, Decsi T, et al. Effect of enterally administered n-3 polyunsaturated fatty acids in acute pancreatitis—a prospective randomized clinical trial. Clin Nutr. 2005;24:198-205.
68. Pearce CB, Sadek SA, Walters AM, Goggin PM, Somers SS, Toh SK, et al. A double-blind, randomized, controlled trial to study the effects of an enteral feed supplemented with glutamine, arginine, and omega-3 fatty acid in predicted acute severe pancreatitis. JOP. 2006;7:361-71.
69. Sun S, Yang K, He X, Tian J, Ma B, Jiang L. Probiotics in patients with severe acute pancreatitis: a meta-analysis. Langenbecks Arch Surg. 2009;394:171-7.
70. Besselink MG., Timmerman HM, Buskens E, Nieuwenhuijs VB, Akkermans LM, Gooszen HG. Probiotic prophylaxis in patients with predicted severe acute pancreatitis (PROPATRIA): design and rationale of a double-blind, placebo-controlled randomised multicenter trial [ISRCTN38327949]. BMC Surg. 2004;4:12.
71. Besselink MG, van Santvoort HC, Boermeester MA, Buskens E, Akkermans LM, Gooszen HG. Probiotic prophylaxis in acute pancreatitis: prudence required. Nat Clin Pract Gastroenterol Hepatol. 2009;6:E3-6.
72. Karakan T, Ergun M, Dogan I, Cindoruk M, Unal S. Comparison of early enteral nutrition in severe acute pancreatitis with prebiotic fiber supplementation versus standard enteral solution: a prospective randomized double-blind study. World J Gastroenterol 2007;13:2733-7.
73. Olah A, Belagyi T, Issekutz A, Gamal ME, Bengmark S. Randomized clinical trial of specific lactobacillus and fibre supplement to early enteral nutrition in patients with acute pancreatitis. Br J Surg. 2002;89(9):1103-7.
Correspondencia:
NORTON PÉREZ, MD
Correo electrónico: naperez2000@hotmail.com
Villavicencio, Colombia

* Nota de los autores: las gráficos de Forrester que corresponden a las figuras 4 a 7, 9, 11, 13 a 16, y 18 a 20 fueron elaboradas en el programa
Review Manager; las salidas aparecen en inglés y no se pueden editar para pasarlas a español.
