Los glucocorticoides ejercen la mayoría de sus efectos a través de su unión con receptores citosólicos específicos y ubicuos (19). Los glucocorticoides circulan en la sangre en forma libre o unidos a una globulina, pero sólo la hormona libre parece ser capaz de difundir a través de la membrana externa celular para unirse a los receptores citoplasmáticos de alta afinidad. Estos receptores constituyen una gran familia en la que se incluyen los receptores para la triyodotironina, vitamina D y ácido retinoico (20). Una vez se unen al receptor que está presente en el núcleo, puede actuar sobre la transcripción con acción sobre la DNA, afectando la transcripción genética mediante la formación de complejos intranucleares (21).
Los glucocorticoides tienen un profundo efecto sobre los adipocitos al alterar tanto la acumulación como la movilización de los Iípidos. La actividad de la lipoproteína-lipasa, el principal determinante enzimático de la captación de los triglicéridos, está incrementada por el cortisol (22). Los glucocorticoides, también tienen un efecto permisivo sobre la movilización de los Iípidos estimulada por las catecolarillnas (23), y pueden tener un efecto sinérgico particular sobre la acumulación de grasa, cuando están presentes niveles altos de insulina.

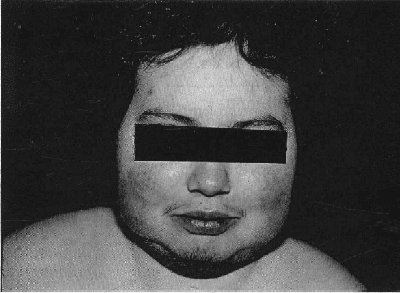
Fig. 1. Cambios en la distribución de los depósitos grasos en el síndrome de Cushing. Nótase la obesidad central.
Virtualmente todos los pacientes con hipercortisolismo causado por síndrome de Cushing, tienen incrementados los depósitos de grasa como uno de los signos más tempranos de este desorden (Fig. 1). Las cantidades incrementadas de grasa, se depositan en el peritoneo, mediastino y sitios subcutáneos de la cara y el cuello. En el 50% de los pacientes los depósitos abdominales son “centrípetos”, también llamados obesidad troncal. La acumulación es tanto subcutánea como intraabdominal, pero más prominente alrededor de las vísceras debido a que la grasa intraabdominal parece tener receptores de glucocorticoides en una población más densa que otros tejidos. Depósitos significativos aparecen en las mejillas (“facies de luna llena”), fosas supraclavicular o temporal, o en el área cervicodorsal (“giba de búfalo”) (Figs. 2 y 3).
 |
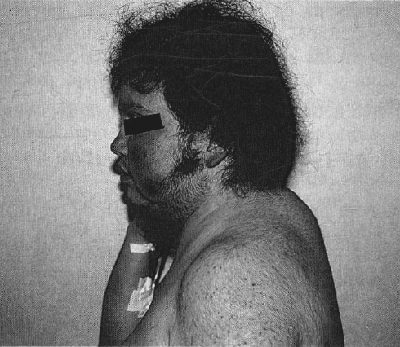 |
| Fig. 2. Alteración de la facies y de los depósitos grasos supraclaviculares. | Fig. 3. Alteración de los depósitos de grasa en el área cervicodorsal (“giba de búfalo”). |
Los glucocorticoides inhiben la división de las células epidérmicas y la síntesis de DNA (24), disminuyen la síntesis de colágeno por los fibroblastos, bloqueando la producción de colagenasa. Estas alteraciones llevan a cambios dermatológicos como atrofia de la piel, adelgazamiento de la epidermis con separación y afinamiento de las fibras elásticas y colágenas, debilidad de la fascia muscular y exposición del tejido vascular subcutáneo. Un trauma mínimo puede causar equimosis. Se ven telangiectasias y púrpura. Acné por esteroides, tipificado por numerosas lesiones pustulosas (lo que refleja incremento de los andrógenos) o lesiones papulares (exceso de glucocorticoides), pueden ocurrir en la cara, pecho y dorso.
Un signo que es virtualmente patognomónico del síndrome de Cushing, es la presencia de estrías violáceas de más de 1 cm de diámetro, que aparecen con mayor frecuencia en el abdomen, pero que se pueden encontrar en muslos, nalgas y parte baja del abdomen (Fig. 4). Estas estrías se deben diferenciar de aquellas que frecuentemente se ven después deI parto o en los obesos con ganancia rápida de peso, las cuales son generalmente rosadas o rojizas, menos pigmentadas.
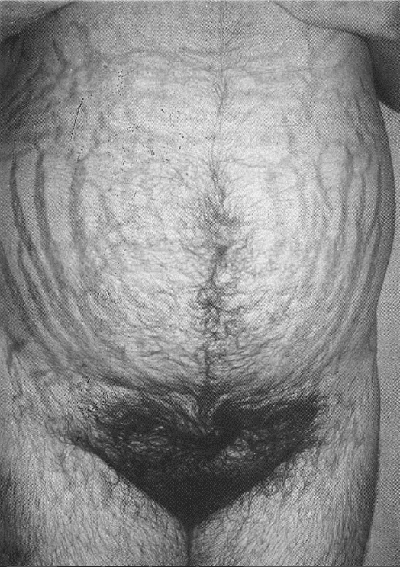
Fig. 4. La apariencia patognomónica de las estrías en el síndrome de Cushing.
Como en cualquier condición que cause hiperinsulismo o resistencia a la insulina, la acantosis nigricans puede ser encontrada en el síndrome de Cushing. Se cree que su mecanismo de aparición, se debe a una disminución de la viscosidad en la matriz extracelular de la piel causada por una pobre calidad en la formación del glicosaminoglicán (25).
El cambio más común en el pelo del cuerpo en este síndrome es el desarrollo de hipertricosis en la frente y parte superior de las mejillas. La virilización franca es poco común y puede sugerir un tumor adrenal primario secretor de andrógenos.
Existe una profunda atrofia de las fibras musculares sin que se irfduzca a la necrosis tisular (26). Los glucocorticoides deprimen la síntesis de proteína muscular y convierten al tejido muscular profundamente resistente a la insulina, probablemente por defecto, en un receptor posinsulina. Incrementan la actividad de la glutamo-sintetasa, una de las vías a través de las cuales el músculo esquelético suple la demanda sistémica para el carbono de los aminoácidos.
Los glucocorticoides causan destrucción del tejido linfoide. La involución del timo, del bazo y de los nódulos linfáticos, ocurre por vía de muerte celular programada, denominada apoptosis. Mientras que los linfocitos T y B bien diferenciados son susceptibles a los efectos de los glucocorticoides, las células madres precursoras, que son inmunocompetentes pero en vía de maduración, no son sensibles a la muerte celular inducida por el cortisol. Una vez que el hipercortisolismo se resuelve, el sistema linfático retiene la capacidad de renovarse (27).
Tanto la función de las células T como la de las B son afectadas por una concentración suprafisiológica de glucocorticoides. También ocurre neutrofilia, causada por liberación de un número de neutrófilos a partir del fondo común de granulocitos, los cuales normalmente constituyen más de la mitad de la población de leucocitos, reduciendo la migración de granulocitos desde el torrente sanguíneo e incrementando en la médula, la síntesis de neutrófilos. El conteo de eosinófilos y basófilos, está también disminuido (28).
La actividad fagocítica de los neutrófilos y de todo el sistema reticuloendotelial está reducida. Los glucocorticoides inhiben la diferenciación de los macrófagos, deprimen la mielopoyesis, bloquean la liberación de citoquinas como la interleuquina-l, la interleuquina-6, el factor de necrosis tumoral alfa, y mengua la producción de prostaglandina y leucotrienos que forman normalmente parte de la respuesta inflamatoria. Estos eventos llevan a un incremento del riesgo de infecciones micóticas de la piel, tales como candidiasis mucocutánea, pitiriasis y pobre cicatrización de la herida. Pacientes con extremo hipercortisolismo (cortisol en el plasma, 70 mcg/dL) tienen riesgo de perforación de vísceras y de infecciones oportunistas y micóticas como pneumocistis carinii, aspergilosis, nocardiosis, criptococosis, histoplasmosis y cándida (29, 30).
Sobre el esqueleto, los glucocorticoides también tienen un efecto marcado. En los niños,suprimen la velocidad del crecimiento óseo, como resultado de la inhibición de la secreción de la hormona del crecimiento, elaboración de inhibidores de somatomedín, y efectos directos en la placa de crecimiento, en donde los glucocorticoides causan depresión de la producción de mucopolisacáridos, lo cual reduce la matríz ósea cartilaginosa y la proliferación epifisaria (31).
La osteopenia es común. Los glucocorticoides deterioran la absorción intestinal de calcio e inhiben los efectos de la vitamina D en el intestino o deprimen la hidroxilación hepática de esta vitamina, lo cual conduce a un hiperparatiroidismo secundario. Más adelante, la reabsorción tubular renal de calcio también se deteriora. Otro efecto importante es la reducción de la producción osteoclástica. Fracturas del pie, costillas o vértebras, pueden ser los signos de presentación del síndrome de Cushing, especialmente en hombres (32).
Con frecuencia se observa ulceración péptica en pacientes que están tomando altas dosis de glucocorticoides, pero parece ser rara en pacientes con hipersecreción endógena de cortisol. La mayoría de las úlceras inducidas por esteroides se encuentran en el píloro, menos del 25% están en el duodeno. La pancreatitis aguda es otra complicación del hipercortisolismo exógeno, no vista con tanta frecuencia en el endógeno.
Los glucocorticoides ejercen varios efectos en el sistema cardiovascular dando origen a morbilidad en el síndrome de Cushing. La hipertensión arterial ocurre en tres cuartas partes de los pacientes con este síndrome y es multifactorial en su causa (33). El desarrollo de hipertensión refleja la interacción de factores que regulan el volumen sanguíneo, la resistencia vascular periférica y el gasto cardíaco, todos los cuales están incrementados en el síndrome de Cushing (34). Estos factores incluyen el paso del sodio al líquido del espacio extracelular inducido por los glucocorticoides, incremento de la acción mineralocorticoide, aumento del tono vascular y efectos en el sistema reninaangiotensina. Hay alza en la presión sistólica, asociada con antinatriuresis, expansión en el volumen del líquido extracelular y del volumen plasmático. Los niveles del factor natriurético atrial generalmente están aumentados en el síndrome de Cushing y se correlaciona con los niveles de cortisol, pero no con la presión sanguínea, lo que sugiere un sodio incrementado en el líquido extracelular (35).
Los glucocorticoides ejercen un efecto permisivo en el tono vascular. Realzan la respuesta presora a las sustancias vasoactivas. Hay un incremento, en el síndrome de Cushing, de la secreción del vasoconstrictor endotelina, y de la captación del calcio. El óxido nítrico recientemente fue identificado como un factor de relajación, derivado de la célula endotelial. Los glucocorticoides inhiben la sintetasa del óxido nítrico, sugiriendo un papel en la vasoconstricción (33). Se ha encontrado en estos pacientes una disminución de la excreción urinaria de prostaglandina-E2 y calicreína, conocidos vasodilatadores.
Otro papel, que ha sido investigado, es el efecto del cortisol en el sistema renina-angiotensina. Los niveles del sustrato plasmático de la renina (angiotensinógeno) están elevados en aproximadamente dos veces el normal, debido a un efecto directo de los glucocorticoides sobre la síntesis hepática del mismo, en pacientes con síndrome de Cushing espontáneo o iatrogénico.
Las anormalidades en los lípidos, la hipertensión, y la diabetes mellitus encontradas en el síndrome de Cushing, conducen a la enfermedad cardiovascular ateroesclerótica (36). Las complicaciones cardiovasculares causantes de mortalidad en el síndrome de Cushing, informadas por Plotz (en el 40%) fueron falla cardíaca, accidente cardiovascular e insuficiencia renal (37).
El cortisol y varios de sus análogos sintéticos, son referidos como glucocorticoides, debido a que estos agentes aumentan el gasto hepático de glucosa, estimulando la gluconeogénesis hepática. Después de la administración de glucocorticoides las enzimas hepáticas glucosa-6-fosfatasa, la fructuosa-6-difosfatasa y la fosfoenolpiruvato carboxiquinasa, todas incluidas en la gluconeogénesis, tienen aumentada su concentración y actividad. Al mismo tiempo que las vías gluconeogénicas hepáticas son activadas, la síntesis proteica muscular es inhibida y su catabolismo estimulado. Se puede observar una masiva liberación de alanina resultante de la glucogenólisis muscular, combinada con producción de nitrógeno derivado del catabolismo de las proteínas.
La hiperalinemia no sólo suministra el sustrato para la gluconeogénesis hepática, sino que también estimula la secreción de glucagón por las células pancreáticas, que en parte explican el marcado incremento del gasto hepático de glucosa, después de la administración de glucocorticoides (38).
El hipercortisolismo también estimula el aumento de la síntesis hepática de lipoproteínas de muy baja densidad, LDL, HDL, Y triglicéridos, y suprime el eje tiroideo; T3, T4, Y T4 libre están reducidos. Los niveles de testosterona en el hombre y estrógenos en la mujer están bajos. Ocurren comúnmente irregularidades menstruales, amenorrea, infertilidad e impotencia. Hay disminución de las gonadotropinas e inhibición de LH y FSH (39, 40).
Generalmente no se observan anormalidades electrolíticas en el síndrome de Cushing, pero cuando la excreción de cortisol en la orina es mayor de 1.500 mcg/día, se puede encontrar hipocaliemia con alcalosis metabólica, lo que puede representar una acción mineralocorticoide en el túbulo renal.
Finalmente, se sabe que el exceso de glucocorticoides altera los innumerables procesos cognoscitivos y psicológicos. Los pacientes muestran síntomas que van desde fatiga, irritabilidad, ansiedad, disminución de la libido, insomnio, pérdida de la memoria y la concentración, cambios en el apetito, depresión, euforia, manía y alucinaciones. La forma exacta de los efectos psicológicos del hipercortisolismo no sólo dependen del sistema endocrino sino también de otros factores, tales como la constitución personal del paciente, el desarrollo de la personalidad, y las capacidades intelectuales y el estado emocional (41).
Como ya se ha esbozado, las anormalidades clínicas y de laboratorio en el síndrome de Cushing primariamente resultan de los efectos farmacológicos de los glucocorticoides que se anotan en el Listado de signos y síntomas N° l.
Listado de signos y síntomas N° 1. Aspectos Clínicos del síndrome de Cushing.
Generales
Cutáneos
Neuropsiquiátricos Disfuncionales gonadales
Músculo-esqueléticos
Metabólicos
|
Algunas de las manifestaciones se relacionan con el incremento de la secreción de andrógenos adrenales (Dihidroepandrosterona DHEA, sulfato de dihidroepandrosterona DHEA-S y androstenediona) que en alguna forma son ACTH-dependiente o que en el caso de los tumores adrenales, pueden ser secretados autónomamente.
