Proteína C Reactiva como Biomarcador Predictivo de Fuga Anastomótica en Cirugía Oncológica Colorrectal: Estudio de cohorte retrospectivo
C-Reactive Protein as a Predictive Biomarker of Anastomotic Leak in Colorectal Cancer Surgery: A retrospective cohort study
Resumen
Introducción. La fuga anastomótica es la complicación más grave del tratamiento quirúrgico del cáncer de colon por su alta morbimortalidad. El diagnóstico evidente, manifestado por la salida de contenido intestinal por drenajes o la herida quirúrgica, ocurre tardíamente (entre el 6º y 8º día). El objetivo de este trabajo fue estudiar la variación de los valores de la proteína C reactiva postoperatoria para hacer un diagnóstico precoz.
Métodos. Estudio observacional, analítico, retrospectivo, de una cohorte de pacientes con neoplasia, en quienes se realizó cirugía oncológica con anastomosis intestinal, entre enero de 2019 y diciembre de 2021. Se midieron los valores en sangre de proteína C reactiva postoperatoria (1°, 3° y 5° días).
Resultados. Se compararon 225 casos operados que no presentaron fuga con 45 casos con fuga. En los casos sin fuga, el valor de proteína C reactiva al 3º día fue de 148 mg/l y al 5º día de 71 mg/l, mientras en los casos con fuga, los valores fueron de 228,24 mg/l y 228,04 mg/l, respectivamente (p<0,05). Para un valor de 197 mg/l al 3º día la sensibilidad fue de 77 % y para un valor de 120 mg/l al 5º día la sensibilidad fue de 84 %.
Conclusión. El mejor resultado de proteína C reactiva postoperatoria para detectar precozmente la fuga anastomótica se observó al 5º día. El valor de 127 mg/l tuvo la mejor sensibilidad, especificidad y valor predictivo negativo, lo cual permitiría el diagnóstico temprano y manejo oportuno de esta complicación.
Palabras clave: proteína C-reactiva; neoplasias colorrectales; anastomosis quirúrgica; fuga anastomótica; complicaciones posoperatorias; diagnóstico precoz.
Abstract
Introduction. Anastomotic leak is the most serious complication of surgical treatment of colon cancer due to its high morbidity and mortality. The obvious diagnosis manifested by the exit of intestinal content through drains or the operative wound, occurs late (between the 6th and 8th day). The objective of this work was to study the postoperative C-reactive protein values to make an early diagnosis.
Methods. Observational, analytical, retrospective study of a cohort of patients undergoing colorectal surgery for neoplasia, between January 2019 and December 2021, who underwent oncological surgery with intestinal anastomosis and measured CRP blood values on 1st, 3rd and 5th post-operative days.
Results. Two-hundred-twenty-five operated cases that did not present leaks were compared with 45 cases with leaks, with CRP values on the 3rd and 5th day of 148mg/l and 71mg/l in cases without leakage and CRP values of 228.24mg/l and 228.04 mg/l in cases with leakage on the 3rd and 5th day, respectively (p<0.05), CRP value of 197mg/l on the 3rd day has a sensitivity of 77%; CRP value of 120mg/l on the 5th day, has a sensitivity of 84%.
Conclusions. The best result for CPR to early diagnosis of anastomotic leak was observed on the 5th day, having the value of 127 mg/l the best sensitivity, specificity and NPV, which would allow early diagnosis and timely management.
Keywords: C-reactive protein; colorectal neoplasms; surgical anastomosis; anastomotic leak; postoperative complications; early diagnosis.
Introducción – Fuga Anastomótica en Cirugía Oncológica Colorrectal
El cáncer de colon es una enfermedad altamente prevalente, con una incidencia anual creciente, siendo en la actualidad la cuarta neoplasia con mayor número de casos nuevos detectados en el mundo. La neoplasia de colon fue responsable del 9,5 % de las muertes por cáncer en mujeres a nivel mundial y del 9 % del total de muertes por neoplasia reportadas en hombres 1.
El manejo quirúrgico es la primera opción de tratamiento, mediante la resección del segmento afectado con márgenes oncológicos y la anastomosis para restaurar el tránsito intestinal normal.
Sin embargo, las alteraciones en la cicatrización de la anastomosis pueden desencadenar salida de contenido intestinal a la cavidad abdominal, denominado fuga de la anastomosis (FA), que conlleva a graves complicaciones, como peritonitis, sepsis y muerte 2,3.
Debido a su alta morbimortalidad, la FA es la más frecuente y temida complicación del tratamiento quirúrgico del cáncer de colon, asociada en algunos casos a la necesidad de reoperaciones, a estancia posoperatoria prolongada e ingreso a unidad de cuidados intensivos, además de peor pronóstico en la supervivencia libre de enfermedad a largo plazo 4-7 e incremento de 3 a 4 veces en el costo por hospitalización 8.
El reconocimiento temprano de esta complicación es difícil debido a que en un inicio los pacientes pueden ser asintomáticos y en los días siguientes presentar signos inespecíficos:
Tales como dolor abdominal, íleo, fiebre y problemas cardiorrespiratorios, que evolucionan hasta el fallo orgánico agudo y sepsis. El diagnóstico precoz antes del quinto día se dificulta debido a que no existen signos exclusivos que puedan atribuirse a una FA.
El diagnóstico evidente que se manifiesta por la salida de contenido intestinal, a través de los drenajes o la herida quirúrgica, usualmente ocurre entre el 6° y 8° día posoperatorio, cuando las complicaciones sépticas son graves y el paciente ya está en shock 7,9-11.
Se ha reportado una media de ocho días para la aparición evidente de la FA 6,12.
La evaluación clínica y el examen físico del abdomen por parte del cirujano tiene cifras de sensibilidad y especificidad del 62 % y del 52 %, respectivamente para predecir la FA, por lo que se considera una técnica inadecuada para el diagnóstico precoz 13.
Por otro lado, los estudios de imágenes, como tomografía computarizada (TC), reportan sensibilidad de 59 %, especificidad de 88 %, valor predictivo positivo (VPP) de 82 % y valor predictivo negativo (VPN) de 70 %, por lo cual los autores señalan que, dada esta importante tasa de falsos negativos, la TC no descarta una FA, e incluso puede llevar a confundir con complicaciones respiratorias (atelectasias, derrame pleural, infiltrado intersticial o neumonía) 14, retrasando las medidas quirúrgicas necesarias.
Dentro de los marcadores sanguíneos y reactantes de fase aguda:
Se han estudiado la procalcitonina y las proteínas en el líquido de los drenajes 9,12, con buena sensibilidad y especificidad, pero alto costo y falta de disponibilidad en muchos centros.
La proteína C reactiva (PCR) es un reactante de fase aguda, sintetizado casi exclusivamente en el hígado, que se libera en respuesta a la estimulación de citoquinas proinflamatorias por células dañadas.
Debido a su rápida elevación y vida medía corta, la PCR es un marcador sensible pero no específico de la inflamación aguda, por lo que el aumento de sus valores en sangre se ha utilizado como marcador temprano de complicaciones infecciosas posoperatorias 9,12,15.
Además, la disponibilidad de PCR en la mayoría de los laboratorios y su costo accesible hacen oportuno el estudio de este marcador y las variaciones de sus valores séricos en pacientes operados.
El objetivo de esta investigación fue evaluar el valor predictivo de la PCR en FA en pacientes sometidos a cirugía oncológica colorrectal de cáncer de colon en el Hospital Nacional Edgardo Rebagliati Martins – EsSalud, de Lima, Perú, determinando en nuestro medio la sensibilidad y el mejor punto de corte.
Métodos – Fuga Anastomótica en Cirugía Oncológica Colorrectal
Se realizó un estudio observacional analítico, retrospectivo, de una cohorte de pacientes que tuvieron diagnóstico preoperatorio de cáncer de colon, operados de manera programada por médicos del Servicio de Cirugía Colorrectal del Hospital Nacional Edgardo Rebagliati Martins – EsSalud, en Lima, Perú, a los cuales se les realizó cirugía resectiva oncológica curativa con anastomosis intestinal, en el periodo de enero del 2019 a diciembre 2021.
Se excluyeron los pacientes menores de 18 años, casos operados de emergencia, aquellos en que no se realizó anastomosis primaria, así como en los que se realizó ostomía de protección, cirugías paliativas, cirugía con anastomosis a recto medio o inferior y pacientes que recibieron radioterapia en pelvis en el preoperatorio.
Dentro de la técnica quirúrgica estándar del servicio, en todos los casos se utilizó sutura mecánica para realizar las anastomosis, tanto lineal como circular. En los casos de colectomía derecha la anastomosis fue latero-lateral y en los casos de colectomía izquierda, fue término-terminal.
Los casos de abordaje laparoscópico que fueron convertidos a laparotomía se consideraron dentro de abordaje convencional vía laparotomía.
El método empleado para determinar la PCR fue de inmunoturbidimetría potenciada por látex, con un analizador Roche/Hitachi Cobas c 501®. Se midió el valor de PCR en sangre posoperatorio en los días 1°, 3° y 5°, como parte de los controles clínicos del servicio.
Se definió FA como la salida de contenido purulento, intestinal o fecal, a través de herida quirúrgica, vía vesical, vía vaginal o por un dren dejado en la cavidad durante la cirugía, así como toda colección intraabdominal perianastomótica detectada por imágenes 2, que requiriera tratamiento quirúrgico urgente o no 16.
Recolección de datos y análisis estadístico
Se hizo revisión documental de las historias clínicas. Las variables continuas fueron expresadas mediante media y desviación estándar, mientras que las categóricas mediante frecuencia absoluta y relativa.
En el análisis de variables continuas se realizaron pruebas de normalidad y análisis con t de Student o pruebas no paramétricas según la distribución normal o no, y en las variables categóricas se utilizó la prueba de chi cuadrado. Se consideró un valor de p<0,05 como estadísticamente significativo.
Para el análisis de la PCR se midieron sensibilidad, especificidad, VPP y VPN. Se elaboró la curva ROC, determinándose el Área Bajo la Curva (ABC) y el índice de Youden, para establecer puntos de corte de valores de PCR 17. Se procesaron los datos con el programa IBM® SPSS® v22.
Resultados – Fuga Anastomótica en Cirugía Oncológica Colorrectal
Se estudiaron 270 casos intervenidos quirúrgicamente en el periodo de enero del 2019 a diciembre 2021; 225 casos no presentaron fuga anastomótica y 45 casos sí presentaron la complicación. Las variables socio demográficas y clínico quirúrgicas se resumen en la Tabla 1, donde se observa que sólo el nivel de albumina era diferente en pacientes que presentaron FA, en comparación con los pacientes que no la presentaron (p<0,0001).
Tabla 1. Variables sociodemográficas y clínico-quirúrgicas en pacientes de cirugía resectiva oncológica
curativa con anastomosis intestinal, Hospital E. Rebagliati M, 2019 – 2021.

Las variables edad, sexo, hemoglobina, abordaje y tipo de operación no tuvieron relación estadísticamente significativa con la presencia de FA (p>0,05).
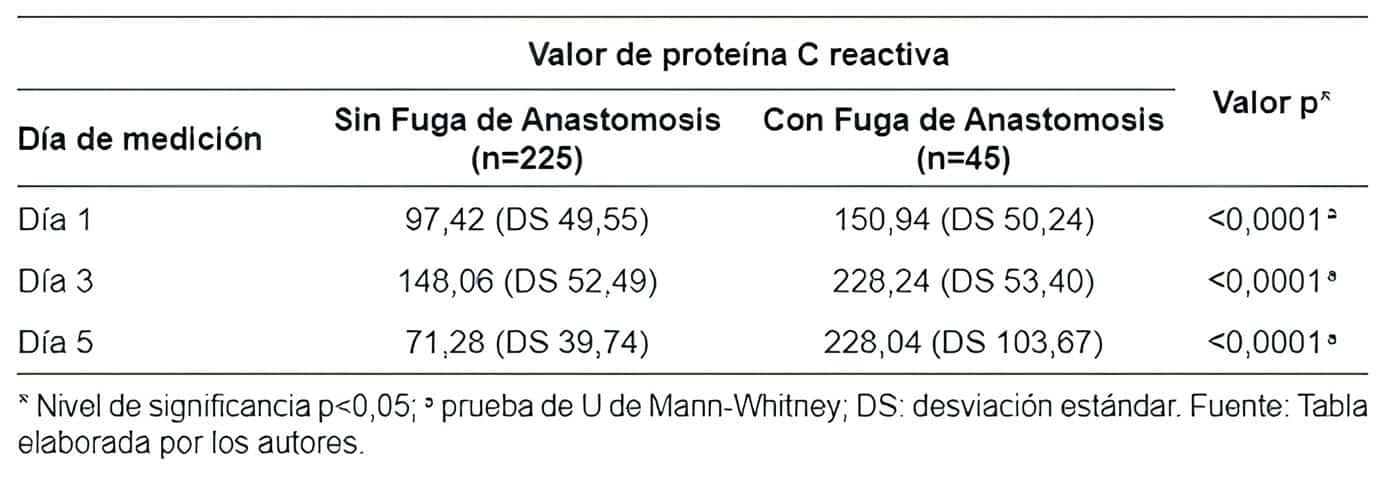
Los valores de PCR en los tres días de medición fueron más elevados en los casos de FA (Tabla 2).En los pacientes que no presentaron FA, el primer día posoperatorio el valor medio de PCR fue de 97,42 mg/l comparado con 150,94 mg/l en casos con esta complicación (p<0,0001).
Hacia el tercer y quinto día posoperatorios, los valores fueron más bajos en los pacientes que no presentaron la complicación (148,06 mg/l y 71,28 mg/l) en comparación con los casos de FA (228,24 mg/l y 228,04 mg/l), con una diferencia estadísticamente significativa (p<0,0001).
Tabla 2. Valores postoperatorios de PCR en pacientes con cirugía oncológica colorrectal, con y sin
fuga de la anastomosis. Hospital E. Rebagliati M, 2019-2021.
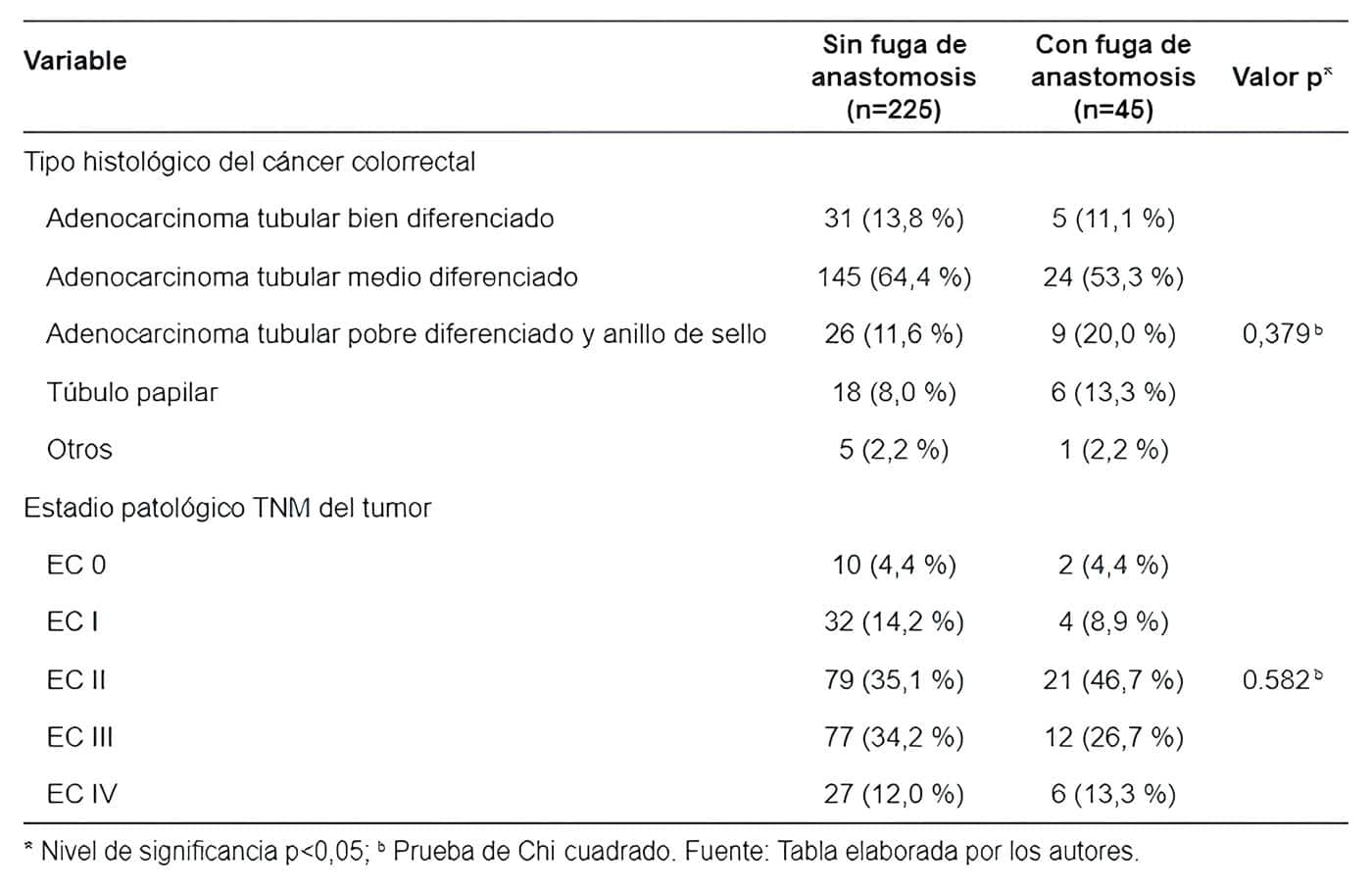
El tipo histológico más frecuente fue el adenocarcinoma tubular medio diferenciado (64,4 % en el grupo sin FA y 53,3 % en el grupo con FA), sin encontrar diferencias respecto al tipo histológico de tumor entre ambos grupos (p=0,379). El estadio patológico TNM más frecuente fue el estadio II en ambos grupos, con 35,1 % en el grupo sin FA y 46,7 % en el grupo con FA, según se aprecia en la Tabla 3.
Tabla 3. Tipo histológico y estadio patológico en pacientes con cirugía oncológica colorrectal,
con y sin fuga de la anastomosis. Hospital E. Rebagliati M, 2019-2021
Las complicaciones más frecuentes en el grupo de FA (Tabla 4) fueron retraso del vaciamiento gástrico (40 %), infección de sitio operatorio (15,6 %) e insuficiencia respiratoria (15,6 %), con valor de p<0,05. La necesidad de reoperación fue mayor en el grupo con FA (28,9 %), asociado a mayor mortalidad (22,2 %) y reingresos hospitalarios (17,8 %).
La estancia posquirúrgica fue significativamente más alta en el grupo de FA en comparación con los casos sin FA (23,4 días y 7,7 días, respectivamente; p<0,0001).
Tabla 4. Complicaciones en pacientes con cirugía oncológica colorrectal, con y sin fuga de la anastomosis.
Hospital E. Rebagliati M, 2019-2021.

Se construyó una curva ROC para cada una de las 3 mediciones realizadas de PCR (1º, 3º y 5º día), encontrando un ABC de 0,8, 0,86 y 0,93 respectivamente. Además, el valor de PCR al 5º día, para un punto de corte de 127 mg/l, tuvo mejor sensibilidad (84,4 %), especificidad (92,4 %), VPP (69,0 %) y VPN (96,7 %), detectando con mayor eficacia los pacientes con FA, en comparación con las mediciones al 1° y 3° día (Figura 1).

Figura 1. Áreas bajo la Curva (ABC, IC95%), puntos de corte, valores de sensibilidad (SENS) y especificidad (ESPEC), valores predictivos positivo (VPP) y negativo (VPN) de proteína C reactiva (PCR) en pacientes con fuga de la anastomosis posterior a cirugía oncológica colorrectal. Hospital E. Rebagliati M, 2019-2021. Fuente: Figura elaborada por los autores con los datos obtenidos en el servicio de cirugía colorrectal del Hospital E. Rebagliati Martins EsSalud, Lima, Perú.
Discusión – Fuga Anastomótica en Cirugía Oncológica Colorrectal
Fuga de la anastomosis
Durante los últimos dos siglos, la técnica de confección de una anastomosis intestinal ha sido estudiada y modificada extensamente.
Desde los primeros reportes de anastomosis intestinales exitosas, publicados en 1743 por Rarodohr 18, han habido múltiples avances y modificaciones en la técnica para prevenir la FA, describiéndose la técnica de invaginación de la serosa intestinal publicada por Lembert en 1826 10, los mejores resultados con el cierre en dos planos de sutura descrito por Czerny en 1880 18 y la importancia de la capa submucosa intestinal, descrita por Halsted en 1887, por ser la que proporciona la mayor parte de la resistencia a la tracción al ser rica en colágeno y tener mayor flujo sanguíneo.
Actualmente se considera está capa de la anatomía intestinal, la más importante para la correcta cicatrización de una anastomosis 19.
La tasa de complicaciones y mortalidad posoperatoria de la FA llevó a realizar varias investigaciones con el objetivo de lograr mejoras en la confección y seguridad de una anastomosis, identificándose como los factores más importantes una técnica meticulosa, un buen flujo sanguíneo y una anastomosis libre de tensión 20.
Además, con la aparición de nuevos y mejores materiales de sutura y el avance de la tecnología, se pasó de realizar anastomosis manuales al uso de suturas mecánicas 21, las cuales buscaban disminuir el tiempo quirúrgico y la incidencia de FA.
Mientras en la década de 1970 reportaban una incidencia entre 8-50 %, en la década de 1980 bajó a 13-30 % 22.
A pesar del conocimiento de los factores de riesgo y los avances en la técnica quirúrgica y materiales de sutura 23,24, la incidencia de FA aún se mantiene en un porcentaje alto, con una morbimortalidad asociada importante.
Actualmente se describe una prevalencia en general de fuga en cirugía colorrectal entre 1 y 19 %, siendo las anastomosis entero-entéricas las que tienen menor tasa de fuga (1-2 %) en comparación con las anastomosis Íleo- cólica (1-4 %), las colo-colónica (2-3 %), las colo-rectal y colo-anal (5-19 %) 25.
En cuanto a Latinoamérica, Pacheco MA, et al., en un estudio realizado en Colombia describieron una incidencia de FA de 10,8 %, con una mortalidad de 9,7 % y una estancia hospitalaria posquirúrgica mayor de 18 días 26.
En el Perú, la tasa de FA en cirugía electiva por cáncer colorrectal se han reportado entre el 6 y 18 %, con mortalidad de 3,6 a 5 % y estancia posoperatoria mayor de 14 días 27.
Nuestro estudio encontramos una incidencia general de 16 %, siendo más alta para colectomías izquierdas (24 %) y sigmoidectomías (17 %), con una mortalidad asociada a la FA de 22 %.
El retraso en el diagnóstico aumenta la mortalidad, describiéndose que un retraso de 2,5 días en la instauración de tratamiento específico para la FA aumenta de 24 a 39 % la tasa de mortalidad 4.
Además, en trabajos sobre shock séptico de causa quirúrgica se ha descrito que cada hora de atraso de inicio de tratamiento antibiótico, desde la instauración del shock, reduce 7,6 % la supervivencia 3.
Las primeras manifestaciones de la FA son inespecíficas y se confunden con patologías cardiovasculares o respiratorias, las cuales pueden ser explicadas en un inicio por el trauma anestésico quirúrgico, perdida sanguínea durante la cirugía o por transfusiones que desencadenan el síndrome de respuesta sistémica (SIRS). Esto hace pensar al cirujano en otros diagnósticos 11.
Las complicaciones asociadas a la FA son principalmente pulmonares, como efusión pleural, atelectasia (16,8 %) o neumonía (14 %), y cardíacas (14 %). Además, se han descrito fiebre mayor de 38ºC y retraso en el vaciamiento gástrico (67 %) 5,7.
Se ha reportado también infección de sitio operatorio (15 %), leucocitosis mayor de 10 × 109/L (72 %), peritonitis (20 %), falla multiorgánica por sepsis (16 %) e incremento de la estancia hospitalaria posquirúrgica de 35 ± 22 días 28.
Similar a lo publicado por otros autores 5,7, en nuestro estudio encontramos que la incidencia de insuficiencia respiratoria fue de 15,6 % en los casos que presentaron FA, con una diferencia estadísticamente significativa (p=0,003) comparado a los controles sin FA (3,1 %).
Otra complicación asociada con diferencia significativa (p=0,002), fue la infección del sitio operatorio, en un 15,6 % en los casos que presentaron la FA.
El retraso de vaciamiento gástrico, que es el signo más asociado a la FA:
Se presentó en nuestro estudio en 40 % de los casos con FA (p<0,001), con una media para su manifestación de 4,76 días (DE 3,98-5,5). Este puede ser un signo de alarma precoz respecto a la probable aparición de una FA, pero no es un signo exclusivo de una FA.
En este estudio, en los casos en que no se evidenció FA, se presentó retraso del vaciamiento gástrico en el 17 % de los pacientes, que requirieron reposo gástrico y sonda descompresiva entre 1 a 2 días, tras lo cual se resolvió el tránsito intestinal normal y continuó con una evolución favorable.
La presentación clínica evidente de la FA, manifestada por salida de contenido intestinalfecal a través de los drenajes o la herida quirúrgica, se detectó en promedio a los 7,6 días (DS 6,6-8,61).
Si bien se conocen más a fondo los factores de riesgo y disponemos de mejor tecnología para evaluar la perfusión sanguínea y la idoneidad de la anastomosis 12,22-24, la FA aún se presenta tras una cirugía resectiva colorrectal.
Como hasta el momento no se ha logrado evitar que la FA ocurra, la mejor estrategia para prevenir las complicaciones y muertes es reconocer la FA tempranamente, con el fin de brindar tratamiento oportuno, antes de que la sepsis progrese.
Proteína C reactiva
La PCR es producida principalmente en el hígado y es liberada en respuesta a la estimulación de citoquinas proinflamatorias, tales como la interleucina 6 y el factor de necrosis tumoral α. La función de este biomarcador es activar la vía del complemento y potenciar la fagocitosis de las células extrañas o dañadas 29,30.
La PCR inicia su elevacion a las 6 horas de aparición del estímulo inflamatorio, con pico máximo a las 72 horas, tiene una vida medía de 19 horas, no presenta variación circadiana y su concentración plasmática no se modifica con la ingestión de alimentos, además, tiene un rápido retorno a valores normales una vez resuelto el estímulo inflamatorio 16,31,32.
Debido a su rápida elevación y vida medía corta, la PCR es un marcador fiable, pero no específico, de la inflamación aguda.
En cirugía de colon y recto ha sido investigada por diversos autores 9,33-36, encontrando asociación entre la proteína C reactiva y la FA, por lo que se considera que la PCR es un predictor fiable de complicaciones sépticas, incluyendo FA, y recomiendan su uso en protocolos de mejora en cirugía con alta precoz, puesto que los valores bajos de este marcador en el seguimiento posoperatorio descartan FA y complicaciones, mostrando elevada sensibilidad y VPN, que puede llegar hasta el 100 % 36.
Similar a nuestro estudio donde los valores de PCR fueron más altos en los casos que presentaron FA:
En estudios retrospectivos de cirugía colorrectal 36,37, se ha reportado que los valores de PCR fueron más altos en pacientes que presentaron complicaciones intraabdominales, de 164,6 mg/l frente a 136,2 mg/l en los días 1 y 2 posoperatorios (p<0,05) y de 209,4 mg/l frente a 132,1 mg/l en los días 3 y 4 posoperatorios (p<0,0001).
El porcentaje de sensibilidad, especificidad y valores predictivos depende del punto de corte que se asigne a una prueba. En la literatura internacional 9,33,35,36,38 se ha descrito hacia el tercer día posoperatorio, para un valor de PCR mayor de 185 mg/l, una sensibilidad del 81 %, especificidad del 91 %, VPP del 45 % y VPN del 98 %; y en el quinto día posoperatorio, para un valor de PCR de 135 mg/l, una sensibilidad de 73 %, especificidad de 83 %, VPP de 20 % y VPN de 98 %, con un ABC de 0,85.
En nuestra investigación encontramos al tercer día posoperatorio, para un valor de corte de 197,5 mg/l, una sensibilidad de 77,8 %, especificidad de 86,2 % con VPP de 53 % y VPN de 95,1 %; y al quinto día posoperatorio, para un valor de PCR de 127,15 mg/l, una sensibilidad de 84,4 %, especificidad de 92,4 %, con VPP de 69,1 % y VPN de 96,7 %.
Por nuestros hallazgos, al igual que lo observado en otras publicaciones 9,33-36,38, la medición al tercer y quinto día posoperatorio, presenta mejor rendimiento diagnóstico, resaltando que la PCR es un buen predictor negativo de FA.
También observamos que la persistencia de valores elevados luego del tercer día posquirúrgico o en ascenso, se asocia a la presencia de complicaciones, similar a lo descrito en los otros trabajos.
Algunos autores 36,39 han reportado que valores de PCR por debajo de 100 mg/l se asocian con menor riesgo de complicaciones intraabdominales y reingreso a hospitalización, permitiendo tener altas más precoces, sin incremento de la morbimortalidad o reingresos.
Varios autores 9,15,36 indican que los valores de PCR al tercer día posquirúrgico entre 170 y 190 mg/l, y al quinto día posquirúrgico entre 100 y 140 mg/l, son los que muestran los mejores valores de sensibilidad, especificidad y VPN.
Los resultados obtenidos en nuestro trabajo para puntos de corte de PCR al tercer y quinto día posquirúrgicos, son similares a los resultados de otros estudios, por lo que consideramos que se podrían extrapolar los valores de corte encontrados en este estudio a otros centros a nivel nacional en el Perú, para favorecer la detección de FA en las instituciones más alejadas o que no tengan acceso a exámenes de imágenes y unidad de cuidados intensivos, como si lo tiene nuestro hospital.
Esto permitiría realizar un seguimiento más objetivo, con marcadores de laboratorio accesibles y de fácil disponibilidad, favoreciendo la toma de decisiones tempranas, antes de la aparición de sepsis severa y shock séptico, disminuyendo la morbimortalidad elevada por un diagnóstico tardío o una intervención quirúrgica inoportuna.
Si bien este estudio se realizó con pacientes oncológicos y de cirugía programada, los valores de PCR podrían también extrapolarse a casos de cirugías con anastomosis intestinal realizada de emergencia, tanto por patología benigna o neoplásica, permitiendo nuevamente que la evaluación del paciente sea más objetiva y no solo en base a la vigilancia clínica, con un seguimiento más preciso del paciente y la toma de decisión quirúrgica utilizando un marcador sensible y con alto valor predictivo.
Conclusiones – Fuga Anastomótica en Cirugía Oncológica Colorrectal
Los valores de la proteína C reactiva al tercer y quinto día postoperatorio, de 197,5 mg/l y 127,15 mg/l respectivamente, mostraron los mejores niveles de sensibilidad, especificidad y valor predictivo negativo, para detectar la fuga de la anastomosis, sirviendo como marcadores objetivos para hacer un diagnóstico precoz y decidir el manejo adecuado.
Los valores de proteína C reactiva mayores a 197,5 mg/l en el tercer día posquirúrgico, asociados a síntomas como el retraso del vaciamiento gástrico o la insuficiencia respiratoria, deberían alertarnos de la posible aparición de fuga de la anastomosis, requiriendo un monitoreo estricto de la aparición de signos de sepsis y una expectativa quirúrgica latente.
Valores por encima de 120 mg/l en el quinto día aún en un paciente con evolución aparentemente favorable, deberían alertarnos de posibles complicaciones, prefiriendo diferir el alta para observación y prevenir reingresos por complicaciones tardías.
Cumplimiento de normas éticas
Consentimiento informado: Por tratarse de un estudio de fuentes secundarias y que garantizó la confidencialidad de los datos obtenidos mediante la deidentificación de los pacientes, no requirió diligenciamiento de consentimiento informado.
Cumple las normas y estatutos de estudios de investigación de acuerdo con la Resolución 008430 de 1993 del Ministerio de Salud de Colombia.
El protocolo de investigación del presente estudio fue revisado por el Comité de Ética e investigación del Hospital E Rebagliati Martins Essalud Lima Perú, con carta de aprobación Nro. 1505-GRPR-ESSALUD-2022.
Conflicto de interés: los autores declararon no tener conflictos de interés.
Fuente de financiación: El trabajo fue autofinanciado en su totalidad con aportes de los autores.
Contribución de los autores
– Concepción y diseño del estudio: Hernán Daniel Pinares-Carrillo, Manuel Núñez-Vergara, David A. Ortega-Checa, Karla Vergel-Ramírez, Manuel Chilca-Alva.
– Adquisición de datos: Hernán Daniel Pinares-Carrillo, Karla Vergel-Ramírez.
– Análisis e interpretación de datos: Hernán Daniel Pinares-Carrillo, Manuel Chilca-Alva.
– Redacción del manuscrito: Hernán Daniel Pinares-Carrillo, Manuel Núñez-Vergara, David A. Ortega-Checa, Manuel Chilca-Alva.
– Revisión crítica: Hernán Daniel Pinares-Carrillo, Manuel Núñez-Vergara, David A. Ortega-Checa.
Referencias – Fuga Anastomótica en Cirugía Oncológica Colorrectal
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. noviembre de 2018;68:394-424. https://doi.org/10.3322/caac.21492
2. Peel AL, Taylor EW. Proposed definitions for the audit of postoperative infection: a discussion paper. Surgical Infection Study Group. Ann R Coll Surg Engl. 1991;73:385-8.
3. Rahbari NN, Weitz J, Hohenberger W, Heald RJ, Moran B, Ulrich A, et al. Definition and grading of anastomotic leakage following anterior resection of the rectum: A proposal by the International Study Group of Rectal Cancer. Surgery. 2010;147:339-51. https://doi.org/10.1016/j.surg.2009.10.012
4. Wang S, Liu J, Wang S, Zhao H, Ge S, Wang W. Adver-se effects of anastomotic leakage on local recurrence and survival after curative anterior resection for rectal cancer: A systematic review and meta-analysis. World J Surg. 2017;41:277-84. https://doi.org/10.1007/s00268-016-3761-1
5. Kube R, Mroczkowski P, Granowski D, Benedix F, Sahm M, Schmidt U, et al. Anastomotic leakage after colon cancer surgery: A predictor of significant morbidity and hospital mortality, and diminished tumour-free survival. Eur J Surg Oncol. 1 de febrero de 2010;36:120-4. https://doi.org/10.1016/j.ejso.2009.08.011
6. Gray M, Marland JRK, Murray AF, Argyle DJ, Potter MA. Predictive and diagnostic biomarkers of anastomotic leakage: A precision medicine approach for colorectal cancer patients. J Pers Med. 2021;11:471. https://doi.org/10.3390/jpm11060471
7. Doeksen A, Tanis PJ, Vrouenraets BC, Lanschot van JJB, Tets van WF. Factors determining delay in relaparo-tomy for anastomotic leakage after colorectal resection. World J Gastroenterol. 2007;13:3721-5. https://doi.org/10.3748/wjg.v13.i27.3721
8. Ashraf SQ, Burns EM, Jani A, Altman S, Young JD, Cun-ningham C, et al. The economic impact of anastomotic leakage after anterior resections in English NHS hospitals: are we adequately remunerating them? Colorectal Dis. 2013;15:e190-e198. https://doi.org/10.1111/codi.12125
Bibliografías – Fuga Anastomótica en Cirugía Oncológica Colorrectal
9. Garcia-Granero A, Frasson M, Flor-Lorente B, Blanco F, Puga R, Carratalá A, et al. Procalcitonin and C-reactive protein as early predictors of anastomotic leak in colorectal surgery: A prospective observational study. Dis Colon Rectum. 2013;56:475-83. https://doi.org/10.1097/DCR.0b013e31826ce825
10. Healey JE, Mc Bride CM, Gallager HS. Bowel anastomosis by inverting and everting techniques: An experimental study. J Surg Res. 1967;7:299-304. https://doi.org/10.1016/0022-4804(67)90069-8
11. Sutton CD, Marshall LJ, Williams N, Berry DP, Thomas WM, Kelly MJ. Colorectal anastomotic leakage often masquerades as a cardiac complication. Colorectal Dis. 2004;6:21-2. https://doi.org/10.1111/j.1463-1318.2004.00574.x
12. Komen N, De Bruin RWF, Kleinrensink GJ, Jeekel J, Lan-ge JF. Anastomotic leakage, the search for a reliable biomarker. A review of the literature. Colorectal Dis. 2008;10:109-15. https://doi.org/10.1111/j.1463-1318.2007.01430.x
13. Karliczek A, Harlaar NJ, Zeebregts CJ, Wiggers T, Baas PC, van Dam GM. Surgeons lack predictive accuracy for anastomotic leakage in gastrointestinal surgery. Int J Colorectal Dis. 2009;24:569-76. https://doi.org/10.1007/s00384-009-0658-6
14. Daams F, Wu Z, Lahaye MJ, Jeekel J, Lange JF. Prediction and diagnosis of colorectal anastomotic leakage: A systematic review of literature. World J Gastrointest Surg. 2014;6:14-26. https://doi.org/10.4240/wjgs.v6.i2.14
15. Singh PP, Zeng ISL, Srinivasa S, Lemanu DP, Connolly AB, Hill AG. Systematic review and meta-analysis of use of serum C-reactive protein levels to predict anastomotic leak after colorectal surgery. Br J Surg. 2014;101:339-46. https://doi.org/10.1002/bjs.9354
16. Clavien PA, Barkun J, de Oliveira ML, Vauthey JN, Dindo D, Schulick RD, et al. The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg. 2009;250:187-96. https://doi.org/10.1097/SLA.0b013e3181b13ca2
Lecturas Recomendadas – Fuga Anastomótica en Cirugía Oncológica Colorrectal
17. Vizcaíno-Salazar GJ. Importancia del cálculo de la sensi-bilidad, la especificidad y otros parámetros estadísticos en el uso de las pruebas de diagnóstico clínico y de laboratorio. Med Lab. 2017;23:365-86. https://doi.org/10.36384/01232576.34
18. Hendriks T, Mastboom WJB. Healing of experimental intestinal anastomoses. Parameters for repair. Dis Co-lon Rectum. 1990;33:891-901. https://doi.org/10.1007/BF02051930
19. Ho YH, Ashour MAT. Techniques for colorectal anasto-mosis. World J Gastroenterol. 2010;16:1610-21. https://doi.org/10.3748/wjg.v16.i13.1610
20. Kirk RM, Winslet MC. Essential general surgical ope-rations. London: The Churchill Livingstone imprint of Elsevier Health Sciences; 2007. 430 p.
21. Ballantyne GH. The experimental basis of intestinal su-turing: Effect of surgical technique, inflammation, and infection on enteric wound healing. Dis Colon Rectum. 1984;27:61-71. https://doi.org/10.1007/BF02554084
22. Fielding LP, Stewart-Brown S, Blesovsky L, Kearney G. Anastomotic integrity after operations for large-bowel cancer: a multicentre study. Br Med J. 1980;281:411-4. https://doi.org/10.1136/bmj.281.6237.411
23. Blanco-Colino R, Espin-Basany E. Intraoperative use of ICG fluorescence imaging to reduce the risk of anasto-motic leakage in colorectal surgery: a systematic review and meta-analysis. Tech Coloproctology. 2018;22:15-23. https://doi.org/10.1007/s10151-017-1731-8
24. Lam A, Fleischer B, Alverdy J. The biology of anasto-motic healing—the unknown overwhelms the known. J Gastrointest Surg. 2020;24:2160-6. https://doi.org/10.1007/s11605-020-04680-w
Fuentes Bibliográficas – Fuga Anastomótica en Cirugía Oncológica Colorrectal
25. McDermott FD, Heeney A, Kelly ME, Steele RJ, Carlson GL, Winter DC. Systematic review of preoperative, in-traoperative and postoperative risk factors for colo-rectal anastomotic leaks. Br J Surg. 2015;102:462-79. https://doi.org/10.1002/bjs.9697
26. Pacheco MA, Aldana GE, Martínez LE, Forero JC, Gómez CA, Coral EM, et al. Incidencia de falla anastomótica en intestino delgado, colon y recto, Bogotá, Colombia. Rev Colomb Cir. 2017;32:269-76. https://doi.org/10.30944/20117582.34
27. Ortega-Checa D, Vojvodic-Hernandez IM, Pinares-Ca-rrillo D. Resultados de la aplicación del Protocolo de Recuperación Mejorada en Cirugía (PREMEC) en el tratamiento quirúrgico del cáncer colorrectal en el Hospital Nacional Edgardo Rebagliati – EsSalud. Rev Gastroenterol Perú. 2020;40:252-9. http://dx.doi.org/10.47892/rgp.2020.403.1125
28. Turrentine FE, Denlinger CE, Simpson VB, Garwood RA, Guerlain S, Agrawal A, et al. Morbidity, mortality, cost, and survival estimates of gastrointestinal anastomo-tic leaks. J Am Coll Surg. 2015;220:195-206. https://doi.org/10.1016/j.jamcollsurg.2014.11.002
29. Volanakis JE. Human C-reactive protein: expression, structure, and function. Mol Immunol. 2001;38:189-97. https://doi.org/10.1016/s0161-5890(01)00042-6
30. Mold C, Rodic-Polic B, Du Clos TW. Protection from Streptococcus pneumoniae infection by C-reactive pro-tein and natural antibody requires complement but not Fcγ receptors. J Immunol. 2002;168:6375-81. https://doi.org/10.4049/jimmunol.168.12.6375
31. Pathak A, Agrawal A. Evolution of C-reactive protein. Front Immunol. 2019;10:943. https://doi.org/10.3389/fimmu.2019.00943
32. Manfredi AA, Rovere-Querini P, Bottazzi B, Garlanda C, Mantovani A. Pentraxins, humoral innate immunity and tissue injury. Curr Opin Immunol. 2008;20:538-44. https://doi.org/10.1016/j.coi.2008.05.004
Reseñas Bibliográficas – Fuga Anastomótica en Cirugía Oncológica Colorrectal
33. Guevara-Morales GR, Regalado-Torres MA, Cantare-ll-Castillo E, Castro-Salas R, Maldonado-Barrón R, Cas-tellanos-Juárez JC. Utilidad de la proteína C reactiva en el diagnóstico oportuno de fuga de anastomosis en cirugía colorrectal. Cir Cir. 2018;86:432-6. https://doi.org/10.24875/CIRU.18000261
34. Ramos-Fernández M, Rivas-Ruiz F, Fernández-López A, Loinaz-Segurola C, Fernández-Cebrián JM, de la Portilla de Juan F. Proteína C reactiva como predictor de fuga anastomótica en cirugía colorrectal. Comparación en-tre cirugía abierta y laparoscópica. Cirugía Española. 2017;95:529-35. https://doi.org/10.1016/j.ciresp.2017.08.003
35. Yeung DE, Peterknecht E, Hajibandeh S, Hajibandeh S, Torrance AW. C-reactive protein can predict anastomo-tic leak in colorectal surgery: a systematic review and meta-analysis. Int J Colorectal Dis. 2021;36:1147-62. https://doi.org/10.1007/s00384-021-03854-5
36. Benoit O, Faron M, Margot N, Creavin B, Debove C, Ti-ret E, et al. C-reactive protein values after colorectal resection: Can we discharge a patient with a c-reactive protein value >100? A retrospective cohort study. Dis Colon Rectum. 2019;62:88-96. https://doi.org/10.1097/DCR.0000000000001216
37. Paliogiannis P, Deidda S, Maslyankov S, Paycheva T, Fa-rag A, Mashhour A, et al. C reactive protein to albumin ratio (CAR) as predictor of anastomotic leakage in co-lorectal surgery. Surg Oncol. 2021;38:101621. https://doi.org/10.1016/j.suronc.2021.101621
38. Paradis T, Zorigtbaatar A, Trepanier M, Fiore JF, Fried GM, Feldman LS, et al. Meta-analysis of the diagnostic accuracy of C-reactive protein for infectious complica-tions in laparoscopic versus open colorectal surgery. J Gastrointest Surg. 2020;24:1392-401. https://doi.org/10.1007/s11605-020-04599-2
39. Waterland P, Ng J, Jones A, Broadley G, Nicol D, Patel H, et al. Using CRP to predict anastomotic leakage after open and laparoscopic colorectal surgery: is there a difference? Int J Colorectal Dis. 2016;31:861-8. https://doi.org/10.1007/s00384-016-2547-0
Autores – Fuga Anastomótica en Cirugía Oncológica Colorrectal
1 Hernán Daniel Pinares-Carrillo, Médico asistente, Servicio de Cirugía de Colon y Recto, Departamento de Cirugía General y Digestiva, Hospital Nacional Edgardo Rebagliati Martins – EsSalud, Lima, Perú.
2 David Ortega-Checa, MD., FACS, especialista en Cirugía General, Departamento de Cirugía General y Digestiva, Hospital Nacional Edgardo Rebagliati Martins – EsSalud; profesor, Universidad de San Martín de Porras, Lima, Perú.
3 Karla Vergel-Ramírez, Médica, asistente Servicio de Cirugía general, Departamento de Cirugía General y Digestiva, Hospital Carlos Alcántara Butterfield- EsSalud, Lima, Perú.
4 Manuel Luis Chilca-Alva, Licenciado en Estadística e Informática; profesor contratado, Universidad de Lima, Lima, Perú.
5 Manuel Núñez-Vergara, Médico, profesor asociado, Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
Fecha de recibido: 26/10/2022 – Fecha de aceptación: 24/12/2022 – Publicación en línea: 03/02/2023
Correspondencia: Hernán Daniel Pinares-Carrillo, Av. Brasil 1055 Jesús María, Lima, Perú. Teléfono +51 987865458.
Dirección electrónica: dr.danielpinares@gmail.com
Citar como: Pinares-Carrillo HD, Ortega-Checa D, Vergel-Ramírez K, Chilca-Alva ML, Núñez-Vergara M. Proteína C reactiva como biomarcador predictivo de fuga anastomótica en cirugía oncológica colorrectal: estudio de cohorte retrospectivo. Rev Colomb Cir. 2023;38:289-99. https://doi.org/10.30944/2011758.2269
Este es un artículo de acceso abierto bajo una Licencia Creative Commons – BY-NC-ND https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es