Según su vinculación al sistema de salud, 65 (61,3 %) pacientes pertenecían al régimen subsidiado, 32 (30,2 %) eran del régimen contributivo y 9 (8,5 %) no tenían ningún tipo de afiliación.
Según las guías de Tokio de 2013 39, 71 pacientes presentaban colecistitis grave (67 %), 25, colangitis aguda de grado II (23,6 %) y, 10, colangitis aguda de grado III (9,4 %). Las disfunciones orgánicas más frecuentes fueron la cardiovascular y la renal (10,3 %), seguidas de la neurológica (9,4 %), la pulmonar (8,4 %), la hematológica (7,4 %) y la hepática (6,6 %).
El tiempo entre la aparición de los síntomas y la consulta, fue menor de 24 horas en 13 (12,2 %) pacientes, de 24 a 72 horas en 26 (24,5 %), de 72 horas a una semana en 33 (31,1 %) y de más de una semana en 34 (34,1 %). En los pacientes con alguno de los dos cultivos positivos, no hubo diferencia significativa al comparar la gravedad y la duración de los síntomas (p=0,320).
Se practicó colecistectomía laparoscópica en 55 (51,9 %) pacientes, colecistectomía más colangiopancreatografía retrógrada endoscópica en 19 (17,9 %), colecistectomía abierta en 18 (17 %) y colangiopancreatografía retrógrada endoscópica en 14 (13,2 %). En todos los casos se practicó colecistostomía y se dejó drenaje por 15 días, aproximadamente. Los tiempos máximo y mínimo de cirugía fueron de 135 y 17 minutos, respectivamente, con una media de 67 minutos. El tiempo medio de estancia hospitalaria fue de 7 días, con un rango de 2 a 32 días.
Todos los pacientes recibieron antibióticos por vía intravenosa, antes y después de la cirugía. Los esquemas de antibióticos prequirúrgicos, fueron: 2 g de ceftriaxona más 500 mg de metronidazol, en 35 (33 %) pacientes; 3 g de ampicilina más sulbactam, en 50 (47,2 %); 2 g de cefalotina, en 18 (17 %); 600 mg de clindamicina más 1 g de aztreonam, en 2 (1,9 %), y 4,5 g de piperacilina más tazobactam, en 1 (0,9 %). Los esquemas posquirúrgicos fueron: 2 g de ceftriaxona más 500 mg de metronidazol, en 43 (40,6 %) pacientes; 3 g de ampicilina más sulbactam, en 53 (50 %); 1 g de meropenem, en 2 (1,9 %), y 4,5 g de piperacilina más tazobactam, en 4 (3,8 %). La duración del tratamiento antibiótico fue: menor de 72 horas en 22 (20,8 %) pacientes, de 72 horas a una semana, en 41 (38,7 %), y de más de una semana, en 43 (40,6 %).
Al analizar las muestras de laboratorio, se encontró que 52 (49,1 %) cultivos de bilis y 21 (19,7 %) hemocultivos fueron positivos, en la población de estudio. Al comparar el resultado positivo de los cultivos en los casos de colangitis aguda de grado III, de disfunción orgánica o de ambas, con el de los otros grupos, se encontró una diferencia estadísticamente significativa en los de bilis (p=0,01) y en los de sangre (p=0,04).
Los microorganismos aislados en los dos tipos de cultivo fueron similares y sus resultados se muestran en la tabla 1. El 86 % de los microorganismos aislados fueron Gram negativos y el 14 % Gram positivos. Los perfiles de sensibilidad y resistencia antibiótica de los microorganismos aislados más frecuentemente, permitieron evaluar los mecanismos de resistencia propuestos según la clasificación de Ambler para las betalactamasas. Escherichia coli (3 de 19 cultivos, 15,7 %) y Citrobacter spp. (1 de 4 cultivos, 25 %) expresaron formación de penicilinasas; al exponerlos al inhibidor piperacilina más tazobactam, solo E. coli persistió resistente, lo quese conoce como betalactamasa resistente al inhibidor (inhibitor-resistant TEM mutant), o sea, clase A de Ambler (tabla 2).
De igual manera, se evaluó la presencia de betalactamasa de espectro extendido (BLEE) y se encontró que Klebsiella spp. (4 de 12 cultivos, 33 %) presentó características clase A de la clasificación Ambler y Enterobacter spp. (1 de 6 cultivos, 16 %) manifestó características de la clase A y C.
Durante el periodo de estudio, fallecieron cuatro (3,8 %) pacientes. No se encontró asociación significativa entre la gravedad de los síntomas (p=0,53), su duración (p=0,56), el tiempo entre el diagnóstico y la cirugía (p=0,64) o el tipo de cirugía (p=0,14), y la mortalidad.
Discusión
Las características de nuestra población son similares a las encontradas por otros autores, en cuanto a que la infección biliar es más frecuente en mujeres alrededor de los 60 años 7,20,27,33,35,40-42; sin embargo, difiere un poco con los estudios de Goo y de Schneider sobre resistencia antibiótica en casos de colangitis, en los cuales hubo predominio del sexo masculino en 53 % y 65 %, respectivamente 43,44.
Tabla 1.
Microorganismos aislados en cultivos de bilis y sangre de pacientes con colecistitis grave o colangitis aguda, Hospital Universitario San José, 2013-2014
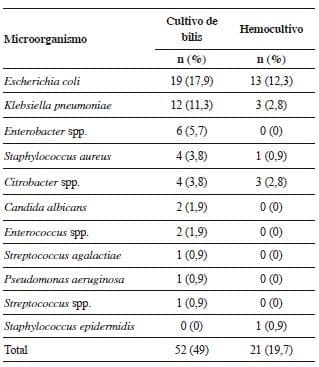
En múltiples estudios, los cultivos positivos de sangre y de bilis fueron más frecuentes (60 a 100 %) (33,44-47) que en el presente (hemocultivo, 49,1 %, y bilis, 19,7 %), aunque, en otros, estos porcentajes fueron similares, como en el de Plata, que reportó 44 % de cultivos positivos 28. Estos resultados pueden relacionarse con las características propias de la población o con la falta de medios de cultivos para gérmenes anaerobios. Sin embargo, hubo coincidencia en los microorganismos aislados más frecuentes, en su orden, E. coli, K. pneumoniae y Streptococcus spp. 20,27,28,33,43.44.
El espectro de resistencia antibiótica encontrado es muy variado al comparar los hallazgos de este estudio con los de otros autores. Se han reportado tasas de resistencia de E. coli de 100 % y 6 % para ampicilina 20,43, de 38 % y 4 % para ceftriaxona 28,43, y de 19 % y 56 % para ciprofloxacina 28,43; y de K. pneumoniae, de 100 % y 5 % para ceftriaxona 28,43, y de 100 % y 15 % para ciprofloxacino 28,43.
Tabla 2.
Sensibilidad antibiótica, pacientes con colecistitis grave o colangitis aguda, Hospital Universitario San José, 2013-2014 Sen: sensible: Int: intermedio; Res: resistente
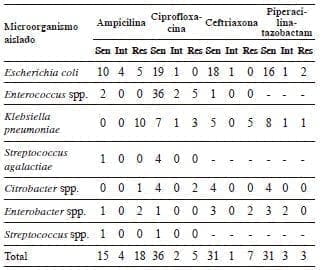
Igualmente, los mecanismos de resistencia son similares a los reportados: se encuentran bacterias productoras de penicilinasas, como E. coli y Citrobacter spp., y otras productoras de BLEE, como Klebsiella spp. y Enterobacter spp.. Esto sugiere que se debe tener precaución al formular ampicilina como antibiótico de primera línea, profiláctico y posquirúrgico 44.
Contrario a lo descrito por Elwodd y Castro 35,41, cuyos pacientes consultaron en los primeros cinco días de presentación de los síntomas, este estudio mostró que, en el departamento del Cauca, el tiempo de consulta supera la semana; esto podría deberse al gran porcentaje de población rural implicada. Llama la atención, que a pesar de esto, la mortalidad de la población estudiada (3,8 %) fue ligeramente inferior a la reportada por Losada, et al., en 2009 (5,6 %) 27; aunque no se encontró ningún factor asociado a este evento, pudo deberse al tratamiento antibiótico empleado y a la intervención quirúrgica realizada.
Es de resaltar la variabilidad en los esquemas antimicrobianos y su duración en el Hospital Universitario San José, los cuales dependen del criterio médico, el tipo de cirugía, los antibióticos previos y la evolución clínica del paciente. Esto incentivó la realización de este estudio, pues puede ser uno de los principales factores que pueden afectar la sensibilidad de los microorganismos.
Dada la diversidad de agentes etiológicos implicados, la guía de Tokio de 2013 39 enfatiza un tratamiento inicial dirigido según los datos epidemiológicos locales sobre la flora microbiana más prevalente. En casos de colecistitis grave, se consideran los esquemas de ampicilina más sulbactam (no se recomienda con sensibilidad menor de 80 %), de cefalosporina más metronidazol, y de ertapenem o fluoroquinolona más metronidazol; en casos de colangitis aguda de grado II o I II, se consideran los de piperacilina más tazobactam, de cefalosporina más metronidazol, y de carbapenémicos o fluoroquinolona más metronidazol. Cuando se practica colangiopancreatografía retrógrada endoscópica, se usan los esquemas de cefalotina, y de cefoxitin o piperacilina más tazobactam.
Por otro lado, sobre la duración del tratamiento, la guía es clara en expresar que solo en infecciones complicadas se deben administrar los antibióticos de 4 a 7 días o hasta por dos semanas, pues, si se practica colecistectomía se controla la fuente de infección y, si el paciente está afebril, se puede limitar a un periodo de 24 horas.
Como lo mencionó Schneider 43, el tratamiento antibiótico inicial es empírico y los fármacos deben individualizarse según las características de cada paciente, el procedimiento quirúrgico y los hallazgos perioperatorios, para optimizar los resultados en el periodo posquirúrgico; esto justificaría tener diversas opciones de tratamiento y aplicarlas según el caso y el criterio del médico tratante.
A pesar esto, se espera que los resultados de este estudio ayuden a reconocer la importancia de los cultivos para determinar el agente causal, la de estandarizar los esquemas según la epidemiología microbiana local y la de continuar trabajando en la concienciación de los médicos y especialistas en el uso racional y apropiado de los antibióticos, para contribuir, así, en la contención de la resistencia de los microorganismos a los diferentes fármacos.
Limitaciones y recomendaciones del estudio
Una de las limitaciones de este estudio fue el no hacer cultivo para gérmenes anaerobios, debido a dificultades técnicas del laboratorio de la institución.
En futuras investigaciones se espera contar con un tamaño muestral mayor y, de ser posible, hacer cultivos para gérmenes anaerobios, así como evaluar la evolución después del egreso hospitalario de los pacientes.
Etiology and antibiotic sensitivity in acute cholangitis
Abstract
Introduction: Abdominal pain is a common presentation at out patient and emergency service in Cauca, Colombia, it is the fifth leading cause of consultation and hospitalization. Infections of the bile duct are a significant cause of bacteremia and high mortality, hence the importance of establishing an early and appropriate antibiotic therapy. We sought to describe the most frequently isolated bacteria in cultures of bile and blood cultures of patients with acute cholecystitis and / or cholangitis University Hospital San José from, Popayán, Colombia. December 2013 to December 2014 and know their profile sensitivity or resistance to antibiotics.
Materials and methods: This was a descriptive, cross-sectional study in patients with acute cholangitis and acute cholecystitis at University Hospital San José, in the period December 2013 to December 2014. Bile cultures and blood cultures were taken and antibiotic sensitivity tests were performed.
Results: Of a total of 106 patients, positive bile cultures were positive in 49.1% and blood cultures were studied in 19% of patients. Most isolates were: Escherichia coli (51.42%), Klebsiella pneumoniae (17%) and other Gram-positive organisms.
Discussion: The results of this and other studies show that despite sharing the causative agent of infection in the bile duct, the identification of such organisms by laboratory testing and antibiotic susceptibility varies considerably, which may be associated with place of residence, the type of antibiotic therapy used regularly at each hospital and the duration of such treatment.
Key words: cholecystitis; cholangitis; bile; bacteria; culture media; microbial sensitivity tests.
Referencias
1. Telfer S, Fenyö G, Holt PR, de Dombal FT. Acute abdominal pain in patients over 50 years of age. Scand J Gastroenterol Suppl. 1988;144:47-50.
2. Eskelinen M, Ikonen J, Lipponen P. Contributions of historytaking, physical examination, and computer assistance to diagnosis of acute small-bowel obstruction. A prospective study of 1333 patients with acute abdominal pain. Scand J Gastroenterol. 1994;29:715-21.
3. Serrano M, Cadena H, Contreras L, Villar L, Reyes W. Abdomen agudo. ASCOFAME, Guías de práctica clínica basadas en la evidencia. Bogotá: Editorial Carrera Séptima; 1998.
4. Patiño JF. Lecciones de cirugía. Editorial Médica Panamericana; 2000. p. 8-14.
5. Filen W. Dolor abdominal. En: Kasper D, Fauci A, editores. Harrison’s Principios de Medicina Interna. 16ª edición. Santiago de Chile: Editorial McGraw Hill; 2006. p. 95-8.
6. Lee JG. Diagnosis and management of acute cholangitis. Nat Rev Gastroenterol Hepatol. 2009;6:533-41.
7. Bejarano M, Gallego CX, Gómez JR. Frecuencia de abdomen agudo quirúrgico en pacientes que consultan al servicio de urgencias. Rev Colomb Cir. 2011;26:33-41.
8. Secretaria Departamental de Salud del Cauca. ASIS – Departamento del Cauca [Internet]. 2012. Fecha de consulta: 30 de julio de 2015. Disponible en: https://www.minsalud.gov.co/plandecenal/mapa/analisis-de-situacion-salud-cauca-2011.pdf.
9. García Ayala E, Rodríguez Rangel DA, Prada Ascencio NE.
Hallazgos patológicos en colecistectomías realizadas en el Hospital Universitario Ramón González Valencia de Bucaramanga entre 1999 y 2002. Salud UIS. 2006;38:108-13.
10. Indar AA, Beckingham IJ. Acute cholecystitis. BMJ. 2002;325:639-43.
11. Balows A, Hansler W, Hermann K, Isenberg H, Shadonny HJ. Manual of clinical microbiology. Washington, D.C.: ASM Press; 1999. p. 451-6.
12. Angarita FA, Acuña SA, Jiménez C, Garay J, Gómez D, Domínguez LC. Colecistitis calculosa aguda. Revista Univérsitas Médica Bogotá. 2010;51:301-19.
13. Claesson B, Holmlund D, Mätzsch T. Biliary microflora in acute cholecystitis and the clinical implications. Acta Chir Scand. 1984;150:229-37.
14. Bjorvatn B. Cholecystitis–etiology and treatment—microbiological aspects. Scand J Gastroenterol Suppl. 1984;90:65-70.
15. Prévôt L, Bresler L, Muller C, Boissel P, Grosdidier J. Bacteriological aspects of acute cholangitis with gallstones. Presse Med. 1991;20:689-91.
16. Sung JY, Costerton JW, Shaffer EA. Defense system in the biliary tract against bacterial infection. Dig Dis Sci. 1992;37:689-96.
17. Scott-Conner CE, Grogan JB. The pathophysiology of biliary obstruction and its effect on phagocytic and immune function. J Surg Res. 1994;57:316-36.
18. Csendes A, Mitru N, Maluenda F, Diaz JC, Burdiles P, Csendes P, et al. Counts of bacteria and pyocites of choledochal bile in controls and in patients with gallstones or common bile duct stones with or without acute cholangitis. Hepatogastroenterol. 1996;43:800-6.
19. Hanau LH, Steigbigel NH. Acute (ascending) cholangitis. Infect Dis Clin North Am. 2000;14:521-46.
20. Hernández-Sánchez J, Díaz-Araujo F, Osorio-Morales S. Identificación de flora bacteriana en cultivos de bilis de pacientes sometidos a cirugía biliar. Kasmera. 2002;30:63-73.
21. Chang WT, Lee KT, Wang SR, Chuang SC, Kuo KK, Chen JS, et al. Bacteriology and antimicrobial susceptibility in biliary tract disease: an audit of 10-year’s experience. Kaohsiung J Med Sci. 2002;18:221-8.
22. Flores C, Maguilnik I, Hadlich E, Goldani LZ. Microbiology of choledochal bile in patients with choledocholithiasis admitted to a tertiary hospital. J Gastroenterol Hepatol. 2003;18:333-6.
23. Qureshi WA. Approach to the patient who has suspected acute bacterial cholangitis. Gastroenterol Clin North Am. 2006;35:409-23.
24. Munford RS. Severe sepsis and septic shock: the role of gramnegative bacteremia. Annu Rev Pathol. 2006;1:467-96.
25. Tanaka A, Takada T, Kawarada Y, Nimura Y, Yoshida M, Miura F, et al. Antimicrobial therapy for acute cholangitis: Tokyo Guidelines. J Hepatobiliary Pancreat Surg. 2007;14:59-67.
26. Kinney TP. Management of ascending cholangitis. Gastrointest Endosc Clin North Am. 2007;17:289-306.
27. Losada H, Manterola C, Pineda V, Vial M, Avendaño L. Asociación entre recuento bacteriano en la bilis y desarrollo de morbilidad postoperatoria en pacientes con colangitis aguda. Rev Chil Cir. 2009;61:142-7.
28. Plata-Castelo LY. Identificación de flora bacteriana en cultivos de bilis de pacientes sometidos a cirugía biliar. La Paz, Bolivia: Universidad Mayor de San Andrés; 2009.
29. Abe R, Oda S, Sadahiro T, Nakamura M, Hirayama Y, Tateishi Y, et al. Gram-negative bacteremia induces greater magnitude of inflammatory response than Gram-positive bacteremia. Crit Care. 2010;14:R27.
30. Kwon W, Jang JY, Kim E-C, Park JW, Han IW, Kang MJ, et al. Changing trend in bile microbiology and antibiotic susceptibilities: over 12 years of experience. Infection. 2013;41:93-102.
31. van Erpecum KJ. Gallstone disease. Complications of bile-duct stones: Acute cholangitis and pancreatitis. Best Pract Res Clin Gastroenterol. 2006;20:1139-52.
32. Attasaranya S, Fogel EL, Lehman GA. Choledocholithiasis, ascending cholangitis, and gallstone pancreatitis. Med Clin North Am. 2008;92:925-60.
33. Boey JH, Way LW. Acute cholangitis. Ann Surg. 1980;191:264-70.
34. Kimura Y, Takada T, Kawarada Y, Nimura Y, Hirata K, Sekimoto M, et al. Definitions, pathophysiology, and epidemiology of acute cholangitis and cholecystitis: Tokyo Guidelines. J Hepatobiliary Pancreat Surg. 2007;14:15-26.
35. Elwood DR. Cholecystitis. Surg Clin North Am. 2008;88:1241-52.
36. Almirante B, Pigrau C. Acute cholangitis. Enferm Infecc Microbiol Clin. 2010;28(Suppl.2):18-24.
37. van Lent AU, Bartelsman JF, Tytgat GN, Speelman P, Prins JM. Duration of antibiotic therapy for cholangitis after successful endoscopic drainage of the biliary tract. Gastrointest Endosc. 2002;55:518-22.
38. Bornman PC, van Beljon JI, Krige JE. Management of cholangitis. J Hepatobiliary Pancreat Surg. 2003;10:406-14.
39. Takada T, Strasberg SM, Solomkin JS, Pitt HA, Gomi H, Yoshida M, et al. TG13: Updated Tokyo Guidelines for the management of acute cholangitis and cholecystitis. J Hepatobiliary Pancreat Sci. 2013;20:1-7.
40. Strasberg SM. Acute calculous cholecystitis. N Engl J Med. 2008;358:2804-11.
41. Castro F, Galindo J, Bejarano M. Complicaciones de colecistitis aguda en pacientes operados de urgencia. Rev Colomb Cir. 2008;23:16-21.
42. Núñez LA, Muñiz M, Muñoz R, Rodríguez U, García J, Pérez R. Flora bacteriana en bilis de pacientes con colangitis aguda del Servicio de Cirugía General del Hospital Juárez de México. Rev Hosp Jua Mex. 2007;74:167-73.
43. Schneider J, De Waha P, Hapfelmeier A, Feihl S, Römmler F, Schlag C, et al. Risk factors for increased antimicrobial resistance: a retrospective analysis of 309 acute cholangitis episodes. J Antimicrob Chemother. 2014;69:519-25.
44. Goo JC, Seong MH, Shim YK, Lee HS, Han J-H, Shin KS, et al. Extended spectrum β-lactamase or carbapenemase producing bacteria isolated from patients with acute cholangitis. Clin Endosc. 2012;45:155-60.
45. Heo JH, Lee JH, Lee MY, Shin KC, Chang HS, Song SH, et al. Bacterial identification in bile and blood of patients with acute cholangitis from benign and malignant bile duct obstruction. Korean J Gastroenterol. 2002;40:53-9.
46. Bae WK, Moon YS, Kim JH, Lee SH, Kim NH, Kim KA, et al. Microbiologic study of the bile culture and antimicrobial susceptibility in patients with biliary tract infection. Korean J Gastroenterol. 2008;51:248-54.
47. Flisfisch H, Heredia A. Colangitis aguda: Revisión de aspectos fundamentales. Revista Medicina y Humanidades. 2011; 3:39-44.
Correspondencia:
Ángela María Merchán-Galvis, MD,
Correo electrónico:
angelamerchan@unicauca.edu.co
Popayán, Colombia
