Durante el período del estudio se incluyeron 548 pacientes fueron hospitalizados en nuestro centro de trauma con el diagnóstico de exanguinación, basado en los criterios de inclusión. Hubo 484 (88%) hombres y 64 (12%) mujeres, con una edad media de 30±13 años (rango, 9 a 94). El 82% (449 pacientes) sufrieron traumatismos penetrantes: 352 (78%) heridas por arma de fuego, 88 (20%) por arma blanca y 9 (2%) heridas por escopeta. Además, hubo 99 (18%) casos por traumatismo cerrado: 52 (53%) pacientes por colisiones de tránsito, 36 (36%) lesiones por atropellamiento, 6 (6%) agresiones agravadas, y 5 (5%) caídas de gran altura.
En la valoración prehospitalaria, presentaron una presión arterial sistólica media de 40±46 mm Hg (rango, 40 a 180) y una frecuencia cardíaca media de 87±49 latidos por minuto (rango, 20 a 200). Los datos del examen físico prehospitalario incluyeron 124 (31%) pacientes con pupilas no reactivas, 105 (24%) no presentaban movimientos respiratorios, en 96 (23%) no se palpaba el pulso carotídeo, 342 (80%) pacientes tenían una presión arterial sistólica menor de 90 mm Hg, y 80 (22%) presentaban un ritmo cardíaco no sinusal. Además, 102 (27%) pacientes requirieron maniobras de reanimación cardiopulmonar antes de su llegada al servicio de urgencias, y 226 (50%) requirieron intubación, ya sea en el lugar del accidente o a su llegada a urgencias. En el momento de la hospitalización, la presión arterial media fue de 63±54 mm Hg (rango, 30 a 198); la frecuencia cardíaca media fue de 78±55 latidos por minuto (rango, 18 a 180), y el volumen medio de reanimación en el servicio de urgencias fue un poco mayor a 2.500 ml (valor medio de cristaloides=2.009±1.507 ml, y concentrado de hematíes = 513±787 ml).
El valor medio del índice revisado de trauma (RTS) fue de 4,38±3,31, y el del índice de gravedad de las lesiones (ISS) fue de 32±20. En 257 (57%) pacientes el valor inicial del pH fue de 7,15 (rango, 6,56 a 7,55).
En 180 (33%) pacientes se consideró necesaria la toracotomía de urgencia con oclusión de la aorta torácica y reanimación cardiopulmonar abierta, de los cuales 99 (55%) fallecieron en urgencias, y 81 (45%) pacientes llegaron con vida al quirófano, los cuales, sumados a los 117 pacientes que requirieron toracotomía en la sala de operaciones, representan un total de 198 pacientes que requirieron toracotomía, ya sea en el servicio de urgencias o en quirófano, y de los cuales 56 (28%) sobrevivieron y fueron dados de alta.
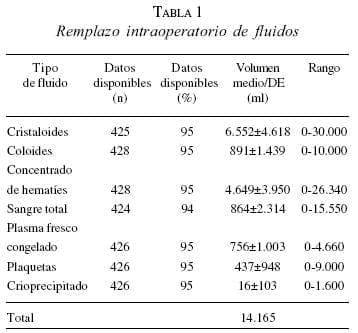
Los valores iniciales del pH en el quirófano en 304 (68%) pacientes revelaron valores medios de 7,15 (rango, 6,56 a 7,55). La temperatura media en 290 (65%) pacientes fue de 34,3°C (rango, 28 a 39,2). Todos los pacientes fueron sometidos a control de las lesiones o se intentó hacerlo. El pH más bajo encontrado fue de 6,65 y la temperatura más baja fue de 30,5°C. El valor de otras mediciones que se relacionaron con la supervivencia incluyeron un volumen medio de cristaloides infundidos de 6.552+4.618 ml (rango, 0 a 30.000), y reanimación con concentrados de hematíes de 4.649+3.950 ml (rango, 0 a 26.340). Para la reanimación de los pacientes que llegaron al quirófano se utilizaron cristaloides, coloides, sangre y productos derivados con un valor medio de 14.165 ml (tabla 1).
En la primera fase del análisis estadístico (mortalidad en urgencias), se identificaron como factores pronóstico los signos vitales y la condición fisiológica durante la admisión al servicio de urgencias (p<0,001), RTS, el índice de coma de Glasgow (Glasgow coma scale, GCS), ISS de 20 ó menor, y sin necesidad de toracotomía de emergencia (p<0,001). Los pacientes que presentaban lesiones cardíacas y torácicas, especialmente aquéllos con lesiones del parénquima y vasos pulmonares (p<0,001), con lesiones vasculares abdominales (p=0,002) y con lesiones renales y de la vasculatura renal (p=0,038), fueron los que tuvieron mayor probabilidad de fallecer en el servicio de urgencias.
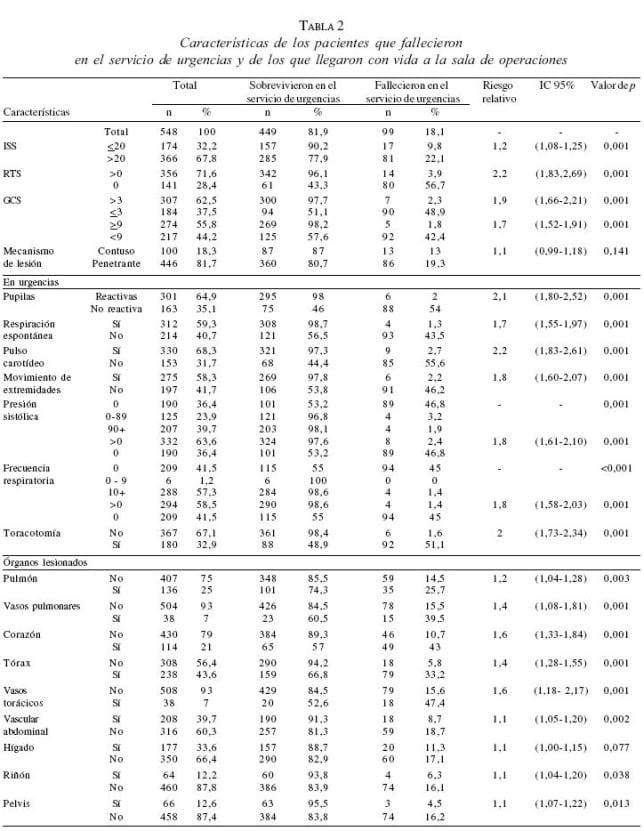
ISS: índice de severidad de lesiones; RTS: índice de trauma revisado; GCS: índice de coma de Glasgow
El análisis de regresión logística identificó los siguientes factores independientes de buen pronóstico antes de llegar al quirófano: presencia de traumatismo penetrante, presencia de respiración espontánea y sin necesidad de toracotomía de urgencia en el servicio de urgencias. En presencia de estos tres factores, la posibilidad de supervivencia fue del 0,996. En el quirófano se registró un pH medio de 7,15 (rango, 6,56 a 7,55) y una temperatura media de 34,3°C (rango, 28 a 39,2). Hemos encontrado una correlación entre la temperatura corporal y la mortalidad, ya que fallecieron el 100% de los pacientes en los que se registró una temperatura corporal menor de 31°C.
En la segunda fase del análisis estadístico (fallecidos vs. supervivientes de los pacientes que llegaron con vida al quirófano), observamos que los parámetros fisiológicos a su llegada al servicio de urgencias tienen un gran significado pronóstico, así como el que no haya necesidad de toracotomía en el quirófano (p<0,001), mientras que los pacientes con lesiones vasculares torácicas (p<0,001) o abdominales (p<0,001) y los que desarrollaron complicaciones intraoperatorias como coagulopatía (p<0,001; riesgo relativo (RR)=3,8, e intervalo de confianza [IC] de 95%: 1,98 – 7,46) o arritmias (p<0,001; RR=19, e IC 95%: 7,19 – 50) tuvieron mayor mortalidad.
El análisis de regresión logística identificó los siguientes factores pronósticos independientes de supervivencia: ISS menor de 20, presencia de respiración espontánea en el servicio de urgencias, reanimación con menos de 4.000 ml de concentrados de hematíes, ausencia de necesidad de toracotomía de urgencia, y ausencia de lesiones vasculares abdominales. La mortalidad global fue de 69% (379 fallecidos del total de 548 pacientes). Si excluimos a los 99 enfermos que fallecieron en urgencias, obtenemos un valor de mortalidad ajustada de 62,3% (281 fallecidos de 449 pacientes).
Discusión
Hay poca información en la literatura que establezca con exactitud la incidencia de exanguinación y hay todavía menos datos sobre las lesiones que presentan mayor tendencia a producir este síndrome. La incidencia del síndrome de exanguinación se puede estimar analizando datos indirectos, como el porcentaje de pacientes que llegan al servicio de urgencias con criterios de choque hipovolémico clase IV, según el manual Advanced Trauma Life Support (4) o mediante los datos de algunos estudios de series de autopsias, adecuadamente realizados.
Además del clásico estudio de Trunkey (6) en el que demuestra que hasta el 50% de las muertes por trauma en la población civil ocurre en la primera hora y se debe a lesiones de exanguinación o a lesiones del sistema nervioso central, y que otro 30% ocurre entre la segunda y tercera hora y se debe a hemorragias internas graves; existen múltiples estudios (7, 8) que han corroborado esos datos, tanto en la población civil como en la militar. En una extensa revisión de la literatura (1, 5, 9) se encontró que las lesiones cardíacas, de grandes vasos y del hígado son las principales causantes de exanguinación. Las lesiones arteriales que pueden producirla son las de la aorta torácica y sus ramas principales, aorta abdominal y arteria mesentérica superior. La vena cava inferior, ya sea en su porciones infrarrenal, suprarrenal o retrohepática, y la vena porta son las estructuras venosas cuyas lesiones conllevan mayor riesgo de exanguinación.
Dada la rápida velocidad de pérdida del volumen sanguíneo, la intervención quirúrgica temprana ofrece las mayores posibilidades de supervivencia al paciente. Por lo tanto, son de máxima importancia las maniobras de reanimación, con una rápida reposición del volumen circulatorio perdido, y el control rápido y eficaz de la hemorragia. En la figura 1 se muestra el algoritmo utilizado en Los Ángeles County and University of Southern California Medical Center para el manejo del paciente politraumatizado con hemorragia y riesgo de exanguinación.

FIGURA 1. Algoritmo de tratamiento de la exsanguinación.
Entre las maniobras de reanimación, la venoclisis adecuada es prioritaria, aunque en presencia de choque hipovolémico y de colapso generalizado, es difícil de practicar. Lo deseable es la colocación de dos catéteres venosos de gran calibre en las extremidades superiores, pero cuando no es posible, debe considerarse la venoclisis en otros sitios de acceso como las venas subclavia, yugular o femoral. Nuestra preferencia es la canalización percutánea de la vena femoral, salvo ante la sospecha de lesiones de grandes vasos venosos intraabdominales, en cuyo caso recomendamos la venoclisis en las extremidades superiores. El uso de catéteres cortos de gran calibre y con diámetro grande, el uso de los sistemas de infusión rápida y el uso de presión para aumentar el flujo son los pilares de la rápida reposición del volumen circulatorio perdido.
La solución de elección es la solución de lactato de Ringer. Esta práctica ha sido convalidada en diversos estudios (10-13), incluso un metaanálisis de ensayos clínicos aleatorios (14). Esta solución cristaloide tiene un Ph medio de 6,5 y contiene lactato el cual, al ser metabolizado a bicarbonato, contribuye a neutralizar la acidosis metabólica producida por la hipoperfusión. Además, su concentración de electrolitos es muy similar a la del líquido intersticial, mientras que la solución salina posee un pH medio de 5, lo que puede provocar una acidosis hiperclorémica.
Mientras que la masa hemática disminuye rápidamente al 50% durante las pérdidas sanguíneas, el plasma se reduce sólo en 35%, debido a que el volumen extracelular es utilizado para remplazar el volumen intravascular perdido (12, 15). Shires (16) demostró que para que la reanimación sea adecuada, se deben reponer no sólo las pérdidas del volumen intravascular, sino también las pérdidas de volumen intersticial. En ello se basa el concepto de la reposición sanguínea utilizando la regla del 3 por 1 (3 ml de cristaloides por cada ml de sangre perdida) desarrollado por Pruitt y sus colaboradores en 1965 (17).
Dado que el objetivo de la reanimación es la adecuada perfusión tisular y el adecuado intercambio celular de oxígeno, en estos pacientes con hemorragias importantes, es necesaria la transfusión de sangre para garantizar el aporte de oxígeno. Nuestro protocolo incluye la transfusión sanguínea inmediata en aquellos enfermos en los que no se ha obtenido respuesta tras un primer bolo de 2 litros de solución de lactato de Ringer o si se estima una hemorragia igual o mayor del 40% de la volemia. Inicialmente, utilizamos sangre del grupo 0 Rh (+) y continuamos con la sangre compatible que se comienza a administrar en cuanto esté disponible, lo que suele demorar alrededor de 30 minutos. En los casos de mujeres en edad fértil, empleamos preferentemente sangre del grupo 0 Rh (-).
Sin embargo, el remplazo agresivo del volumen, imprescindible para evitar los efectos del choque hipovolémico, tiene sus efectos negativos, como la hipotermia, que puede dar lugar a arritmias cardíacas potencialmente letales y disfunción plaquetaria, la coagulopatía por hemodilución y de consumo, y la acidosis producida por el metabolismo anaerobio secundario a la hipoperfusión tisular. Con el conocimiento del círculo vicioso de la acidosis, la hipotermia y la coagulopatía, Stone (18) propuso un nuevo planteamiento quirúrgico, que luego fue perfeccionado por Rotondo (19), denominado “cirugía para el control de lesiones” (damage control). Consiste en el rápido control quirúrgico de las lesiones sangrantes y de aquéllas que producen contaminación, la finalización precoz de la laparotomía con traslado inmediato a la unidad de cuidados intensivos, difiriendo la reparación de las lesiones para una segunda fase en la que la hipotermia, la coagulopatía, la acidosis y la hipoperfusión se hayan corregido.
El momento de terminar la cirugía y optar por una técnica de control de lesiones se define para la mayoría de los cirujanos como la observación intraoperatoria de un sangrado por coagulopatía de consumo; sin embargo, cuando la coagulopatía ya está presente quizá sea demasiado tarde. Nuestro propósito fue identificar marcadores que indicaran la necesidad de una laparotomía abreviada para el control de las lesiones, antes de que el paciente hubiera entrado ya en ese círculo vicioso. Cosgriff y Moore (20) propusieron un modelo de predicción de mortalidad que incluye el ISS igual o mayor de 25, una presión arterial sistólica igual o menor de 70 mm Hg, un pH menor de 7,1 y una temperatura menor de 34ºC. Además, otros autores han identificado como indicadores, la transfusión de 25 concentrados de hematíes (21), tiempo de protrombina mayor de 16, tiempo de tromboplastina mayor de 50 (22), y choque hipovolémico por más de 70 minutos (23).
La propuesta basada en estudios prospectivos realizados por nuestro grupo (9) consiste en la monitorización intraoperatoria de las necesidades de volumen y de parámetros fisiológicos e indicar la cirugía abreviada cuando:
• se requieran más de 4 litros de concentrados de hematíes;
• se transfunda una combinación de hematíes y sangre total mayor de 5 litros;
• el volumen total de fluidos administrado supere los 12 litros;
• pH menor de 7,2;
• temperatura menor de 34ºC;
• o una pérdida sanguínea estimada mayor de 5.000 ml.
La laparotomía abreviada para el control de los daños exige el adecuado control de las lesiones con sangrado activo o de aquéllas que produzcan contaminación.
Una vez se haya comprobado que no hay una estructura vascular responsable que pudiera empeorar el círculo vicioso (23), se realiza el empaquetamiento de los lechos sangrantes. Igualmente, es fundamental limitar la contaminación que es un factor desencadenante de sepsis y de síndrome de respuesta inflamatoria sistémica, para lo cual es necesario el cierre rápido o la resección con suturas mecánicas de los segmentos de vísceras huecas con perforaciones, de los tramos intestinales inviables (24) y el adecuado drenaje del páncreas cuando esté lesionado (9).
Finalmente, se debe cerrar la cavidad abdominal, para lo cual se han descrito múltiples alternativas. Se inicia la aproximación de la piel y, si ello genera empeoramiento de la función respiratoria o hemodinámica del paciente, o se presentan signos del síndrome de compartimiento abdominal, se deja la laparotomía abierta. En estos casos es necesario cubrir las vísceras con una bolsa estéril de 2 litros de suero salino (también llamada bolsa de Bogotá) suturada a los bordes de la piel y un gran apósito adhesivo por encima, que lo deje adecuadamente sellado para disminuir la contaminación.
La técnica de la cirugía de control de daños, pionera en el concepto y la más comúnmente utilizada, es el empaquetamiento hepático, el cual fue descrito por Pringle para el tratamiento de las lesiones hepáticas complejas (25), de las cuales, aproximadamente, el 5% requiere el uso de esta técnica. Las indicaciones actuales incluyen las hemorragias que no son coercibles con otras medidas y en las que se considera que el sangrado es secundario al círculo vicioso de acidosis, hipotermia y coagulopatía (26).
La segunda parte en el manejo de estos pacientes después de una cirugía, ya sea abreviada o completa, es su manejo en la unidad de cuidados intensivos. Quienes sobreviven a una cirugía mayor por lesiones con exanguinación, ingresan en dicha unidad con inestabilidad hemodinámica extrema y la mayoría se encuentran en el círculo vicioso de hipotermia, acidosis y coagulopatía, por lo que es necesario continuar con una reanimación agresiva. Generalmente, este tipo de pacientes se encuentran intubados y con asistencia respiratoria mecánica, y pueden necesitar de agentes vasoactivos en el camino entre el quirófano y la unidad de cuidados intensivos. Se trata de un grupo de pacientes con altísimo riesgo y con secuelas de choque muy importantes, y muchos de ellos habrán entrado ya en el camino hacia la falla multiorgánica. Requieren monitorización invasiva, corrección de la hipotermia, recuperación del volumen circulatorio, corrección de la acidosis y restablecimiento de una adecuada perfusión tisular.
La hipotermia, definida como una temperatura corporal central menor de 35ºC, es una complicación prácticamente constante en estos pacientes (27). En nuestra serie, la temperatura media fue de 34,2ºC (rango, 28 a 39,2). Hay múltiples factores que contribuyen a producir hipotermia, como la exposición a ambientes fríos, tanto en el área de reanimación como en el quirófano, la reposición de cristaloides a temperatura ambiente, la transfusión de sangre almacenada a 4ºC, la presencia de más de una cavidad abierta simultáneamente y la hemorragia masiva. La prevención comienza desde el servicio de urgencias, donde se debe cubrir al enfermo con mantas calientes e iniciar la transfusión con cristaloides y sangre tibios. Es recomendable el uso de los sistemas de infusión rápida desde este momento y durante todo el proceso, en el quirófano y en la unidad de cuidados intensivos. En el quirófano se deben colocar vendas en las extremidades inferiores y cubrir toda la superficie corporal que sea posible con un cobertor de aire caliente. Además, es conveniente irrigar regularmente las cavidades expuestas con suero salino caliente y mantener la temperatura ambiente en 29ºC. El éxito está relacionado con el tiempo que se emplee en controlar la hemorragia con exanguinación y en restaurar el volumen circulatorio. En nuestra serie, hemos observado una mortalidad del 100% para aquellos pacientes con una temperatura corporal menor de 31ºC.
La coagulopatía28 es otra complicación frecuente con orígenes multifactoriales, pues depende de la acidosis, de la trombocitopenia por hemodilución (que es directamente proporcional al número de unidades transfundidas) y de la disfunción plaquetaria secundaria a la hipotermia y a la disminución de los factores de la coagulación. Se aconseja realizar la transfusión de plasma fresco congelado y plaquetas a temperaturas por encima de los 34ºC, ya que esto mejora la actividad de ambos (29, 30). También, disminuye la concentración y la actividad del fibrinógeno, por lo que debe considerarse su administración. Nuestra práctica habitual se centra en iniciar la transfusión de plasma fresco congelado después de haber transfundido 10 unidades de sangre, administrando 30 ml por kg de peso hasta que los tiempos de coagulación y las plaquetas se normalicen. Se debe administrar crioprecipitado cuando los niveles de fibrinógeno estén por debajo de 200 mg/dl o cuando se hayan transfundido más de 15 unidades de sangre.
La tercera fase de este planteamiento terapéutico consiste en una nueva laparotomía para revisión, el retiro del empaquetamiento y la reparación definitiva de las lesiones que así lo requieran. En la actualidad, sigue en discusión el momento adecuado para esta nueva intervención quirúrgica. Por un lado, es necesario diferir la nueva laparotomía hasta que se haya completado la reanimación del enfermo y la acidosis, y la hipotermia y la coagulopatía estén adecuadamente corregidas, lo que con un correcto manejo en la unidad de cuidados intensivos debe obtenerse en un plazo de 24 a 48 horas (23).
Por otro lado, es conveniente realizar la nueva exploración lo antes posible, ya que múltiples series han demostrado que el empaquetamiento prolongado, especialmente mayor de 72 horas, aumenta significativamente el número de abscesos intraabdominales y otras complicaciones (31). También está indicada una nueva laparotomía precoz en los casos en los que se sospeche la persistencia del sangrado o aparezca el síndrome de compartimiento abdominal (24).
En resumen, podemos concluir que la exanguinación es una entidad clínica mal definida, pero de gran importancia y que requiere un pensamiento rápido y una actitud quirúrgica agresiva, enmarcados dentro de un plan de actuación establecido con anticipación, para obtener buenos resultados. El tratamiento debe ir dirigido al control de la hemorragia que causa la exanguinación, seguido de una cuidadosa monitorización y reanimación en la unidad de cuidados intensivos (32). La supervivencia de estos enfermos puede estimarse por algunos signos clínicos y parámetros fisiológicos, que son los que deben gobernar la toma de decisiones.
Factors predicting institution of damage control in the exanguination syndrome
Abstract
Background: The objectives of this study were to investigate the relationship between survival and patient characteristics, such as vital signs, mechanisms of injury, and management, as well as to determine if levels of pH, temperature, and blood loss can predict survival.
Materials and methods: A retrospective 72-month-study performed at Los Angeles County and University of Southern California Medical Center, including patients with diagnosis of exsanguination. Inclusion criteria: intraoperative blood loss of >2,000 ml, transfusion of packed red blood cells of >1,500 ml during the resuscitation period. Exclusion criteria: patients younger than 18 years old. Other information collected included age, gender, mechanisms of injury, vital signs on arrival, presence of spontaneous respiration, pulse, movements of the extremities, electrical cardiac activity, need of orotracheal intubation and cardiopulmonar resuscitation. Injury Severity Score (ISS), Revised Trauma Score (RTS), and Glasgow Coma Scale (GCS) were also recorded. Analysis was made in two phases: -death vs. survival in Emergency Department (ED), and death vs. survival in operating room (OR). Analysis was performed using t-Student test.
Results: 548 patients were identified. Penetrating injuries: 82% vs. blunt injuries: 18%. Vital signs in ED: mean systolic blood pressure 63±54 mm Hg (range: 30-198), mean heart rate 78±55 beats per minute (range: 18-180). Mean RTS: 4,38; mean ISS 32. Mean OR pH 7.15, and temperature 34.3°C. Mortality was 69% (379 out of 548). Analysis phase 1: Logistic regression. Independent risk factors for survival – penetrating trauma, spontaneous ventilation, and no ED thoracotomy (p<0.001). Analysis phase 2: Logistic regression. Independent risk factors for survival: ISS<20, spontaneous ventilation in ED, OR packed red blood cells replacement < 4,000 ml, no ED or OR thoracotomy, and absence of abdominal vascular injury (p<0.001).
Conclusions: Survival rates can be predicted in this patient population. Damage control should be instituted following these guidelines.
Key words: keywords: surgical blood loss, hemorrhage, laparotomy, guideline, wounds and injuries, survival
Referencias
1. ASENSIO JA. Exsanguination from penetrating injuries. Trauma quirúrgico 1990;6:1-25.
2. ANDERSON KA. Pre-hospital care in traumatically induced hemorrhage and exsanguination. J Emerg Nurs. 1984;10:141.
3. TRUNKEY DD. Trauma. Sci Am. 1983;249:28-35.
4. American College of Surgeons-Committee on Trauma. Advanced Trauma Life Support instructor manual. Chicago: American College of Surgeons; 1997.
5. ASENSIO JA, CHAHWAN S, HANPETER D, et al. Operative management and outcome of 302 abdominal vascular injuries. Am J Surg. 2000;180:528-34.
6. TRUNKEY DD, BLAISDELL FW (eds.). Abdominal trauma: trauma management. New York: Thieme and Stratton; 1982.
7. BAKER CC, OPPENHEIMER L, STEPHENS V, et al. Epidemiology of trauma deaths. Am J Surg. 1980;140:144-50.
8. TRUNKEY DD, LIM RC: Analysis of 425 consecutive trauma fatalities: An autopsy study. J Am Coll Emerg Phys. 1974;368- 71.
9. ASENSIO JA, MCDUFFIE L, PETRONE P, et al. Reliable variables in the exsanguinated patient which indicate damage control and predict outcome. Am J Surg. 2001;182:743-81.
10. CAREY LD, LOWERY BD, CLOUTIER CT. Hemorrhagic shock. Curr Prob Surg. 1971;8:1048.
11. LOBETT WM, WANGENSTEEN SL, GLENN TM, et al. Presence of myocardial depressant factor in patients with circulatory shock. Surgery. 1981;70:223.
12. LUCAS CE, LEDGERWOOD AM. The fluid problem in the critically ill: Symposium on Critical Illness. Surgical Clin North Am. 1993;63:439-54.
13. TRAVERSO LE, LEE WP, LANGFORD MJ. Fluid resuscitation after an otherwise fatal hemorrhage: crystalloid solutions. J Trauma. 1986;26:168-75.
14. VELANOVICH V. Crystalloid Vs. colloid resuscitation: a metaanalysis of mortality. Surgery. 1989;105:65-71.
15. LUCAS CE, BENISHEK DJ, LEDGERWOOD AM. A proposed mechanism for reduced pressure after shock. Arch Surg. 1982;117:675-9.
16. SHIRES GT, CANNIZARO PC. Fluid resuscitation in the severely injured. Surg Clin North Am. 1973;53:1341-66.
17. PRUITT BA, MONCRIEF J, MASON AD. Effect of buffered saline solution upon blood volume of man in acute hemorrhage: annual research progress report. San Antonio: Institute of Surgical Research; 1965.
18. STONE HH, STROM PR, MULLINS RJ. Management of the major coagulopathy with onset during laparotomy. Ann Surg. 1983;197:532-5.
19. ROTONDO MF, SCHWAB CW, MCDONIGAL MD, et al. Damage contro: an approach for improved survival in exsanguinating penetrating abdominal injury. J Trauma. 1993;35:375-83.
20. COSGRIFF N, MOORE EE, SAUAIA A, et al. Predicting life-threatening coagulopathy in the massively transfused trauma patient: hypothermia and acidosis revisited. J Trauma. 1997;4:857-62.
21. PHILLIPS TF, JOULIER G, WILSON RF. Outcome of massive transfusion exceeding two blood volumes in trauma surgery. J Trauma. 1987;27:903-10.
22. SHARP KW, LOCICERO RJ. Abdominal packing for surgically uncontrollable hemorrhage. Ann Surg. 1992;215:467-75.
23. SHAPIRO MB, JENKINS DH, SCHWAB CW, ROTONDO MF. Damage control: collective review. J Trauma. 2000;49:969-78.
24. MOORE EE. Staged laparotomy for the hypothermia, acidosis and coagulopathy syndrome. Am J Surg. 1996;172:405-10.
25. PRINGLE JH. Notes on the arrest of hepatic hemorrhage due to trauma. Ann Surg. 1908;48:541-9.
26. CARMONA RH, PECK D, LIM RC Jr. The role of packing and planned reoperation in severe hepatic trauma. J Trauma. 1984;24:779-
27. LUNA GK, MARER RV, PAVLIN EG, et al. Incidence and effect of hypothermia in severely injured patients. J Trauma. 1987;27:1014-8.
28. CLAGGETT GP, OLSEN WR. Non-mechanical hemorrhage in severe liver injury. Ann Surg. 1978;187:369-74.
29. MARTIN D, LUCAS C, LEDGERWOOD A, et al. Fresh frozen plasma supplement to massive red blood cell transfusion. Ann Surg. 1985;202:505-11.
30. REED R, CIAVARELLA D, HEIMBACH D, et al. Prophylactic platelet administration during massive transfusion. Ann Surg. 1986;203:40-8.
31. ABIKHALED JA, GRANCHI TS, WALL MJ, et al. Prolonged abdominal packing for trauma is associated with increased morbidity and mortality. Am Surg. 1997;63:1109-13.
32. PETRONE P, KARSIDAG T, ASENSIO JA. Lesión exsanguinante en trauma grave. En: Quesada Suescún A, Rabanal Llevot JM (editores). Actualización en el manejo de trauma grave. Primera edición. Madrid, España: Editorial Ergon; 2006. p.141-51.
