Enfoque Actual Presentación de Seis Casos
MANUEL SANTIAGO MOSQUERA PAZ, MD*; AKRAM KADAMANI ABIYOMA, MD**; GABRIEL SÁNCHEZ DE GUZMÁN, MD***; LUIS JAIME TÉLLEZ, MD****; ENRIQUE PONCE DE LEÓN, MD*****; ADRIANA VARÓN, MD*****; JUAN MANUEL PÉREZ, MD******; CLAUDIA VARÓN, MD*******; ALIRIO ZULUAGA, MD; JULIÁN RIVERA, MD*******; JACQUELINE MUGNIER, MD********
Palabras clave: tumores estromales gastrointestinales, inmunohistoquímica, 50 campos de alto poder, hemorragia de vías digestivas, tomografía computarizada, c-Kit, CD34, actina de músculo liso.
Resumen
Se presentan seis pacientes con diagnóstico inmuno-histoquímico de tumores estromales gastrointestinales y extragastrointestinales localizados en diferentes ór-ganos del tracto digestivo y otras áreas, estudiados e intervenidos en nuestra institución a partir del año 2000, con seguimiento en su evolución clínica hasta la fecha por los servicios de hemato- oncología y cirugía; a ex-cepción de una paciente. En su mayoría sin diagnósti-co claro en su preoperatorio o con alta sospecha de presentar tumores mesenquimales complicados por masa compresiva, oclusión intestinal o sangrado.
Se plantean de manera concreta los aspectos rele-vantes en su diagnóstico y clasificación patológi-ca, manejo quirúrgico y tratamiento en relación a la literatura actual, exponiendo algunas de las con-troversias existentes. Además de fijar nuestra posición como grupo terapéutico frente a esta neoplasia, con base en la revisión realizada y nuestra limitada experiencia.
Introducción
El término tumor estromal gastrointestinal fue descrito por Mazur y Clark en 1983 para explicar las neoplasias gastrointestinales no epiteliales que semejaban aspec-tos inmunohistoquímicos de las células de Schwann, sin tener la característica ultra estructural de las células del músculo liso (1) . Hirota y colaboradores, en 1998, descubrieron actividad en la mutación del protooncogen c-Kit (CD117) de los TEGI, situación crucial en el ori-gen y clasificación de los mismos (2).
Recientemente se postuló el origen de los TEGI en las células intersticiales de Cajal (células marcapaso), o células precursoras que cumplen una importante fun-ción en la motilidad intestinal (3-7) .* Cirugía General, Gastrointestinal, Endoscopia Digestiva. Ser-vicio de Cirugía General y Especialidades. Fundación Cardio Infantil Instituto de Cardiología, Bogotá, Colombia.
El protooncogen c-Kit (CD117) es un receptor transmembrana para el factor de crecimiento de las células de Stem. Está codificado por el protoncogen c-Kit localizado en el cromosoma 4q11-21. Posee sec-tores intra y extracelulares e intramembranosos, al li-garse el factor del crecimiento con el receptor, se produce dimerización del segundo y activación de la tirosina cinasa en el sector intracelular, produciendo reacciones en cascada que controlan la proliferación, adhesión y diferenciación celular (8) . La expresión del antígeno CD 117 se manifiesta en casi todos los TEGI (90%) (9) y está sujeto a mutaciones en un 50% de los casos, otro de los mecanismos de activación del re-ceptor (10-12) .
Aunque el antígeno CD117 se expresa en otro tipo de tumores como: dermatofibrosarcoma protuberan-te, sarcoma sinovial, linfoma anaplásico de células grandes, glioma, germinoma, melanoma, leucemia mieloide aguda, mastocitoma, carcinoma pulmonar de células pequeñas, neuroblastoma, carcinoma adenoide quístico, angiosarcoma y sarcoma de Ewing (13-17) , no se generan confusiones diagnósticas debido a su dife-rente morfología y localización.
Los TEGI son la forma más común de aparición de los tumores mesenquimales del aparato digestivo (80%) también se presentan en el epiplón, mesente-rio o retroperitoneo (18-19) . conocidos como tumores estromales extragastrointestinales (19) . La incidencia anual estimada es de 10 a 20 casos por millón, de los cuales 20 a 30% son malignos (15, 21,22) . Se presentan con igual frecuencia en ambos sexos, en una edad promedio de 60 años, en ocasiones por debajo de los 40 años y son extremadamente raros en niños (15, 21) . Su localización más frecuente es en él estomago (40- 70%) (23) . luego el intestino delgado (20-40%), se-guido de colon y recto (5-15%) (24) , esófago (<5%), omento (<5%), mesenterio y retroperitoneon (15, 24-27) . En general, los tumores gástricos tienen mejor sobrevida que los de intestino delgado con igual ta-maño y actividad mitótica (28, 29) ; dentro de éstos los tumores duodenales mayores de 4,5 cm con dos o más mitosis por 50 campos de alto poder (CAP) y los yeyunoileales mayores a 5 cm y con cinco mito-sis o más por 50 CAP y necrosis de coagulación, evo-lucionan estadísticamente con mal pronóstico (30-32) .En recto los tumores mayores de 5 cm y con más de cinco mitosis por 50 CAP muestran un comporta-miento agresivo (33) . Los tumores estromales del omento aparecen menos agresivos que los mesentéricos (34) . Además del tamaño y recuento mitótico, se han estudiado otros factores pronósticos como celularidad y atipia nuclear, invasión muscu-lar, ulceración, diferenciación de marcadores inmunohistoquímicos (positividad para CD34 o expre-sión de actina del músculo liso) y positividad nuclear para análogos del Ki67 en un porcentaje mayor al 10%, lo cual sugiere mayor incidencia de metástasis y mor-talidad en estos pacientes, pero sin superioridad pronóstica al recuento mitótico. Los otros factores tam-poco aportan de manera relevante en el pronóstico (30-33, 35-39) . En la experiencia de algunos autores, la invasión mucosa se observa exclusivamente en tumo-res malignos, lo cual se evidencia en biopsias endoscópicas y hace limitante su aplicación por su crecimiento endofítico (18) . Hay tres series publicadas que lo refieren como un factor pronóstico negativo en tumores de intestino delgado (30-32) .
Presentación de Casos
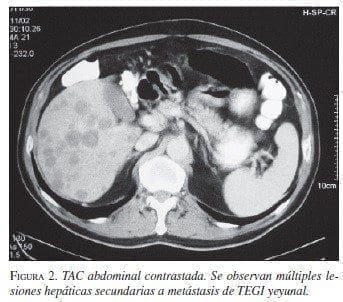
Paciente 1: Hombre de 64 años de edad, con cuadro clínico de hemorragia de vías digestivas (HVD) masiva y shock hipovolémico. La endoscopia de vías digesti-vas altas no mostró lesiones sangrantes. La colonoscopia evidenció enfermedad diverticular y pólipos con san-gre en la luz intestinal. Es llevado a cirugía en enero de 2000 encontrándose una masa sangrante en el yeyuno, a 60 cm del ligamento de treitz (figuras 1A y B). Se practicó resección yeyunal con anastomosis término-terminal. La patología informó TEGI maligno, con bor-des de sección negativos; la inmunohistoquímica (IMHQ) confirmó el diagnóstico (cuadro 1). En el postoperatorio mediato presentó infarto agudo del miocardio (enfermedad de dos vasos), por lo cual ha revascularizado. En su seguimiento se documentó por escanografía, en agosto de 2002, lesiones hepáticas múltiples sugestivas de metástasis (figura 2), que se documentaron histológicamente con diagnóstico de sar-coma fusocelular hepático. En el momento recibe tra-tamiento con imatinib, con interrupciones periódicas por neutropenia febril.


Paciente 2: Mujer de 37 años de edad, con cuadro clínico de varios meses de evolución de astenia, adinamia y pérdida severa de peso. La tomografía axial computarizada (TAC) mostró conglomerado ganglionar peri y para-aórtico que comprometía estructuras vasculares, con rechazo anterior del duodeno e hidronefrosis izquierda. En febrero de 2001 se llevó a cirugía y se encontró masa de características descritas, irresecable, por lo cual se tomaron biopsias. La pa-tología informó fibromatosis retroperitoneal y la inmunohistoquímica fue positiva para marcadores como vimentina, actina muscular, con diagnóstico final de tumor miofibroblástico. Recibió interferón y talidomi-da con pobre respuesta. Un mes después presentó clínicamente y por vías digestivas altas una obstruc-ción duodenal, pero la paciente no aceptó derivación gastrointestinal quirúrgica mediata, que se practicó un año más tarde con nuevas biopsias, las cuales confir-maron por IMH2, TEGI (cuadro 1). En su evolución cursó con hidronefrosis bilateral manejada con nefrostomías percutáneas e insuficiencia renal, pseodoquiste de páncreas drenado percutáneamente. Falleció un mes después de iniciado el tratamiento con imatinib.
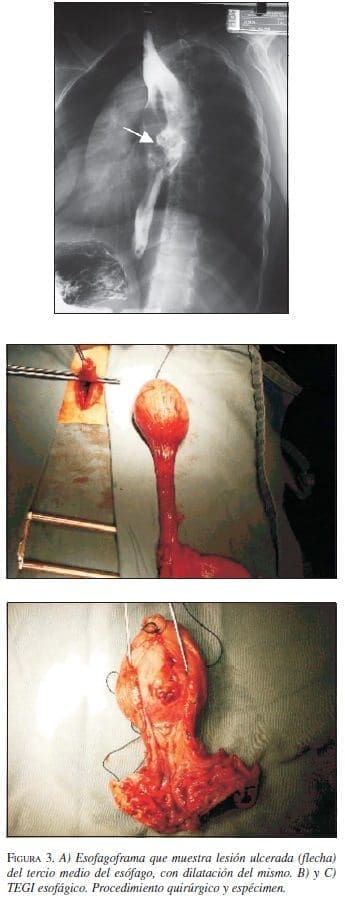
Paciente 3: Mujer de 30 años de edad, con cuadro clínico de disfagia y dolor torácico. La endoscopia di-gestiva alta mostró masa esofágica ulcerada, la biopsia informó TEGI, las vías digestivas altas revelaron masa ulcerada en el tercio medio del esófago torácico (figura 3A) y la TAC sugirió un leiomioma esofágico. En fe-brero de 2002 se practicó esofagectomía transhiatal con ascenso de tubo gástrico (figura 3B y C); cursó con un neumotórax derecho que se manejó con toracostomía cerrada y evolucionó adecuadamente. La patología re-portó un TEGI con ulceración superficial focal, la IMHQ confirmó el diagnóstico (cuadro 1. Presentó estenosis de la anastomosis esofagoyeyunal que se manejó con dilataciones. No continuó asistiendo a control institucional.
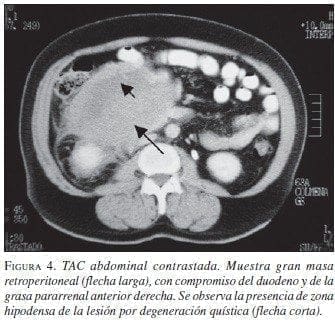
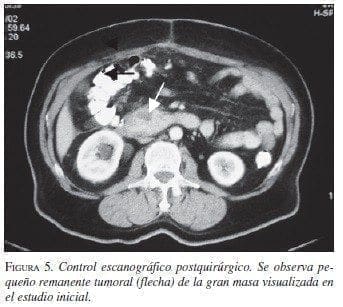
Paciente 4: Hombre de 63 años de edad, con cuadro clínico de sensación de masa abdominal, dolor y vómito. La TAC abdominal preoperatoria mostró gran masa retroperitoneal (figura 4). La sofagogastroduodenoscopia informó compresión extrínseca de la segunda y tercera porción duodenal; las biopsias mucosas fueron negativas para malig-nidad. En septiembre de 2002 se llevó a cirugía y se practicó resección de la masa, colectomía derecha e ileotransversostomía término-lateral; quedó con tu-mor residual en un volumen aproximado de 2% ad-herido a la cabeza del páncreas. Por riesgo quirúrgico del paciente (enfermedad cardiovascular y enfermedad pulmonar obstructiva crónica) no se consideró pertinente extender la resección a una pancreatoduodenectomía. La patología informó TEGI, sin invasión a colon. La IMHQ confirmó el diagnóstico (cuadro 1. En el postoperatorio inme-diato cursó con infarto agudo del miocardio, que requirió angioplastia de urgencia, con evolución adecuada. Se encuentra en tratamiento con imatinib, sin evidencia de crecimiento tumoral por escanografía (figura 5).
 |
 |
Paciente 5: Mujer de 59 años de edad, con sensa-ción de masa epigástrica y dolor. Había sido estudiada extrainstitucionalmente mediante TAC documentándo-se tumor hepático del lóbulo izquierdo susceptibilidad para resección quirúrgica. Se practicaron nuevos estu-dios: endoscopia digestiva que mostró masa intrínseca versus extrínseca ulcerada antral, las biopsias fueron reportadas como negativas para malignidad. Se realizó una arteriografía hepática con fines de embolización preoperatoria, que mostró tumor neovascular alimentado por ramas de la arteria gástrica derecha y gastroduodenal; la arteria hepática y sus ramas fueron normales. En octubre de 2002 se sometió a intervención quirúrgica, cuyo resultado mostró gran masa de-pendiente de la pared del antro gástrico, rechazando el lóbulo izquierdo del hígado. Se practicó gastrectomía subtotal y reconstrucción en BII. La patología reportó TEGI con bordes de sección negativos, atipia y necrosis focal en la masa. La IMHQ confirmó el diagnóstico (cuadro 1). Por el tamaño tumoral se indicó tratamien-to complementario con imatinib, pero no fue autoriza-do por el servicio médico. A la fecha no hay evidencia de recidiva tumoral.
Paciente 6: Hombre de 68 años de edad, con cuadro de sangrado digestivo severo. En la endoscopia digesti-va se visualizó una lesión ulcerada e infiltrante en la tercera porción duodenal con sangrado activo. Las vías digestivas altas mostraron masa en la tercera porción duodenal (figura 6).
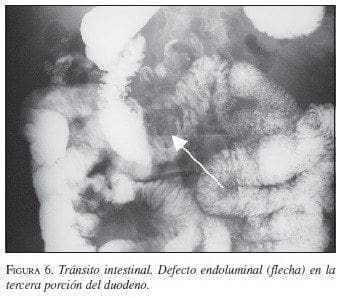
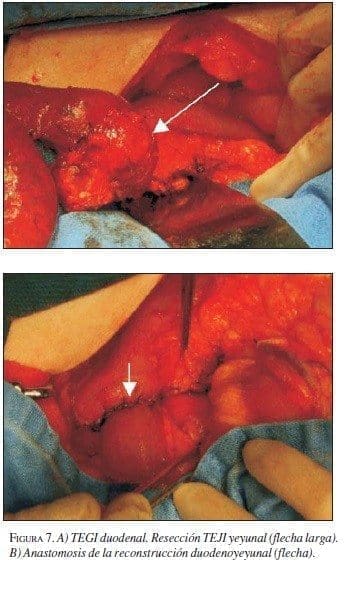
En abril de 2003 se llevó a cirugía y se encontró tumor en la tercera porción duodenal con sangrado ac-tivo. Se realizó duodenectomía de la tercera y cuarta porción con resección del segmento pancreático adhe-rido a la lesión, y duodenoyeyunostomía en la segunda rodilla duodenal con drenajes (figura 7A y B). La pato-logía informó TEGI con bordes de sección negativos, necrosis focal y alta celularidad. La IMHQ confirmó el diagnóstico (cuadro 1).
En el postoperatorio mediato cursó con fístula pancreática y posteriormente ictericia de tipo obstructivo en relación con el cuadro de colecistitis acalculosa por lo cual requirió reintervención y colecistectomía, con mejoría clínica, cierre de fístula pancreática y apari-ción de fístula biliar en manejo médico y evolución sa-tisfactoria. Recibe tratamiento complementario con imatinib.
** Cirugía General. Servicio de Cirugía General y Especiali-dades.
*** Cirugía General, Cabeza y Cuello. Servicio de Cirugía Ge-neral y Especialidades.
**** Cirugía General, Tórax. Servicio de Cirugía de Tórax.
***** Gastroenterólogo. Departamento de Gastroenterología.
****** Radiólogo. Departamento de Radiología.
******* Hematooncólogo. Departamento de Hemato-Oncología.
******** Patóloga. Departamento de Patología.
