Estudios Analíticos
RODRIGO CASTAÑO LLANO*, RICARDO OLIVEROS WILCHES**, MARITZA REY PINZÓN***
Discusión
El paciente con antecedente de cáncer que desarrolla una obstrucción intestinal (OI), representa una complicada situación para el cirujano tratante, dado que la causa de la obstrucción puede ser una adherencia o una recaída local susceptible de tratamiento quirúrgico definitivo o de una derivación paliativa, o bien, se trata de una carcinomatosis. El gran reto para el cirujano está en tratar adecuadamente aquellos pacientes que presentan una razonable posibilidad de éxito en su terapéutica y el no someter los irrescatables a terapias con reconocidos altos riesgos para, finalmente, obtener resultados pobres.
La obstrucción intestinal que aparece en pacientes que ya han sido tratados por cáncer es común. Ocurre hasta en 28% de los pacientes con historia de cáncer colorrectal y hasta en 42% de las enfermas con cáncer de ovario3. La principal causa de obstrucción intestinal en la población general es la presencia de bridas, y en diferentes series la obstrucción maligna se ubica en segundo lugar con una importante proporción de muertes por OI4.esente estudio confirma que la obstrucción intestinal en una persona con cáncer nos enfrenta a un paciente con una enfermedad avanzada y que la posibilidad de patología benigna como causa de la obstrucción es de sólo 20%, lo cual contrasta con los hallazgos de series con cifras más alentadoras en las que existe notable predominio del cáncer colorrectal, el cual se relaciona con obstrucciones de origen benigno hasta en 48%4. Por su parte, la OI originada en neoplasias ginecológicas como carcinoma ovárico y otros, muestra origen benigno en tan sólo 6,1% de las pacientes5,6.
El hallazgo de neoplasias en estados avanzados desde el momento de su diagnóstico (estados 3 y 4 en 67%), se corresponde con lo descrito en otras series7-9. La distribución por estados en la presente serie se hizo discriminando las clasificaciones de las diferentes neoplasias por cada uno de los servicios en cuatro categorías: estado 1, lesiones precoces; estado 2, lesiones intermedias; estado 3, lesiones avanzadas; y estado 4, lesiones metastásicas.
Al confrontar la supervivencia con el estado de la neoplasia se encontró una relación entre la pobre supervivencia con los estados más avanzados (Log-Rank=18,2; p=0,0004). Se excluyeron de este análisis las muertes posoperatorias, las cuales característicamente correspondían a estados 3 (3 pacientes) y 4 (8 pacientes) (tabla 1).
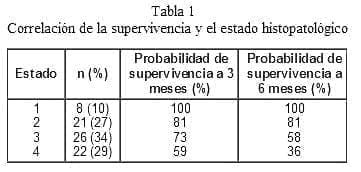
Similar a como ha sido descrito en recientes reportes2,4,8,10-13, el cáncer colorrectal en esta serie representó el antecedente de neoplasia más frecuente, en 38% de los casos, y el de cérvix en 21%. Cuando los estudios consideran sólo la OI con antecedente único de cáncer colorrectal, la causa de la obstrucción es benigna hasta en 48%9. Sin embargo, en la presente serie, la causa de obstrucción benigna para los 33 pacientes con cáncer colorrectal fue de sólo 15%, lo que se explica porque el 79% de estas neoplasias correspondían a estados 3 y 4.
En los pacientes con cáncer avanzado, el inicio de la OI raramente es un episodio agudo. Los síntomas gradualmente empeoran hasta tornarse constantes y su presencia e intensidad dependen de la porción del tracto gastrointes-tinal comprometida. La presencia de vómito varía de 68 a 100%14-16. Se encontró vómito en 68 de nuestros pacientes (77%).
El dolor se explica por la distensión abdominal, la presencia frecuente de masa tumoral y hepatomegalia; es cólico cuando compromete el intestino delgado y/o el colon. La prevalencia del dolor cólico es de 72 a 76% en diferentes series15,16, mientras que en la presente fue de 67%. Debe destacarse que la evolución del dolor debe ser tenida en cuenta desde el inicio del síntoma y no desde el ingreso del paciente, dado que el dolor que se prolonga por más de 5 días se encontró significativamente relacionado con una mayor mortalidad posoperatoria (t de Student=3,1, p=0,003).
El diagnóstico definitivo de OI requiere descartar dos eventos frecuentes: el estreñimiento y el íleo paralítico. El estreñimiento puede ser la causa de los síntomas obstructivos cuando los pacientes se quejan de heces duras y deposiciones en escaso número, lo cual puede ser el resultado de tratamientos con drogas que estriñen (opioides, belladona, alcaloides, antiespasmódicos, antidepresivos) sin el uso de laxantes. Esta situación puede ser empeorada por la inactividad, una dieta baja en fibra, debilidad o imposibilidad para alcanzar prontamente el baño con la sensación de defecación. El examen físico muestra una ampolla con heces y masas fecales palpables en abdomen. Cuando el recto está vacío y la impactación es alta, frecuentemente se requieren radiografías para llegar al diagnóstico5.
Los estudios radiográficos demuestran que el tránsito por enteroclisis ofrece mejor rendimiento diagnóstico con respecto a la administración oral del bario y sirve para diferenciar claramente la obstrucción mecánica del íleo reflejo17. Si bien estos estudios no son realizados rutinariamente, están indicados en pacientes con un alto riesgo quirúrgico, como los de esta serie, con carcinomatosis abdominal conocida y múltiples operaciones previas o enteritis por radiación. Característicamente la carcinomatosis muestra el represamiento a diferentes niveles del contraste, lo cual sugiere múltiples sitios de obstrucción17. En la presente serie el tránsito intestinal mostró ser el mejor método diagnóstico con 92% de éxito, seguido por la ecografía abdominal y las radiografías simples de abdomen (71 y 70%, respectivamente). La TAC sólo fue sensible en 6 de 9 pacientes (67%).
La decisión de operar un paciente con OI y antecedente de malignidad con el ánimo de encontrar patología susceptible de corrección, debe ser evaluada contra la posibilidad de alta morbimortalidad en enfermos que a menudo presentan una corta expectativa de vida. Una intervención quirúrgica curativa o paliativa debe considerarse en todos aquellos pacientes cuyos síntomas por OI no mejoran luego de 3 a 7 días de descompresión con sonda nasogástrica (SNG).
En pacientes con neoplasias avanzadas los tratamientos conservadores versus los procedimientos quirúrgicos constituyen motivo de controversia. De acuerdo con algunos autores, el tratamiento quirúrgico debe instaurarse así haya múltiples antecedentes de OI10,11,16,18, pero existen detractores de esta conducta que promueven el tratamiento médico13,19,20. Según Osteen4, cuando la obstrucción es debida a carcinoma recurrente, las posibilidades de aliviar una segunda obstrucción son pobres. Esta decisión es bastante complicada por la posibilidad, aunque remota, de que la obstrucción sea de origen benigno.
La gran disparidad en los resultados del tratamiento conservador o quirúrgico que aparecen en las diferentes publicaciones se puede explicar por la inclusión de pacientes en los que la extensión de la entidad maligna de base, particularmente intraabdominal, es desconocida o pobremente documentada. En el presente estudio, 67% del grupo correspondía a estados 3 y 4, lo que habla de entidades avanzadas. Sin embargo, el grado de diferenciación y la invasión vascular y/o linfática no fueron factores determinantes de importancia en cuanto a la supervivencia.
De acuerdo con diferentes series5,7,11,21, entre 6 y 60% de los pacientes no son buenos candidatos para cirugía. Las principales causas de inoperabilidad son: 1) la extensión del tumor; 2) la presencia de múltiples obstrucciones parciales; 3) una corrección quirúrgica improbable; y 4) una pobre condición clínica del paciente.
En el presente estudio la intención de tratamiento médico se dio en 80 de los 88 pacientes. En 8 hubo necesidad de pasarlos de manera urgente al quirófano. (Flujograma de curso clínico).
Entre los 80 pacientes tratados médicamente hubo necesidad de intervenir a 52, conformándose un grupo de 60 pacientes operados (68%) con los 8 que se pasaron de manera “inmediata”, cifra que está relacionada con lo descrito por Ketchan18 (67%), Osteen4 (76%), Weiss2 (60%), Butler22 (67%), Tang12 (70%), Spears8 (66%), y Gallick13 (59%).
Diferentes autores han señalado criterios pronósticos para seleccionar aquellos pacientes que poco se beneficiarán de una cirugía y en quienes es preferible hacer manejo médico por la alta morbimortalidad que representa una intervención; éstos son:
1. Problemas de motilidad intestinal por infiltración difusa debida a carcinomatosis peritoneal13,19,23.
2. Pacientes con más de 65 años en estado de caquexia5,23, 24.
3. Ascitis que requiera paracentesis frecuentes4,13,15,19, 23, bajos niveles séricos de albúmina24 y bajos niveles de prealbúmina en sangre5.
4. Radioterapia previa sobre abdomen o pelvis5,23.
5. Masa intraabdominal palpable, compromiso hepático, metástasis a distancia, derrame pleural o metástasis pulmonar13,19,23.
6. Obstrucción intestinal múltiple y parcial3.
7. Niveles elevados de nitrógeno ureico y de fosfatasa alcalina, estado tumoral avanzado e intervalos cortos entre los episodios de OI24.
8. Una escala de actividad pobre11. deseo del paciente debe tenerse en cuenta a la hora de decidir la cirugía. En términos generales, los pacientes ancianos o muy enfermos prefieren un tratamiento sintomático. Ningún paciente debe ser llevado a cirugía para prevenir la muerte por la obstrucción, pues ésta puede ser evitada con un adecuado uso de drogas15.
Durante la cirugía se encontró carcinomatosis abdominal en 47% de los pacientes. Los procedimientos practicados fueron: resección intestinal con anastomosis, 30%; derivación externa, 27% (ostomías); derivación interna, 16%; liberación de bridas, 11%; en 10 pacientes (16%) no se pudo realizar procedimiento alguno por lo extenso de la enfermedad. En 65% la OI era múltiple y en 55% había metástasis o siembras peritoneales del tumor primario. La OI completa se asoció con un riesgo dos veces mayor de morir en el posoperatorio (IC 95%=1,1 a 4,1), y con un peor control de la OI en el posoperatorio.
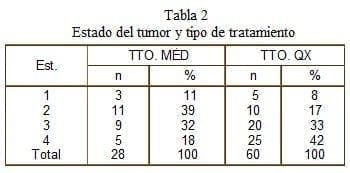
De los 60 pacientes operados 77% salieron del hospital tolerando la vía oral, mientras que de los tratados médicamente, 96% pudieron reiniciar con éxito la vía oral. Esto se explica por lo avanzado del estado del grupo de pacientes intervenidos (75% en estados 3-4) al comparar con los de tratamiento médico (50% en estados 3-4), lo cual además está relacionado con una escala de actividad menor para los pacientes de manejo quirúrgico. En síntesis, los pacientes intervenidos presentaban una peor condición clínica y sus tumores eran más avanzados (tabla 2).
En los pacientes que no se logró controlar la OI con cirugía ni tratamiento médico se encontró una mediana de sobrevida de 19 días, contra 213 días en los que se logró controlar la OI (p<0,0001).
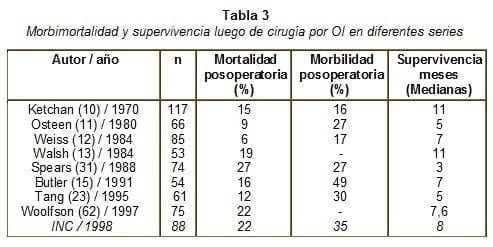
La cirugía no siempre alivia la obstrucción ni controla cabalmente los síntomas en los casos de cáncer avanzado. Además, en un buen porcentaje de casos la cirugía puede relacionarse con alta morbimortalidad (tabla 3).
Las complicaciones más frecuentes son las infecciones de la herida quirúrgica, la dehiscencia de fascia, sepsis, fístulas enterocutáneas, nueva obstrucción, absceso peritoneal, dehiscencia de anastomosis, sangrado gastrointestinal, embolismo pulmonar, trombosis venosa profunda, infecciones urinarias o respiratorias.
El manejo de los pacientes no operados consistió en reposición hidroelectrolítica, reposo intestinal (nada vía oral), SNG y controles clínicos periódicos respecto a la evolución del dolor. La permanencia de la SNG por largos períodos interfiere con un correcto mecanismo de la tos para aclarar las secreciones pulmonares y puede causar erosión del cartílago nasal, otitis media, broncoaspiración, neumonía, esofagitis con sangrado.
No se justifican períodos prolongados del uso de SNG y líquidos intravenosos para el tratamiento sintomático de pacientes inoperables. Este manejo puede resultar molesto para pacientes ya sometidos a otras terapias invasoras, dada su condición de base. La SNG debe considerarse principalmente cuando la terapia farmacológica para el control de los síntomas es inefectiva5.
Una alternativa en la atención de los pacientes que no son candidatos para cirugía, o cuando ésta es ineficaz, es la gastrostomía, idealmente percutánea, la cual puede ejecutarse en forma segura para descomprimir el tracto gastrointestinal, aliviando las náuseas y el vómito. Según Malone25 la gastrostomía percutánea es superior a la succión permanente por SNG o a la gastrostomía quirúrgica para la paliación de la OI en pacientes terminales con cáncer de ovario. Gemlo26 reporta similares resultados con el tratamiento ambulatorio de pacientes terminales con gastrostomía endoscópica por obstrucción intestinal.
La conducta inicial en el paciente con OI y una enfermedad maligna avanzada es controvertido. Algunos sugieren la cirugía como la mejor forma de paliación10,11,18,27, mientras otros encuentran significativas respuestas con tratamientos conservadores y obtienen supervivencia equiparables con ambas conductas6,13,19. Una explicación para esta discrepancia puede ser la inclusión de pacientes con una entidad maligna pero en estados desconocidos o pobremente documentados.
La OI por el cáncer colorrectal merece una consideración especial; se presenta entre 8 y 16% y afecta principalmente el ángulo hepático o esplénico y el colon descendente27. Esta obstrucción conlleva pronóstico pobre. El proyecto americano para el control del cáncer colorrectal y de seno28 (NSABP) analizó 1.021 pacientes en estados B y C, y encontró que el 14% se presentó con OI aguda (140 pacientes); porcen-tualmente el compromiso del ángulo esplénico fue 37%; el del colon descendente, 21%; el del sigmoides, 16%; y el del recto, 4%. Independiente del compromiso ganglionar, la OI en el cáncer colorrectal mostró una menor supervivencia que en los no obstructivos.
El grupo para el estudio de los tumores gastrointestinales (GITSG) realizó un estudio semejante con 572 pacientes; en 80 hubo OI aguda (14%). La supervivencia se afectó adversamente por la OI, independiente del estado. La tasa de supervivencia a 5 años fue 45% en los pacientes con OI y 60% en pacientes sin OI, diferencia significativa (p<0,003) 29.
En una revisión de 77 pacientes del Massachussets General Hospital (Boston) se confirmaron los hallazgos del NSABP y del GITSG. La supervivencia a 5 años fue peor para los pacientes con OI que sin ella (31% vs 59%); el tiempo libre de enfermedad 44% vs 75%; la recurrencia fue mayor tanto localmente, 42% vs 14%. como a distancia, 44% vs 21%30.
En otro estudio por Sjodahl y asociados, la OI se asoció con una peor supervivencia a 5 años 19% vs 38%, (p=00,1) en el análisis univariado. En el análisis multivariado, la OI pierde algo de su importancia (p=0,018), siendo el estado, la edad y el grado tumoral las más importantes. Sin embargo, la OI fue el único síntoma o signo que mantuvo una importancia pronóstica independiente, por encima del dolor abdominal, anemia, alteración del hábito intestinal, examen abdominal anormal, y duración de los síntomas31.
El tratamiento de las obstrucciones del colon derecho no presenta tanta controversia y se acepta la hemicolectomía derecha con anastomosis primaria como una terapia segura27. Para las lesiones obstructivas del colon izquierdo el tratamiento óptimo exhibe menos unanimidad y se tiende a individualizar. Las opciones incluyen:
1. Colostomía para descompresión, seguida semanas más tarde por la resección tumoral.
2. Resección con colostomía y cierre de colostomía más tarde.
3. Resección con anastomosis primaria.
La colostomía para descompresión puede utilizarse en ciertas circunstancias, como en pacientes con mal pronóstico por problemas médicos o con enfermedad diseminada con una expectativa de vida corta. Para la mayoría, sin embargo, la resección es lo indicado27.
Existe uniformidad en aceptar que entre menos operaciones, menores son la estancia hospitalaria y las complicaciones. En un reporte de 115 pacientes con OI colorrectal maligna, la estancia hospitalaria fue significativamente menor cuando el tumor se resecó inicialmente, que cuando se realizó o no una colostomía, sin diferencias en la mortalidad operatoria o la supervivencia31.
Una atractiva y reciente opción para el tratamiento de estos pacientes consiste en la hemicolectomía derecha extendida, o colectomía subtotal con anastomosis ileocolónica o anastomosis ileorrectal. El mayor inconveniente con esta operación es la presencia de diarrea, especialmente en el anciano o en el paciente debilitado. Se destaca en diferentes series el encontrar pacientes con tumores sincrónicos y adenomas proximales al sitio de obstrucción32,33, lo que justificaría esta amplia resección.
En 1985 Baines y colaboradores14 publicaron el primer estudio del tratamiento farmacológico de las náuseas, vómito, dolor y otros síntomas en la OI inoperable, evitando el uso de la SNG y la hidratación intravenosa. Esto se ha hecho extensivo para diferentes unidades de cuidado paliativo en el mundo. Si se obtiene el alivio de los síntomas con el tratamiento paliativo, el paciente puede tomar agua u otros líquidos, así como comer pequeñas cantidades de alimentos, alejando la posibilidad de la NPT5.
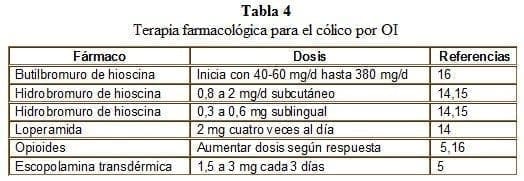
El butilbromuro de escopolamina es una droga frecuentemente utilizada tanto para el vómito como para el cólico. Su actividad anticolinérgica disminuye el tono y peristaltismo del músculo liso por inhibición competitiva de receptores muscarínicos a nivel del músculo liso y por impedir la transmisión ganglionar neural en la pared intestinal5. Los receptores colinérgicos muscarínicos también se han observado en las células mucosas del lumen intestinal y en las glándulas salivales humanas, lo que explica su efecto analgésico sobre el cólico mientras reduce las secreciones intestinales. Dada su poca solubilidad en lípidos, no penetra la barrera hematoencefálica, lo cual disminuye efectos colaterales como somnolencia y alucinaciones cuando se administra con opioides.
La administración de drogas en estos pacientes debe individualizarse, siendo poco frecuente la disponibilidad de la vía oral por las náuseas y el vómito. Si bien la administración rectal o sublingual son buenas alternativas, existen pocas drogas disponibles para estas vías.
Para el control del dolor abdominal continuo, los opioides (morfina, hidromorfona, diamorfina) pueden administrarse con dosis equianalgésicas, alternando la vía oral con la parenteral según el control del síntoma, (tabla 4).
La metoclopramida es un antiemético que estimula la evacuación gástrica. Algunos autores14-16 evitan su uso ante la presencia de OI completa, porque tiende a incrementar las náuseas, el vómito y el dolor cólico. Según Faisinger34, la metoclopramida parenteral, 10 mg cada 4 horas, es la droga de elección en pacientes con OI incompleta.
Para el control del vómito la droga de primera elección es el haloperidol. Puede cursar con parkinsonismo a dosis mayores de 15 mg/d (tabla 5).
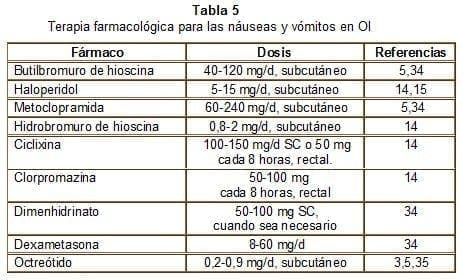
La somatostatina y sus análogos son nuevas drogas sometidas a estudio para el control de los síntomas de la OI. Se ha demostrado su capacidad de reducción de las diferentes hormonas36 y secreciones37 gastrointestinales. Además, disminuyen el tránsito intestinal, el flujo biliar, incrementan la producción de moco y disminuyen el flujo sanguíneo esplácnico.
El octreótido es un análogo de la somatostatina que tiene potente actividad biológica y mayor vida media (1,5 horas). Puede administrarse por vía subcutánea, por bolos o por infusión continua. La disminución en las secreciones gastrointestinales produce reducción en la distensión del intestino, con disminución de la secreción de sodio y agua por el epitelio intestinal; por lo tanto, disminuye el vómito y el dolor. Dado su alto costo, debe considerarse cuidadosamente la relación costo/beneficio en el momento de formular la droga, especialmente cuando se contemplan tratamientos prolongados.
El octreótido está indicado cuando fallan los antieméticos convencionales (haloperidol y clorpromazina). La dosis recomendada para empezar es de 0,3 mg/d subcutáneos, y se ajusta hasta alcanzar el control de los síntomas5.
El más reciente análogo de la somatostatina es el vapreotide, fármaco microencapsulado de lenta liberación y con propiedades y acciones semejantes a la somatostatina pero con una acción más prolongada. Se dosifica semanalmente, 4 mg por vía parenteral durante 1 mes; los resultados son alentadores35.
Diferentes autores recomiendan el uso de los esteroides por su capacidad de reducir la inflamación peritumoral, mejorando la movilidad intestinal. No existen estudios controlados y la dosis no ha sido estandarizada. Se sugiere iniciar con dexametasona (8 mg/d) o prednisona (25 mg cada 12 horas por 5 días), con reducción gradual de la dosis al encontrar respuesta. Si no hay respuesta, puede aumentarse la dexametasona 5 a 10 mg/d subcutáneos (34). Aunque la droga ha sido útil en el control de los síntomas, su papel en el control de la OI y prevenir la obstrucción completa, no se ha podido determinar.
La gastrostomía percutánea consiste en la introducción de un tubo a través de la pared abdominal, sin intervención quirúrgica ni anestesia general. Puede practicarse en forma segura en pacientes con cáncer avanzado y náuseas y vómito por OI, para descomprimir el tracto gastrointestinal. Según Malone25 y Gemlo26 la gastrostomía percutánea es preferible a la SNG y a la gastrostomía quirúrgica para la paliación de la OI en el paciente terminal.
Cuando los síntomas de la OI no pueden ser controlados con la terapia farmacológica convencional, el consenso apunta hacia utilizar la gastrostomía percutánea por ser una modalidad más efectiva y una mejor alternativa al uso prolongado de la SNG.
Con base en el análisis multivariado de los diferentes factores que incidían en la supervivencia, se desarrolló con el método paso a paso (stepwise) un sistema de categorización, con 4 categorías en el grupo de pacientes que los divide en: bajo riesgo, riego intermedio-bajo (mediana 238 días), intermedio alto (112 días) y alto (53 días).
De acuerdo con este sistema de categorización y la pobre superviencia en los pacientes de riesgo alto (presencia de hemoglobina <9 g/dL, escala de actividad de 3-4 y estado del tumor 3-4), se justifica insistir en un tratamiento no quirúrgico e intentar uno farmacológico orientado por el servicio de cuidados paliativos con el apoyo de una gastrostomía endoscópica de descompresión.
Conclusiones
Este estudio prospectivo en unión con una revisión de la literatura, permite llegar a conclusiones y recomendaciones para el tratamiento del paciente con OI y antecedente de cáncer:
1. Los antecedentes del paciente son un marcador importante en el pronóstico del mismo; la cirugía previa, sea por neoplasia o no, las obstrucciones anteriores y el estado del tumor, son fuertes predictores de una pobre supervivencia.
2. Las características clínicas como el dolor intermitente o continuo, la presencia de temperatura elevada o el pulso anormal no fueron marcadores importantes con respecto a la necesidad de realizar o no cirugía en el momento del ingreso.
3. Al considerar el tiempo transcurrido con dolor desde antes de la consulta del paciente, sumado al que haya sentido a partir del ingreso a la cirugía, si resulta en más de 5 días, el pronóstico de morbimortalidad posoperatoria se hace más sombrío.
4. Las radiografías simples de abdomen muestran una sensibilidad diagnóstica de 70%, mientras que el tránsito intestinal mostró un rendimiento de 92%. La ecografía demostró una sensibilidad de 71% y la TAC de 67%.
5. La hemoglobina < 9 g/dL al ingreso mostró ser un alto factor predictivo de corta supervivencia. Por su parte, las cifras de leucocitos no fueron predictivas de la posibilidad de cirugía ni de una mayor morbimortalidad.
6. Igualmente, la escala de actividad pobre se encontró como un factor determinante de una pobre supervivencia.
7. La cirugía mostró que la obstrucción era benigna en sólo 20% de los casos, con un 47% de carcinomatosis abdominal. Se practicó resección intestinal y anastomosis en 30%, ostomías derivativas en 27%, derivaciones internas en 16% no se hizo nada en 16%, y se practicó liberación de bridas en 11%. En el 65% la obstrucción era múltiple y en 68% era completa, lo cual se asoció a una mortalidad posoperatoria dos veces mayor.
8. La presencia de perforación intestinal se relacionó significativamente con una mayor morbilidad infecciosa en el posoperatorio.
9. La morbilidad posoperatoria ocurrió en 21 pacientes (24%) y correspondió a: infección de la herida quirúrgica en 10 pacientes (47%), evisceración en 3 (14%), neumonía en 2 (10%), filtración de anastomosis con peritonitis 2 (10%), fístulas enterocutáneas en 2 (10%) y OI en posoperatorio 2 (10%).
10. La mortalidad posoperatoria ocurrió en 11 pacientes (12,5%); 2 de las muertes no fueron hospitalarias. Las principales causas fueron: falla multiorgánica en 7 pacientes (64%), sepsis de origen abdominal en 3 (27%), y 1 paciente por OI (9%) con carcinomatosis.
11. La estancia hospitalaria fue mayor para los operados, encontrándose un mejor control del episodio obstructivo para los pacientes con tratamiento médico (96%) sobre los intervenidos quirúrgicamente (77%).
12. Se presentaron 39 episodios de recurrencia. Los pacientes tratados médicamente presentaron un mayor número de recurrencias que los llevados a cirugía.
13. Sólo la presencia de obstrucciones anteriores y el tipo de tratamiento (quirúrgico o médico) mostraron una influencia negativa significativa en el tiempo libre de enfermedad (recurrencia). mortalidad en 57% de los pacientes, con una mediana de supervivencia de 181 días. Los determinantes de una pobre supervivencia fueron: antecedente de cirugía, estado del tumor 3-4, escala de actividad 3-4, hemoglobina menor de 9 g/dL, pacientes intervenidos, tiempo con dolor mayor a 5 días antes de la cirugía, origen maligno de la obstrucción, obstrucción total y extensión múltiple de la OI.
15. Los factores determinantes de pobre supervivencia en el análisis multivariado por el método paso a paso (stepwise) en el momento del ingreso fueron: hemoglobina < 9 g/dL, estado 3-4 de la neoplasia y una escala de actividad 3-4.
16. En el momento de la cirugía este mismo análisis mostró como factores determinantes de pronóstico de pobre sobrevida: extensión múltiple de la OI, una obstrucción total o el antecedente de cirugía por neoplasia.
17. Con base en estos hallazgos se crea un sistema pronóstico para el ingreso que se relaciona bien con la mediana de supervivencia. Los de riesgo bajo, los de riesgo intermedio-bajo (supervivencia mediana 213 días), riesgo intermedio alto (supervivencia mediana 112 días) y los de riesgo alto con una supervivencia mediana de 53 días.
18. De acuerdo con estos hallazgos, los pacientes con riesgo alto (hemoglobina < 9 g/dL, más estado 3-4 de la neoplasia más una escala de actividad 3-4) serían candidatos para un tratamiento no operatorio apoyados por el servicio de cuidados paliativos y eventualmente la posibilidad de una gastrostomía endoscópica descompresiva.
Referencias
1. Medina M: Atlas de mortalidad por cáncer en Colombia. 1a. ed., vol. 1, Santa Fe de Bogotá. Nuevas ediciones; 1990.
2. Weiss SM, Skibber JM, Rosato F: Bowel Obstruction in cancer patients: Performance status as a predictor of survival. J Surg Oncol 1984; 25: 15-7.
3. Ripamonti C, Conno FD, Ventafridda V, et al: Management of bowel obstruction in advanced and terminal cancer patients. Ann Oncol 1993; 4: 15-21.
4. Osteen RT, Guyton S, Steele G, et al: Malignant intestinal obstruction. Surgery 1980; 87: 611-5.
5. Ripamonti C: Management of bowel obstruction in advanced cancer. Curr Opin Oncol 1994; 6: 351-7.
6. Lau PW, Lorentz TG: Results of surgery for malignant bowel obstruction in advanced, unresectable, recurrent colorectal cancer. Dis Colon Rectum 1993; 36: 61-4.
7. Gandrup P, Lund L, Balslev I: Surgical treatment of acute malignant large bowel obstruction. Eur J Surg 1992; 158: 427-30.
8. Spears H, Petrelli N, Herrera L, et al: Treatment of bowel obstruction after operation for colorectal carcinoma. Am J Surg 1988; 155: 383-6.
9. Woolfson RG, Jenning K, Whalen GF: Management of bowel obstruction in patients with abdominal cancer. Arch Surg 1997; 132: 1093-7.
10. Walsh HPJ, Schofield PF: Is laparotomy for small bowel obstruction justified in patients with previously treated malignancy? Br J Surg 1984; 71: 933-5.
11. Turnbull A, Guerra J, Starnes F: Results of surgery for obstructing carcinomatosis of gastrointestinal, pancreatic, or biliary origin. J Clin Oncol 1989; 7: 381-6.
12. Tang E, Davis J, Silberman H: Bowel obstruction in cancer patients. Arch Surg 1995; 130: 832-7.
13. Gallick HL, Weaver DW, Sachs RJ, Bouman DL: Intestinal obstruction in cancer patients: an assessment of risk factors and outcome. Am Surg 1986; 52: 434-7.
14. Baines M, Oliver DJ, Carter Rl: Medical management of intestinal obstruction in patients with advanced malignant disease. A clinical and pathological study. Lancet 1985; 2: 990-3.
15. Baines M. The patophysiology and management of malignant intestinal obstruction. In: Textbook of palliative Medicine. Doyl D, Hanks GWC, MacDonald N,(eds). Oxford: Medical Publication; 1993; 311-6.
16. Ventafridda V, Ripamonti C, Caraceni A, et al: The management of inoperable gastrointestinal obstruction in terminal cancer patients. Tumori 1990; 76: 389-93.
17. Ericksen AS, Krasna MJ, Mast BA, et al: Use of gastrointestinal contrast studies in obstruction of the small and large bowel. Dis Colon Rectum 1990; 33 (1): 56-64.
18. Ketchan A, Hoye RC, Pilch Y, Morton D: Delayed intestinal obstruction following treatment for cancer. Cancer 1970; 25: 406-10.
19. Glass RL, LeDuc RJ: Small intestinal obstruction from peritoneal carcinomatosis. Am J Surg 1973; 125: 316-7.
20. Chan A, Woodruff RK: Intestinal obstruction in patients with widespread intrabdominal malignancy. J Pain Symptom Manag 1992; 7 (6): 339-42.
21. Taylor RH: Laparotomy for obstruction with recurrent tumor. Br J Surg 1985; 72: 327.
22. Butler JA, Cameron BL, Morrow M, et al: Small Bowel Obstruction in patients with a prior history of cancer. Am J Surg 1991; 162: 624-8.
23. Krebs HB, Goplerud DR: Surgical management of bowel obstruction in advanced ovarian carcinoma. Obstet Gynecol 1983; 61: 327-30.
24. Fernández JR, Seymour RJ, Suissa S: Bowel obstruction in patients with ovarian cancer: a search for prognostic factors. Am J Obstet Gynecol 1988; 158: 244-9.
25. Malone JM, Koonce T, Larson DM, et al: Palliation of small bowel obstruction by percutaneous gastrostomy in patients with progressive ovarian carcinoma. Obstet Gynecol 1986; 68: 431-3.
26. Gemlo B, Rayner AA, Lewis T: Home support of patients with end-stage malignant bowel obstruction using hydratation and venting gastrostomy. Am J Surg 1986; 152: 100-4.
27. Wiebke EA: Malignant Gastrointestinal Obstruction. In: Lefor AT, Editor. Surgical problems affecting the patient with cancer: interdisciplinary management. Philadelphia, New York: Lippincott-Raven Publishers; 1996, 25-60.
28. Wolmark N, Wieand HS, Rockette HE, et al: The prognostic significance of tumor location and bowel obstruction in Dukes B and C colorectal cancer. Ann Surg 1983; 198: 743.
29. Steinberg SM, Barkin JS, Kaplan RS, Stablein DM: Prognostic indicators of colon tumors: the gastrointestinal tumor group experience. Cancer 1986; 57: 1866.
30. Willett C, Tepper JE, Cohen A, et al: Obstructive and perforative colonic carcinoma: patterns of failure. J Clin Oncol 1985; 3: 379.
31. Sjodahl R, Franzen T, Nystrom PO: Primary versus staged resection for acute obstructing colorectal carcinoma. Br J Surg 1992; 79: 685.
32. Morgan WP, Jenjins N, Lewis P, Aubrey DA: Management of obstructing carcinoma of the left colon by extended right hemicolectomy. Am J Surg 1985; 149: 327.
33. Brief DK, Brener BJ, Goldenkranz R, et al: Defining the role of sutotal colectomy in the treatment of carcinoma of the colon. Ann Surg 1991; 213: 248.
34. Faisinger RL, Spachynski K, Hanson J, Bruera E: Symptom control in terminally ill patients with malignant bowel obstruction. J Pain Symptom Manag, 1994; 9: 12-8.
35. Stiefel F, Morant R: Vapreotide, a new somatostatin analogue in the palliative management of obstructive ileus in advanced cancer. Supportive care cancer 1993; 1: 57-8.
36. Reichlin S: Medical Progress: Somatostatin. N Engl J Med 1983; 309: 1495-501.
37. Puerta JD, Castaño R: Octreotide en el manejo de las fístulas enterocutáneas. Seguimiento de 21 pacientes. Rev Colomb Cir 1996; 11: 182-8.
Correspondencia:
Rodrigo Castaño Llano. Departamento de Cirugía Digestiva y Endoscopia, Universidad de Antioquia, Medellín; Ricardo Oliveros Instituto Nacional de Cancerología, Bogotá, D.C., Colombia.
* Rodrigo Castaño Llano, Profesor de Gastroenterología y de Cirugía Digestiva y Endoscópica, Universidad de Antioquia, Medellín.
** Ricardo Oliveros Wilches, jefe del Servicios de Gastroenterología, Cirugía Digestiva y Endoscópica, Instituto Nacional de Cancerología.
*** Maritza Rey Pinzón, Epidemióloga, Instituto Nacional de Cancerología, Bogotá, D.C., Colombia.
