Presentación de Casos y Revisión de Temas
BRAVO DE INSUASTY M, MD*; ADRADA A, MD**; SANDOVAL J, MD***
Palabras clave: tumores estromales gástricos, leiomioblastoma, leiomioma, leiomiosarcoma.
Resumen
Los tumores gástricos estromales (TGE) son poco frecuentes y en muchas ocasiones de difícil diagnóstico. Se estudia una paciente de sexo femenino, que consultó al Hospital Universitario San José de Popayán en l997, con un tumor quístico intraabdominal dependiente del estómago y de crecimiento exogástrico. Se revisó la historia clínica y se realizaron cortes para hematoxilina-eosina (HE) histoquímica e inmunohistoquímica. Las coloraciones HE mostraron un TGE constituido por proliferación de células de aspecto epitelioide con prominente estroma mixoide. La inmunofenotipificación confirmó su origen mioide, el “alcian blue” pH 2,5 fue positivo para mucosustancias en el estroma. Después de revisar las características clínicas, morfológicas, el pronóstico y tratamiento y los métodos diagnósticos de los TGE, y de consultar numerosos trabajos sobre el tema, resaltamos el valor de la inmunotipificación que nos permite clasificarlos con base en su histogénesis en un intento por determinar su pronóstico e individualizar su tratamiento.
Introducción
Los tumores estromales gástricos epitelioides forman un subgrupo especial de los TGE; su histogénesis, su comportamiento biológico y el término más adecuado para denominarlos, son controversiales. Fueron descritos por Martin en l960, quien los llamó tumores miogénicos gástricos de células redondas. Stout en l962 propuso nombrarlos como leiomiomas o leiomioblastomas bizarros1. Evans cuestionó la validez del término afirmando que el aspecto de las células constituye sólo una variación morfológica que puede presentarse indistintamente en leiomiomas o en leiomio-sarcomas y que esta característica no amerita separar tal tipo de tumores en un subgrupo histológico distinto; propuso utilizar los términos: leiomioma epitelioide o leiomiosarcoma epitelioide, según el caso2. La tendencia actual es incluir todos estos tumores dentro de un grupo único denominado tumores estromales gastrointestinales, subclasificándolos según su localización y origen, estableciendo su naturaleza benigna o maligna con base en la tasa mitótica. Estudios con seguimiento de pacientes permitieron definir parámetros bastante confiables para determinar el grado histológico de estos procesos, mas no así para su comportamiento biológico3,4. La inmunofenotipificación, la medición del ADN y la utilización de métodos análogos como el Ki-67 y el índice PCNA (Antígeno nuclear celular proliferativo) y más recientemente la aplicación de biología molecular en el estudio de mutaciones genéticas, abren nuevas perspectivas que nos permitirán en un futuro aproximarnos acertadamente a la clasificación de estos raros tumores.
Materiales y Métodos
Se estudia una paciente con un tumor gástrico, tratada por el Departamento de Ciencias Quirúrgicas del Hospital Universitario San José de Popayán, en 1997. Del material obtenido fijado en formol al 10% en bloques de parafina, se hicieron cortes para coloración con hematoxilina-eosina (HE) e histoquímica: ácido periódico de Schiff (PAS), tricrómico de
asson, Alcian blue con pH 2,5 con y sin digestión, retículo y elástica; igualmente se tomaron cortes para inmunohistoquí-mica: desmina, actina-músculo liso (ASM), citoqueratina de amplio espectro monoclonal (AE 1, AE 3), antígeno epitelial de membrana (EMA), proteína S100, alfa fetoproteína, factor VIII, antígeno carcinoembriónico (CEA), CD15, CD68; los anticuerpos utilizados para inmunohistoquímica pertenecen a Dako Vector Lab USA. Todas las pruebas se corrieron con controles positivos y negativos.
Resultados
Reporte de caso
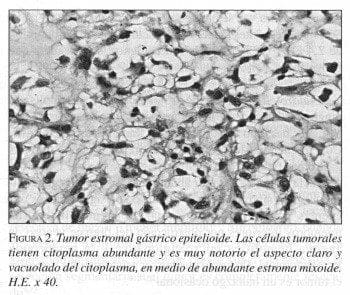
Mujer de 72 años natural del Valle de Tenza, Boyacá, procedente de Popayán, de ocupación religiosa. Consulta por sensación de masa abdominal de 3 meses de evolución. Al examen clínico se palpa masa abdominal móvil, no adherida, localizada en el mesogastrio. En el acto operatorio se encuentra masa exogástrica que depende de la curvatura mayor del estómago y con adherencias al mesocolon transverso. La masa se reseca en su totalidad, con un segmento gástrico amplio. En patología se recibe masa bien delimitada de superficie lisa, que mide 7x5x4 cm. Al corte aparece quística y drena líquido serohemático; tiene en su interior una masa blanda polipoide de 5 cm de diámetro, la cual al corte, también es quística y multiloculada (figura 1). A la microscopía de luz se identifica un tumor mesenquimal, constituido por proliferación de células con amplio citoplasma claro, de aspecto epitelioide que focalmente adoptan patrón en anillo de sello; en otras áreas la célula que prolifera es fusocelular, los dos tipos de células están dispuestos en fascículos y sábanas, con claro predominio de las células claras; el estroma tiene un prominente patrón mixoide. Hay focos de necrosis y hemorragia. La tasa mitótica es de 3 X 50 HPF. El tumor infiltra la capa muscular propia del estómago y la serosa, sin comprometer mucosa ni submucosa (figura 2).
 |
 |
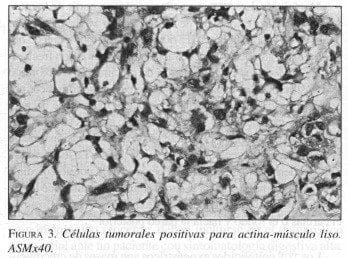
La inmunotipificación mostró positividad focal para actina-músculo liso (SMA) y desmina, lo cual confirma su origen miogénico (figura 3). Los otros marcadores fueron negativos, con lo cual se descartó origen epitelial, neural, vascular o histiocítico. El estroma mixoide fue positivo para Alcian blue, lo cual confirmó la presencia de mucosustancias. Fue reportado como leiomiosarcoma epitelioide de bajo grado de malignidad.
Discusión
Los tumores gástricos estromales (TGE) forman un grupo heterogéneo pobremente comprendido y de muy baja frecuencia; constituyen entre 1% y 3% de las neoplasias del estómago y dentro de ese grupo los de diferenciación epitelioide son todavía más infrecuentes; las características epidemiológicas son comunes para todos los tumores estromales del tracto gastrointestinal. Aunque están descritos en un rango entre 10 y 80 años, su incidencia máxima ocurre en la 5ª a 7ª década de la vida; rara vez se han reportado en menores de 20 años. Son más frecuentes en el sexo masculino en una proporción de 2,4 a 11,5-7, y la mayoría son benignos: se considera que entre 10% y 30% son malignos8,9.
Cuadro clínico. Su espectro clínico tiene un amplísimo rango; puede ser, desde un hallazgo incidental completamente benigno, hasta un tumor altamente maligno con metástasis. Con frecuencia, los pacientes se presentan con síntomas gastrointestinales como hematemesis y melenas. La hemorragia, la anemia y el dolor abdominal inespecífico generalizado son los síntomas más constantes. Son signos menos frecuentes la obstrucción intestinal, el edema bilateral de miembros inferiores por obstrucción del drenaje venoso, la anemia hemolítica microangiopática y la hemorragia intraabdominal. Un tercio pueden ser asintomáticos y en ellos el tumor es un hallazgo ocasional1,5-7,10.
Morfología. Los TGE se pueden originar a partir de la muscular propia del estómago, de la muscularis mucosae o de la pared de un vaso sanguíneo. El 60% son endofíticos, crecen hacia el lumen gástrico y la penetración y ulceración son frecuentes. En 30% de los casos el patrón de crecimiento es exofítico (exogástrico); éstos usualmente son de curso asintomático; por esta razón alcanzan gran tamaño y pueden extenderse hasta el ligamento gastrocólico y hacia el omento; a veces su única conexión con el estómago es un delgado pedículo; ocasionalmente crecen en las dos direcciones (en reloj de arena). La localización más frecuente del TGE epitelioide benigno es la porción media y distal del estómago y hacia la pared anterior, en tanto que los de localización proximal, generalmente malignos, se localizan en el cardias o el fondo y hacia la pared posterior5,6.
Los TGE epitelioides exogástricos son masas de crecimiento lento, lobuladas, bien delimitadas, tienden a presentar patrón quístico y sólido combinados y son hipervascularizados, aunque de dimensiones muy variables, se han descrito hasta de 30 cm1,10-12.
A la microscopia las células neoplásicas son redondas, con abundante citoplasma claro o vacuolado de aspecto epitelioide, con núcleo central con tendencia a formar nódulos y a organizarse alrededor de vasos sanguíneos; se observan también, en menor proporción, células de aspecto fusiforme, las cuales coexisten en nódulos adyacentes con las células de aspecto epitelioide; se debe anotar que el aspecto epitelioide de las células es un artefacto de fijación, el cual no está presente cuando se utilizan técnicas de fijación diferentes a la formalina. La neoplasia puede tener características típicas del leiomioma común, incluidos los cambios degenerativos; en ocasiones se observan células con patrón en anillo de sello, lo cual puede llevar al diagnóstico erróneo de un liposarcoma o de un carcinoma, pero sus vacuolas con coloraciones especiales son negativas para mucosustancias, grasa o glicógeno, lo cual facilita el diagnóstico diferencial1,4-6.
Se ha descrito la presencia de un prominente patrón mixoide en algunos TGE, similar al estroma de las neoplasias neurales, pero que carece de características ultraestructurales e inmunohistoquímicas propias del tejido neural; en éstas el patrón mixoide es ocasionado por acumulación de mucopo-lisacáridos en el estroma; se desconoce aún si se trata de una reacción específica a un estímulo desconocido o si sólo son cambios degenerativos13.
Los avances en inmunohistoquímica permiten realizar una clasificación muy exacta de estos tumores basada en su histogénesis e independiente de su patrón histopatológico. Existen tres grupos bien definidos de tumores estromales del tracto gastrointestinal: los de origen miogénico, los de origen neural y los tumores estromales con marcadores negativos para músculo liso y para tejido neural. En los primeros, la inmunorreactividad es variable, sólo el 50% de los tumores de músculo liso gástricos son desmina positivos; también es variable la inmunorreactividad para actina. Los del segundo grupo de origen neural son S-100 positivos y se subclasifican según sus características histopatológicas en schwannomas y en tumores de nervio autonómico; es importante establecer la diferenciación entre estos dos subtipos, ya que los schwannomas son generalmente benignos, en tanto que aproximadamente el 50% de los tumores de nervio autonómico son malignos. El tercer grupo está constituido por los tumores estromales gastrointestinales con marcadores negativos para músculo liso y para tejido neural, que tienen un prototipo inmunohistoquímico característico, son CD34 positivos y CD117 (C-kit) positivos, marcadores que son siempre negativos en los dos grupos anteriores. Otra característica observada en este último grupo es la presencia de una mutación a nivel del gen C-kit, localizado en el brazo largo del cromosoma 4, la cual se expresa en estos tumores independiente de su comportamiento biológico8,13-15.
Se ha señalado una estrecha relación entre estos tumores y las células de Cajal, ya que éstas también son CD34 y CD 117 positivas, se sugiere que podrían tener su origen en dichas células16.
Investigaciones recientes señalan que, contrario a lo que se ha aceptado siempre, la mayoría de los tumores estromales gastrointestinales pertenecen al tercer grupo y que sólo un pequeño porcentaje son verdaderos leiomiomas o tumores de origen neural8. Esto seguramente generará gran controversia en el futuro próximo.
Pronóstico. La evaluación de su potencial maligno es con frecuencia difícil y aunque los criterios propuestos son múltiples, existe consenso en que el parámetro histológico más confiable es la tasa mitótica; también se consideran importantes el tamaño, la celularidad y la presencia de necrosis. Aunque hay múltiples propuestas sobre su clasificación, la más aceptada es: TGE benignos, menos de 5 mitosis por 50 HPF y menores de 5 cm; TGE límite, menos de 5 mitosis por 50 HPF y mayores de 5 cm. Se consideran malignos los tumores que tienen más de 5 mitosis por 50 HPF, de cualquier tamaño. Para algunos autores también son malignos los tumores altamente celulares independiente del número de mitosis. No hay consenso en la utilidad real de estos parámetros; estudios de seguimiento observan que ninguno de ellos es suficientemente consistente para predecir recurrencia o muerte 1-3, 7, 8, 15, 17-24.
En la búsqueda de parámetros confiables predictivos de pronóstico se propuso la utilización del índice PCNA que mide el patrón de crecimiento de las células tumorales mediante análisis inmunohistoquímico, utilizando anticuerpos contra antígenos nucleares celulares proliferativos (PCNA); infortunadamente estos antígenos son inestables y los resultados no han sido consistentes; actualmente se trabaja con otro método análogo denominado Ki-67. En los dos casos aún faltan estudios para determinar su utilidad8,17,18.
El patrón de ADN, en estudios por citometría de flujo, está significativamente relacionado con la clasificación histológica y con el pronóstico. Al parecer, ninguno de los tumores con ADN diploide hace recurrencia o metástasis. Aunque se necesita profundizar más en este campo, puede señalarse que el análisis de ADN debe utilizarse como un estudio complementario y no para determinar la malignidad de un tumor23-25.
Procedimientos diagnósticos. Los medios diagnósticos más utilizados son: radiografía con medio de contraste, ecografía, TAC, arteriografía, laparoscopia, gastroscopia y biopsia; se debe señalar que en los estadios tempranos el diagnóstico por biopsia endoscópica muchas veces puede ser fallido, ya que es difícil acceder a él a través de la mucosa; de allí la importancia de complementar el estudio con otros procedimientos diagnósticos. La TAC ha demostrado ser la de mayor utilidad ya que sugiere el diagnóstico en la mayoría de los casos19.
Evolución. Aunque el comportamiento de los TGE epitelioides no siempre es consecuente con su clasificación histológica, el 63% de las variantes malignas producen metástasis durante los 2 años siguientes al diagnóstico, localizadas más frecuentemente en el hígado y en las superficies peritoneales; pueden presentarse incluso hasta 30 años después de la resección del tumor primario1,8. La supervivencia a 5 años es de 56%. La invasión a órganos adyacentes y un gran tamaño se asocian a un peor pronóstico; se considera que tienen mal pronóstico los tumores aneuploides mayores de 6 cm y con más de 5 mitosis por HPF4,19,23,26.
El tratamiento de elección es la resección local, en cuña para las lesiones pequeñas, y la gastrectomía parcial para tumores grandes. Antes del estudio histopatológico, el cirujano puede intuir la naturaleza benigna o maligna de la tumoración, al observar su tamaño y la capacidad infiltrativa con compromiso de órganos vecinos y orientarse hacia una técnica resectiva de mayor o menor amplitud19. Sin embargo, cuando se trata de tumores malignos se ha observado que la gastrectomía subtotal no ofrece mayor supervivencia que la resección segmentaria si el tumor es completamente resecado8,23.
El caso que presentamos es extremadamente raro y constituyó un problema clínico ya que el tumor, por su ubicación exogástrica, logró desarrollarse asintomático hasta alcanzar gran tamaño; también fue difícil su clasificación morfológica debido a su presentación predominantemente quística, a su patrón histológico y a su estroma francamente mixoide. Consideramos que es fundamental establecer su histogénesis para orientar el probable comportamiento de estas neoplasias. Pese a que constituyen un problema quirúrgico infrecuente, deben tenerse en cuenta debido a su comportamiento errático, sus especiales características histológicas, en donde no se ha podido establecer una clara línea divisoria entre benignidad y malignidad, y a su capacidad de dar metástasis, aun con patrón histológico inocente; deben incluirse en el diagnóstico diferencial ante un paciente con sintomatología digestiva alta. Nuestra paciente a la fecha se encuentra asintomática y libre de recidiva.
Agradecimientos
Al Departamento de Patología del Instituto Nacional de Cancerología, en donde se realizaron las coloraciones de inmunohistoquímica.
Abstract
Gastric Stromal Tumors (GST) are rare entities which ordinarily pose diagnostic difficulties. We have studied a female patient that consulted at Hospital Universitario de San José, in the city of Popayán, Colombia, in 1997, because of a cystic intraabdominal tumor originating in the stomach but exhibiting exogastric growth. The hospital record and the pathology sections, including ordinary hematoxylin-eosin histochemical and immunochistochemical sections, were reviewed. The sections revealed a GST showing proliferation of cells of ephiteliod appearance with prominent myxoid stroma. Immunophenotyping confirmed myoid origin, alcian blue pH 2.5 was positive for mucosubstances in the stroma. Following intensive reviews and consultations, we point but the value of immnunophenotyping, which allows for adequate classification based on histogenesis, in an effort to establish prognosis and individualize treatment.
Referencias
1. Appelman H, Helwing E: Gastric Epithelioid Leiomyoma and Leiomyosarcoma (Leiomyoblastoma). Cancer 1976 Aug; 38 (2): 708-28
2. Evans H,: Smoth muscle: tumors of the gastrointestinal tract. A study of 56 cases followed for a minimum of 10 years. Cancer 1985; 56: 2242-50
3. Owen D: Stomach: Epithelioid tumors. Brooks J: Disorders of Soft Tissue: Smooth muscle lesions. In: Sternberg. Diagnostic Surgical Pathology, Volume 2. New York: Raven Press; 1989. p. 166-8 and p. 961-2
4. Ricci A, Ciccarelli O, Cartun R, Newcomb P: A Clinicopathologic and Immu-nohistochemical study of 16 patients with small intestinal leiomiosarcoma. Cancer 1987 Oct; 60 (8): 1790-9
5. Rosai J: Gastrointestinal tract: Stromal tumors. In: Ackerman’s Surgical Pathology 8th ed. St. Louis: Mosby; 1996. 645-7
6. Enzinger F, Weiss S: Epithelioid smooth muscle tumors. In: Soft Tissue Tumors, 2nd ed. St. Louis: Mosby; 1988S. 422-32
7 Sobrino SR, García BA, Pérez E, Abdo F: Leiomiosarcomas gástricos y leiomioblastomas. Rev Gastroenterol Mex 1995 Ene; 60 (1): 12-16
8. Miettinen M, Sarlomo M, Lasota J: Gastrointestinal stromal tumors: Recent advances in understanding of their biology. Hum Pathol 1999 Oct; 30 (10): 1213-20
9. Waldrep D, Morgenstern L, Alshak NS: The enigma of leiomyoblastoma: spectrum of a rare gastric tumor. Am Surg 1993 Apr; 59 (4): 256-60
10. Di Lorenzo N, Sica GS, Gaspari AL: Laparoscopic resection of gastric leiomyoblastoma. Surg Endosc 1996 Jun; 10 (6): 662-5
11. Lerner ME, Farman J, Cho K, Tyler I, Mullen D: Leiomyoblastoma: Varied CT appearance. Clin Imaging 1992 Jul; 16 (3):194-7
12. Choi BI, Ok ID, Mi JG, Han MC, Yu ES, Kim YI: Exogastric cystic gastric leiomyoblastoma with unusual TC appearance. Gastrointest Radiol 1988; 13 (2): 109-11
13. Sustere D, Moran CA: Gastrointestinal stromal tumors with prominent myxoide matrix. Am J Surg Pathol 1995; 19 (1): 59-70
14 Persson S, Kindblom L, Angervall L, et al: Metastasizing gastric epithelioid leiomyosarcomas (leiomyoblastomas) in young individuals with long-term survival. Cancer 1992 Aug; 70 (4): 721-732.
15. Sakurai S, Fukaawa T, Chong JM, Tanaka A, Fukayama M: Embryonic form of smooth muscle myosin heavy chain in gastrointestinal stromal tumor and intersticial cells of Cajal. Am J Pathol 1999 Jan; 154 (1): 23-8
16. Miettinen M, Virolainen M, Maarit-Sarlomo-Rikala: Gastrointestinal stromal tumors – value of CD34 antigen in their identification and separation from true leiomyomas and schwannomas. Am J Surg Pathol 1995 Feb; 19 (2): 207-16
17 Ghnassia JP, Wagner M, Velten M: Stromal tumors of the digestive tract. Prognostic evaluation of a series of 36 cases. Ann Pathol 1996; 16 (1): 27-32
18. Franquemont DW, Frierson HF: Proliferating cell nuclear antigen immunoreactivity and prognostic of gastrointestinal stromal tumors. Mod Pathol 1995 Jun; 8 (5): 473-7
19. Sanders L, Silverman M, Rossi R, Braasch J: Gastric smooth muscle tumors: Diagnostic dilemmas and factors affecting outcome. World J Surg 1996 Oct; 20 (8): 992-5
20. Ueyama T, Kawamoto K, Iwashita I, Masuda K, Haraguchi Y, Yosehida M: Correlation between tumor volume doubling time and histologic findings in gastric smooth tumor: clinical implications of tumor volume doubling time. J Surg Oncol 1995 Sep; 60 (1): 12-
21.Amin MB, Ma CK, Linden MD, Kubuss J, Zarbo RJ: Pronostic value of proliferanting cell nuclear antigen index in gastric stromal tumors. Correlation with mitotic count and clinical outcome. Am J Clin Pathol 1993 Oct; 100 (4): 428-32
22. Ma CK, De Peralta MN, Amin MB, Linden MD, Dekovich AA, Kubuss JJ, Zarbo RJ: Small intestinal stromal tumors: a clinic copathologic study of 20 cases with immunohistochemical assessment of cell differentiation and the prognostic role of proliferation antigens. Am J Clin Pathol 1997 Dec; 108 (6): 641-51
23. Lee JS, Nascimento AG, Farnell MB, Carney JA, Harmsen WS, Ilustrup DM: Epithelioid gastric stromal tumors (leiomyoblastomas): a study of fifty-five cases. Surgery 1995 Oct; 118 (4): 653-60
24. Shimamoto T, Haruma K, Sumii K: Flow Cytometric DNA analysis of gastric smooth muscle tumors. Cancer 1992 Oct; 70 (8): 2031-4
25. Tsushima K: Leiomyosarcoma and benign smoth muscle tumors of the stomach: Nuclear DNA paterns studied by flow cytometric. Mayo Clinic Proc 1987; 62: 275-80
26. Dorado J: Leiomioblastoma epitelioide gástrico. Presentación de dos casos y revisión de la literatura. Universitas Médica 1990; 31(2)113-7.
Correspondencia:
Myriam Bravo de Insuasty
Dpto. de Patología, Hosp. Univers. San José.
Carrera 6ª con Calle 9ª Norte. Popayán, Colombia.
MYRIAM BRAVO DE INSUASTY, patóloga, Profesora Asociada. Facultad de Ciencias de la Salud, Universidad del Cauca.
** ARTURO ADRADA, Cirujano General. Profesor Titular Facultad de Ciencias de la Salud, Universidad del Cauca, Popayán, Colombia.
*** JAIRO SANDOVAL, patólogo, Profesor Asistente. Facultad de Medicina, Universidad de Boyacá, Tunja, Colombia.
