E. MULETT, MD; C. MARTINEZ, MD, SCC; P. E. PABON, MD; J. ESCOBAR, MD.
Palabras clave: Tamización o tamizaje, Cáncer colorrectal, Rectosigmoidoscopia flexible, Marcadores celulares, Alteraciones genéticas.
Se evaluaron los pacientes sometidos a rectosigmoidoscopia flexible en el programa de chequeo médico del Hospital Militar Central durante el año de 1993. Sólo se tuvieron en cuenta los pacientes considerados de bajo riesgo y los que no tenían sintomatología colorrectal persistente. Se estudiaron 268 pacientes y éstos se dividieron en grupos según fueran menores o mayores de 45 años. No se observó diferencia significativa en el hallazgo de pólipos en los diferentes grupos de edad y no se encontró ningún caso de cáncer. Entonces queda a consideración del médico clasificar el riesgo de cada caso individual y considerar o no la necesidad de búsqueda de patología en estos pacientes.
Introducción
Uno de los grandes objetivos de la medicina, en la época actual, más que curar es el de prevenir la aparición o por lo menos detectar en una fase temprana las enfermedades neoplásicas.
Se han desarrollado métodos que van desde un simple tacto rectal dentro del examen clínico general, hasta las más sofisticadas técnicas de biología y/o genética molecular con el fin de detectar aquellas personas en las que se desarrollará cáncer colorrectal. El problema básico con que se enfrentan todas estas técnicas es el de evaluar su real utilidad en la balanza costo-beneficio.
En el Hospital Militar Central, como en algunas otras instituciones, se lleva a cabo un programa de chequeo médico en donde se incluye como parte de éste, una rectosigmoidoscopia flexible.
Decidimos entonces estudiar la población que durante 1993 acudió al Hospital para someterse a este programa, con el fin de evaluar en una población sana los hallazgos de una rectosigmoidoscopia flexible.
Materiales y Métodos
Se tomaron para el estudio las historias clínicas de los pacientes que estuvieron en el programa de chequeo médico durante el año de 1993, siendo sometidos a un interrogatorio dirigido a buscar sintomatología colorrectal y posteriormente se les practicó una recto sigmoidoscopia flexible. El total de pacientes fue de 268. Se tuvo en cuenta la edad, el sexo y, además, se preguntó acerca de antecedentes tipo sangrado rectal o cambios del hábito intestinal. Esta sintomatología debería de tener carácter ocasional, pues si el paciente presentaba alguna sintomatología persistente se excluía de la evaluación; también se excluyeron aquellas personas consideradas dentro de los grupos de alto riesgo para cáncer colorrectal.
Los pacientes ingresaban al hospital el día anterior al fijado para el chequeo general; por la noche tomaban 120 mL de leche de magnesia, como método para preparar la porción distal del colon; además, se aplicaban 2 enemas de fosfato (Travad) de 130 mL c/u, aproximadamente 2 y 1 horas antes del procedimiento. El examen se practicaba con un video- colonos copio marca Olympus™ y era realizado por alguno de los especialistas del servicio. No se utilizaba ningún tipo de sedación.
Como en estos programas de chequeo se incluía indiscriminadamente población de cualquier edad, se decidió hacer el estudio en la población general y, posteriormente, se dividió en menores y mayores de 45 años.
Resultados
En la población general, que fueron 268 pacientes, se encontró un promedio de edad de 49.8 (rango 24-86) años. El 70.8% fueron hombres y el 29.1 % mujeres. El 82.4% de los pacientes referían estar asintomáticos en el momento de la evaluación, el 15.6% tenían antecedentes de sangrado rectal ocasional y el 0.7%, cambios del hábito intestinal. El diagnóstico fue de pólipos en el 3.3% de los pacientes; de divertículos en el 6.7%, y de hemorroides internas en el 26.1 (k’. En el 63.8% de los pacientes no se encontró alteración alguna (Tabla 1).

En la evaluación de pacientes según fueran o no mayores de 45 años se encontró 10 siguiente:
En la población mayor de 45 años, 178 pacientes, el promedio de edad fue de 58.1 (rango 45-86) años. El 71.9% fueron hombres y el 28% mujeres. El 84.2% de los pacientes no referían sintomatología alguna; el 13.4% habían presentado sangrado ocasional y el 0.5%, alteraciones en el hábito intestinal. En el 56.1 % de los pacientes no se encontró alteración alguna; en el 9.5% se encontraron divertículos; en el 3.9%, pólipos y en el 30.3%, hemorroides internas (Tabla 2).

En la población menor de 45 años, 90 pacientes, el promedio de edad fue de 37.8 (rango 24-44) años. El 68.8% de los pacientes fueron hombres y el 31% fueron mujeres. El 78.8% de los pacientes estaban asintomáticos; el 20% tuvieron episodios de sangrado ocasional y el I.l % referían cambios del hábito intestinal. Los hallazgos fueron, un examen normal en el 78.8% de los pacientes; 17.7% tenían hemorroides internas; el 2.2% tenían pólipos y el 1.1%, divertículos (Tabla 3).

Discusión
El carcinoma colorrectal es una de las principales causas de muerte en los países occidentales. En Estados Unidos se diagnostican aproximadamente 140.000 casos nuevos cada año (1), Y en Inglaterra en 1988 fueron diagnosticados 31.000 nuevos casos (2). En Estados Unidos la probabilidad de sufrir cáncer colorrectal durante alguna época de la vida es del 6% (3). Además, a pesar de los avances en el tratamiento, de la disponibilidad de agentes quimioterapéuticos y de mejores técnicas de radioterapia, la mortalidad por cáncer colorrectal es esencialmente la misma durante los últimos 50 años (4). El cáncer familiar sólo corresponde a un 6% (5), quedando la inmensa mayoría de la población expuesta a este riesgo.
Tradicionalmente hemos seguido las recomendaciones de la Sociedad Americana de Cirujanos de Colon y Recto (3-8) y de la Sociedad Americana de Cáncer para detección temprana en personas asintomáticas (6, 7), de acuerdo con la edad:
1. Mayores de 40 años: Tacto rectal anual. Sangre oculta en materia fecal (FOBT) anual.
2. Mayores de 50 años: FOBT anual y sigmoidoscopia preferiblemente flexible cada 3-5 años.
A pesar de estas recomendaciones, a nuestros hospitales continúan llegando pacientes, en su mayoría en estados avanzados de cáncer colorrectal, en quienes la posibilidad de curación es prácticamente ninguna. Desafortunadamente el sangrado, que es el principal signo y el que generalmente motiva el estudio del paciente, no siempre está presente, incluso en casos con tumores avanzados, o el sangrado solamente es intermitente (2). El problema no es pues los grupos de alto riesgo, constituidos por los pacientes con historia de cáncer de endometrio, ovario, seno, radiación pélvica, poliposis familiar adenomatosa, pancolitis ulcerosa de 7 o más años de duración, colitis ulcerosa del colon izquierdo de más de 15 años de duración o colitis de Crohn de más de 15 años de duración; pacientes con historia de pólipos adenomatosos o con historia familiar o personal de cáncer colorrectal (3-8), quienes deben ser sometidos a estudio endoscópico completo del colon cada 1- 3 años.
El objetivo es tratar de identificar aquellos pacientes con tumores esporádicos que ocurren en aproximadamente 85-90% de los casos (2) y aquellos pacientes con pólipos adenomatosos, considerados precursores de cáncer colorrectal (9).
Para identificar esta gran proporción de pacientes, se han desarrollado diferentes métodos de tamizaje. El objetivo de éste debe ser el de mejorar la sobrevida, si la detección ocurre en un punto de la historia natural del cáncer cuando la enfermedad pueda responder a la intervención terapéutica. Además, el aumento de la sobrevida no debe ser opacado por la morbilidad potencial de la prueba (1-10). Algunos han llegado hasta considerar el cáncer colorrectal como “prevenible” o previsible, si identificamos su estado premaligno, el pólipo adenomatoso (11), lo que llevaría a mejorar las tasas de sobrevida (12).
Cualquier método de tamizaje debe tener algunas características que lo lleven a comprobar o no su utilidad en la búsqueda de determinada patología. La sensibilidad, que refleja la proporción de personas con neoplasias colorrectales que son correctamente identificadas por el examen. La especificidad, que refleja la proporción de individuos sin neoplasias colorrectales en quienes la prueba es negativa: la sensibilidad de una prueba debe ser alta (>90%); la especificidad no debe ser tan alta, pero entre más baja sea, mayor es el número de investigaciones innecesarias hechas por falsos positivos (1). Hay que tener en cuenta también la aceptación de las personas para una determinada prueba.
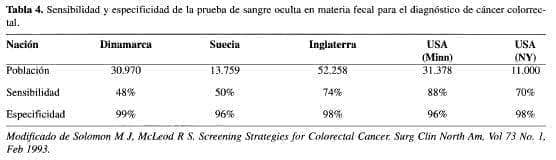
La búsqueda del método adecuado para el tamizaje se ha iniciado con la investigación de sangre oculta en la materia fecal, basados en la premisa de que los pólipos y los tumores colorrectales sangran. Hay diferentes métodos, como el Hemoccult ™ (Smith Kline Diagnostics), que se basa en la reacción de guayaco (13) para detectar la peroxidasa de la hemoglobina; se requieren al menos 20 mL por día de sangrado para obtener un resultado positivo (14, 15). Otro tipo diferente es el HomoQuant™ (Smith Kline Diagnostics), que detecta la molécula de porfirina de la hemoglobina (15). Se han desarrollado otros exámenes basados en inmuno ensayo que están todavía en estudio y que no se ha comprobado su real eficacia (14, 15). De los estudios realizados con FOBT, sólo el estudio de la Universidad de Minnesota (16) ha demostrado una reducción del 33% en la mortalidad por cáncer colorrectal en placas rehidratadas; a los pacientes con resultados positivos se les hizo colonoscopia. El uso extensivo de la colonoscopia en pacientes con prueba positiva, teniendo en cuenta que la rehidratación puede aumentar la positividad de aquella, pudo haber contribuido a la detección de lesiones no sangrandes, y la extirpación de pólipos también pudo contribuir a la disminución de la mortalidad. En los otros estudios realizados no se ha logrado una significativa reducción en la mortalidad por cáncer (Tabla 4).
La rectosigmoidoscopia flexible se ha propuesto también como método de tamizaje, con base en que alrededor del 70% de los tumores ocurren en el sigmoide y el recto (2, 17). Es más costosa e invasora que la sangre oculta, pero algunos estudios muestran que hay una reducción en la mortalidad por cáncer colorrectal distal hasta en un 70-90% en pacientes que fueron sometidos a tamizaje con sigmoidoscopia (10, 18), siendo la detección de cáncer de 0.2% y la de adenomas de 11% en personas asintomáticas (19). Otros estudios muestran una reducción del 59% en la mortalidad respecto a la zona examinada y sugieren que un programa de búsqueda con rectosigmoidoscopia flexible puede reducir la mortalidad general hasta en 30% (20). La recomendación de la sigmoidoscopia como tamizaje, está basada en que tiene una alta sensibilidad para cánceres tempranos y adenomas (21), Ya la reducción de la mortalidad que se ha encontrado en algunos estudios (20). Sin embargo, también está la consideración de que aun la endoscopia flexible hasta 60 cm puede perder las lesiones situadas proximal mente (10, 15); además, es necesario verificar también la aceptación de los pacientes a este tipo de examen (22).
El colon por enema de doble contraste, tiene su papel principal como método complementario a la rectosigmoidoscopia flexible (11, 23) Yno como estudio primario en el tamizaje del paciente asintomático para cáncer colorrectal. A pesar de poder diagnosticar cáncer, la relativa baja capacidad para detectar pólipos y la necesidad de evaluar los resultados dudosos con colonoscopia incrementarían los costos del examen (24).
En cuanto al tamizaje con colonoscopia, comúnmente ha sido rechazado debido a que es un procedimiento invasor, costoso, que requiere de la experiencia del examinador y que presenta una baja aceptación por parte de los pacientes; además, siempre está presente el riesgo de hemorragia o perforación (1, 25). Tiene un riesgo variable de no identificar algunos pólipos, de 10-30% en algunos estudios (12, 26), concediéndole en otros hasta un 95% de efectividad (17) siendo, sin embargo, considerada como el examen más sensitivo y específico para la detección de la patología colónica (27), sumándole la ventaja de poder extirpar los pólipos en el momento del diagnóstico (lO, 12). Algunos autores proponen un esquema consistente en una colonoscopia a la edad de 60-65 años; si no se encuentran adenomas ni cáncer, la persona es considerada como de muy bajo riesgo y no es necesario continuar con ningún seguimiento (15). Con la colonoscopia se pueden identificar hasta el 95% de los pacientes con lesiones, y con los otros métodos actuales sólo el 50% (27). Infortunadamente, mientras los costos de la colonoscopia sean altos, ésta no se puede utilizar como método de tamizaje masivo para la población (1).
El futuro del tamizaje está en la genética, con la cual podremos identificar con anterioridad la predisposición a sufrir cáncer (7, 11, 18, 28) o también, con la identificación de alteraciones en la proliferación celular o de marcadores tisulares (29).
En nuestra revisión encontramos sólo un pequeño grupo de pacientes con diagnóstico de pólipos, observando que no hubo diferencia en la comparación de pacientes mayores de 45 años y la población general. A pesar de esto, la edad es el único parámetro en que nos podríamos basar para iniciar la búsqueda en pacientes asintomáticos, haciendo así un uso racional de los métodos diagnósticos.
Conclusión
El objetivo del tamizaje o tamización es disminuir la mortalidad por una patología determinada. Aún no se ha definido el mejor método de tamizaje para el cáncer colorrectal. Algunos sugieren que este procedimiento sólo debe estar dirigido a las poblaciones de alto riesgo debido a los elevados costos que se generan al aplicarlo a la población general. Queda por evaluar la aplicabilidad de los marcadores celulares y la identificación de alteraciones genéticas para el diagnóstico de los casos esporádicos, quedando también a criterio del médico tratante clasificar el riesgo en cada caso particular y la necesidad o no de la búsqueda deseada.
Abstract
We analyzed the records of al! patients that underwent flexible sigmoidoscopy at the Central Military Hospital during the year 1993. The study included only those patients considered to be of low risk and those free of persistent colorectal symptomatology. The group, amounting to 268 patients, was divided in two subgroups: patients younger than 45 years of age, and patients older than 45 years. No significant difference was found in the two groups pertaining to the finding of polyps, and no cancers were identified. Thus, it behooves the clinician to classify the risk of each individual patient and to consider the search for pathology in selected patients.
Referencias
1. Solomon M J, McLeod R S: Screening strategies for colorectal Cancer. Surg Clin North Am 1993 Feb; 73(1): 31-45
2. Austoker J: Screening for colorectal cancer. BMJ 1994 Aug; 309 (6951): 382-6
3. The American Society of Colon and Rectalb Surgeons. Practice Parameters for the Detection of Colorectal Neoplasms. Dis Colon Rectum 1992 Apr; 35(4): 389-90 4. Dunlop M G: Screening for large bowel neoplasms in individuals with a family history of colorectal cancer. Br J Surg 1992 Jun; 79(6): 488-94
5. Bazzoli F, Fossi S, Sttili S et al: The Risk of Adenomatous Polyps in Asymptomatic First-Degree Relatives ofPersons With Colon Cancer. Gastroenterology 1995 Sep; 109(3): 783-8
6. Guillem J G, Forde K A, Treat M R et al: Colonoscopic Screening for Neoplasms in Asymptomatic First-Degree Relatives of Colon Cancer Patients. A Controlled, Prospective Study. Dis Colon Rectum 1992 Jun; 35(6): 523-9
7. Levin B, Murphy G P: Revision in American Cancer Society Recommendations for the Early Detection of Colorectal Cancer. CA 1992 Sep; 42(5): 296-9
8. The Standars Task Force American Society of Colon and Rectal Surgeons. Practice Parameters for the Detection of Colorectal Neoplasms-Supporting Documentation. Dis Colon Rectum 1992 Apr; 35(4); 391-4
9. Winawer S J, Zauber A G. O’Brien M J; Randomized Comparison of Surveillance Intervals After Colonoscopic Removal of Newly Diagnosed Adenomatous Polyps. N Engl J Med 1993 Apr; 328(13): 901-6
10. Warden M J, Petrelli N J, Herrera L et al: The Role of Colonoscopy and Flexible Sigmoidoscopy in Screening for Colorectal Carcinoma. Dis Colon Rectum 1987 Jan; 30( 1): 52-4
11. Lieberman D: Screening/Early Detection Model for Colorectal Cancer. Why Screen’) Cancer (Suppl) 1994 Oct; 74(7): 2023-7
12. Wameke J. Petrelli N, Herrera L et al: Accuracy of Colonoscopy for the Detection of Colorectal Polyps. Dis Colon Rectum 1992 Oct; 35(10): 981-5
13. Carlson U, Ekelllnd G. Rutger E et al: Evaluation of Possibilities for Mass Screening ror Colorectal Cancer with Hemoccult Fecal Blood Test. Dis Colon Rectum 1986 Sept; 29(9): 553-7
14. Robinson M H E, Marks C G. Farrands P A et al: Screening for colorectal cancer with an immunological faecal occult blood test: 2-year follow-up. Br J Surg 1996; 83:500-1 15. Ransohoff D F. Lang C A: Screening For Colo rectal Cancer. N Engl J Med 1991 Jul;325 (1): 37-41
16. Mandel J S. Bond J H, Church T R et al: Reducing Mortality from Colorectal Cancer by Screening for Fecal Occult Blood. N Engl J Med 1993 May: 328(19): 1365-71
17. Nivatvongs s: Diagnosis. In: Gordon P H, . Nivatvongs S. eds. PrincipIes and Practice of Surgery For the Colon, Rectum and Anus. Q M p. St Louis, 1992. pp. 81-117
18. Lieberman D: Colon Cancer Screening: Beyond Efficacy. Gastroenterology 1994 Mar: 106 (3): 803-12
19. Rcx D K, Glen A L. Ulbright T M et al: The Yield of a Second Screening Flexible Sigmoidoscopy in Average-Risk Persons after One Negative Examination. Gastroenterology 1994 Mar; 106(3): 593-5
20. Selby J V, Friedman G D, Quesenberry C P ct al: A Case-Control Study of Screening Sigmoidoscopy and Mortality from Colorectal Cancer. N Engl J Med 1992 Mar: 326( l O): 653-7
21. Ransohotl D F, Lang C A: Sigmoidoscopic Screening in the 1990·s. JAMA 1993 Mar; 269( 10: 1278-81
22. Robinson M H E. Berry D P. Vellacott K D et al: Screening for colorectal cancer. Lancet 1993 Jul; 342: 241
23. Stewart E T: Air-Contrast Barium Enema Technique. In: Cohen A M. Winawer S J. Friedman M A et al, eds: Cancer of the Colon, Rectum and Anus, Mc Graw Hill, New York, 1995. pp: 319-43.
24. Lieberrnan D A: Cost-effectiveness Model ror Colon Cancer Screening. Gastroenterology 1995 Dec; 109 (6): 1781-90
25. Atkin W S. Cllzick J: Screening for colorectal cancer. Lancet 1993 Jun; 341: 1667
26. Vatn M H: Screening for colorectal cancer. Lancet 1993 May; 341: 1279
27. Liebennan D: Screening Colonoscopy. Has the time comc’) Gastrointest Endosc C¡in North Am 1993 Oct; 3(4): 673-82
28. Lynch H T. Smyrk T, Lynch J et al: Genetic Counseling in an Extended Attenuated Familial Adenomatous Polyposis Kindred. AJG 1996 Mar; 91 (3): 455-9
29. Lev R: Screening. Surveillance. and Risk Factors for Colon Neoplasia. Gastroenterology 1994 Ocl: 107(4): 1213-5
Correspondencia:
Edelberto Mulett. Hospital Militar Central. Carrera 5 No. 49-00. Santafé de Bogotá, D. C.
Doctores: Edelberto Mulett Vásquez, Ciruj. Gral. Resid. De Coloproctol.; Carlos Martínez Jaramillo, Ciruj. Coloproctólogo, Jefe del Servo de Coloproctol.; Pedro Enrique Pabón Páez, Ciruj. Coloproctólogo; Jaime Escobar Cardona, Cirujo Oncólogo, Instructor del Servo de Coloproctología, Hosp. Militar Central, Univer. Militar Nueva Granada, Santafé de Bogotá, Colombia.
