Informe de 1 caso y Revisión de la Literatura
P. YUGUEROS, MD; J. M. SARMIENTO, MD; R. FERRADA, MD, SCC.
Palabras claves: Síndrome pospericardiotomía, Trauma precordial, Hemopericardio, Efusión pericárdica, Ventana pericárdica subxifoidea, Taponamiento cardíaco.
Se define el síndrome pospericardiotomía y se califica una entidad infrecuente. Se presenta 1 caso documentado de este estado patológico, diagnosticado en un hombre de 25 años de edad quien había sufrido una herida con arma cortopunzante en el área precordial.
Se discuten aspectos históricos, etiológicos, fisiopatológicos, clínicos, paraclínicos, diagnósticos, terapéuticos y anatomopatológicos del síndrome pospericardiotomía.
Por último, se transcriben 21 referencias bibliográficas nacionales e internacionales sobre el tema.
Introducción
El síndrome pospericardiotomía (SPP) es una entidad infrecuente en la práctica clínica. Desde su descripción en 1928 por Cox (1) hasta su reconocimiento con el nombre que hoy lleva, otorgado por Dresdale en 1956 (1), se ha asociado a otros síndromes parecidos pero de etiología diferente (p.e. el Sínd. de Dressler que es una pericarditis posterior a un infarto agudo del miocardio).
Presentación de 1 Caso
El siguiente caso ilustra esta patología, que en nuestro medio tiene su mayor asociación con el trauma.
H. C. W 1157026 del HUV.
Paciente de sexo masculino de 25 años, quien recibió una herida por arma cortopunzante en el área precordial en nivel del 5° espacio intercostal izquierdo, línea medioclavicular. Fue sometido a la práctica de una ventana pericárdica subxifoidea (VPS), cuyo resultado fue negativo (líquido claro en saco pericárdico).
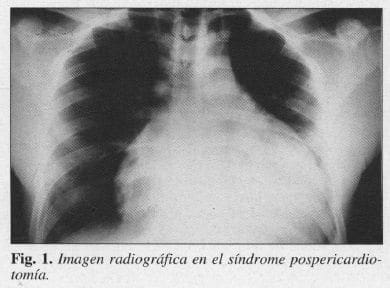
Dos meses después, consultó por disnea de pequeños esfuerzos, ortopnea y disnea paroxística nocturna. La radiografía del tórax mostró un corazón abalonado (Fig. 1), por lo que se le hizo pericardiocentesis la cual drenó 100 ml de líquido serohemático. Se le dio salida con prescripción de indometacina oral (75 mg/d). Diez días después la sintomatología reapareció y se auscultaron ruidos cardíacos de baja intensidad con arritmias.
Nuevamente se le realizó pericardiocentesis que drenó 450 rnL. Por mejoría clínica se le dio salida con indicación de indometacina.
Se le realizó un ecocardiograma 12 días después, que mostró signos de taponamiento cardíaco. Sin embargo, por su buen estado clínico, se le dio salida con el mismo medicamento.
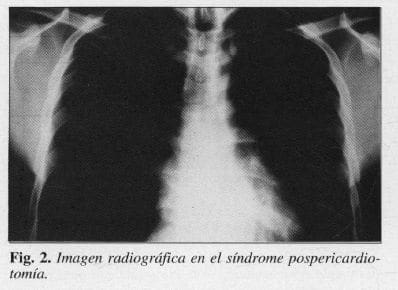
Un mes más tarde reapareció la sintomatología inicial por lo que se practicó VPS a través de la cual se extrajeron 2000 mL de líquido. seroso. Se dejó un tubo intrapericár dico que se retiró al 4° día, cuando dejó de drenar. Se dio de alta por evolución satisfactoria; la radiografía del tórax fue normal (Fig. 2).
La biopsia del pericardio mostró fibrosis y hemorragia antigua.
Discusión
Hipócrates describió el pericardio como “un manto liso que rodea el corazón y contiene una pequeña cantidad de líquido que recuerda la orina”, (2) que sirve para proteger el corazón y proveerle soporte.
En 1699 Lower documentó el primer caso de taponamiento cardíaco como consecuencia de acumulación de líquido intrapericárdico (2).
Desde 1982 se viene utilizando sistemáticamente la ventana pericárdica subxifoidea (VPS), como método diagnóstico de lesión cardíaca en pacientes con heridas en el área precordial (3). En una revisión posterior de 5 años, entre 328 pacientes a quienes se les practicó VPS, sólo uno de ellos presentó pericarditis como complicación posquirúrgica, mostrándose ésta como hallazgo infrecuente de este procedimiento (4).
El SPP se ha descrito como complicación de la cirugía cardíaca, ya sea por la apertura del pericardio y/o miocardio, o por la acumulación de sangre dentro de aquel, teorías aún no comprobadas (5).
Experimentalmente se ha producido SPP mediante inyección de grasa en la cavidad pericárdica (6). Se dice que el 30% de los pacientes a quienes se les hacía cirugía de corazón desarrollaban SPP (2, 7); sin embargo, en nuestro medio sólo se le ha hecho seguimiento a pacientes con VPS, encontrándose un porcentaje menor del 1% (4).
Engle y col, informaron la presencia de anticuerpos antimiocardio en los pacientes con SPP (8), pero posterior mente se encontró que no todos ellos tenían dichos anticuerpos (9). Más tarde Engle postuló otra teoría en la cual se involucraban los virus como agentes causales, propuesta que no tuvo mayor acogida (10).
Los pacientes con SPP’ evolucionan con fiebre, malestar general, dolor pleurítico y disnea, teniendo como antecedente cirugía cardíaca o de pericardio (VPS), y el 50% de ellos con frote pericárdico (11). Los exámenes de laboratorio muestran casi invariablemente leucocitosis y aumento de la velocidad de eritrosedimentación. Generalmente el EKG muestra cambios de bajo voltaje. Usualmente la radiografía del tórax confirma el diagnóstico cuando muestra cardiomegalia, como ocurrió en el paciente que nos ocupa.
Stevenson y col, no aconsejan la radiografía como método de tamizaje en pacientes posquirúrgicos para diagnóstico de SPP por su falta de especificidad (12). Además, más del 50% de los pacientes en el posquirúrgico tienen efusiones pericárdicas detectables mediante la radiografía o la ecografía y sólo un porcentaje muy bajo llegan al taponamiento cardíaco (13). Por eso tampoco se recomienda la ecografía rutinariamente en el posoperatorio (13), reservándose solamente para aquellos casos que tengan clínica sugestiva de SPP (12). Puntualizando lo anterior, Weitzman y col, consideran que la sintomatología del paciente posquirúrgico es variable e independiente del tamaño de la efusión pericárdica (13).
La ecocardiografía es un excelente método diagnóstico cuando hay sospecha de SPP (13, 14); no es invasiva, tiene pocos falsos positivos (15, 16) Y raros falsos negativos.
Recientemente Bufalino y col, recomendaron la gamagrafía con galio 67 como una excelente ayuda para el diagnóstico de esta entidad (9).
Un 15-32% de los pacientes desarrollaron cuadros recurrentes de clínica similar al episodio inicial (5). Fowler ha definido esta entidad como una pericarditis recurrente, la cual hace parte de SPP y cumple 3 criterios para su definición (5):
1. Ausencia de enfermedad sistémica, carcinoma o infección.
2. Ataque original confirmado por clínica, EKG o ECO.
3. Ataques recurrentes en los 3 primeros meses.
Las complicaciones de esta entidad son infrecuentes. Entre ellas se mencionan la pericarditis constrictiva, la enfermedad miocárdica y el taponamiento cardíaco. Este último se presenta tardíamente (17) y con una frecuencia entre el 0.1 y 1.3% (18).
El tratamiento de esta patología se inicia con medidas farmacológicas, siendo la elección los AINES tipo indometacina, ASA o ibuprofén, por un período de 2 a 3 semanas.
Si el paciente continúa con sintomatología, se inician esteroides hasta llegar a 60 mg/día de prednisona, terapia que debe ser de corta duración por sus efectos secundarios y porque pueden prolongar las recurrencias (5).
De la Serna y col, informan de los beneficios de la terapia con colchicina, sin que se encuentren otras menciones posteriores en la literatura (19).
Cuando estas medidas son insuficientes para el control de la entidad se debe realizar pericardiectomía sin ser sus resultados completamente satisfactorios.
Cuando la efusión pericárdica es mayor, hay grupos que prefieren realizar procedimientos intermedios. Little y col, realizan VPS dejando 2 tubos en la cavidad pericárdica (anterior y posterior) por 3 a 5 días, buscando que se formen adherencias entre las dos hojas pericárdicas para evitar así la reacumulación de líquidos (20). Este procedimiento sería una aplicación al SPP del tratamiento de las efusiones pericárdicas no relacionadas con cirugía, como se realizó en el paciente que se presenta.
Existen otros métodos para drenaje del pericardio tales como la pericardiocentesis (de poco uso actual), la ventana pleuropericárdica y la ventana pericardioperitoneal. Las dos últimas establecen una comunicación definitiva entre las cavidades para el drenaje continuo de la efusión pericárdica.
El examen microscópico de la biopsia de pericardio solo muestra fibrosis e inflamación (5).
Abstract
A case a 25-year old patient suff’ering from a precordial chest stah wound and treated with a suh-xyphoid pericardial window who later developed post-pericardiotomy syndrome is presented. Yjis rather infrequent condition is reviewed, analyzing its historiad, etiological, physiopathological, c1inical, paraclinical, therapeutical aspects; also transcrihing twenty-one national and international references.
Agradecimientos
Al doctor Luis Felipe Rivas, por su colaboración en el manejo y la revisión de este caso.
Referencias
l. Ebert P A: Postpericardiotomy Syndrome. In: Gibbon’s Surgery of the chest. Edited by Sabiston DC & Spencer Fe. W. B. Saunders Con. 19X3. pp. 1006-8
2. Cunninghan J N. Spencer F C. Zcll R et al: Inlluence of primary elosure of the periciardium after open-heart Surgery on the frequency of tamponade. postcardiotomy Syndrome. and pulmonary complications. J Thorac Cardiovasc Surg 1975: 70: 119-25
3. Pérez M V. González A. Rubiano J: Experiencia con la ventana pericárdiea para el diagnóstico de las lesiones precordiales. HUV 1983-1987; Colombia Méd 1988: 19: 142-4
4. Pérez M V. González A. Rubiano J: Experiencia con la ventana pericárdica para el diagnóstico de las lesiones precordiales. HUV 19X3-19X7: Colombia Méd 1988: 19: 142-4
5. Fowler N O: Recurrent Pericarditis. Cardiology Clinies 1990: 8: 621-6
6. Ehrenhaft J L. Taber R E: Hcmopericiardium amI Constrictive Pcricarditis. J Thorac Surg 1952: 24: 355-8
7. Roses D F, Rose M R. Rapaport F T: Febrilc response associated with cardiac Surgery Relation ships to lhe post host immunologic reaetivity, J Thorac
Cardiovasc Surg 1974: 67: 251-5
8. Engle M A. McCabe T L. Ebert P A et al: The postpericardiotomy Syndrome and anti-heart entibodies Circulation 1974: 49: 401-5
9. Bufolino V 1, Robinson S A, Henkin R: Gallium-67 Scanning: A new diagnostic approach to the postpericardiotomy syndrome. Am Heart J 1983; 106: 1138-43
10. Engle M A. Zabriskie J B. Senterfit L Bet al: Viral illness and the postpericardiotomy Syndrome. A prospective study in children. Circulation 198O: 62: 1151-8
1l. Shabetai R: Enfermedades específicas del pericardio. En: Pericardio. Editado por Shahetai R. 1984. pp. 286-327
12. Stevenson L W, Child J S, Laks H et al: Incidence and signifieanee of early pericardial effusions afler cardiac surgery. Am J Cardiol 1984: 54: 848-51
13. Weitzman L B, Tinker W P, Kronzon I et al: Ineidenee and natural history of perieardial effusion afler cardiae surgery and echocardiographic study. Circulalion 1984; 69: 506-1 1
14. Horowitz M S, Schulta C S, Stinson E B et al: Sensitivity and specificiity of echocardiographie diagnosis of pericardial effusion. Circulation 1974: 50: 239-
15. Feigenbaun H: Ultrasonic cardiology diagnostic ultrasound as an aid to the management of patients with pericardial effusion. Dis Chest 1969; 55: 59-65
16. Fooke W C, Jefferson C M, Price H L: False-positive eehoeardiographic diagnosis of pericardial effusion. Chest 1977: 71: 546-50
17. Ofori-Krakye S K, Tyberg T I. Geha A S et al: Late eardiae tamponade afler open heart-surgery: incidence. role of anticoagulants in its pathogenesis and its relatioship to the post-pericardiotomySyndrome, Circulation 19X7: 63: 1323-8
18. Porkin A M. Schaff H V, Gardner T J et al: Diagnosis and management of postoperative perieardial effusions and late cardiac tamponade following open-heart surgery. Ann Thorac Surg 1981; 31: 512-9
19. De la Serna A R. Soldevila J G. Claramunt V M et al: Colchicine for reeurent pericardits. (Letter) Lancet 1987: 2: 1517
20. Little A G. Kremser P C. Wade J L et al: Operation for diagnosis and tratment of pericardial effusions. Surgery 1984: 96: 738-44
21. Dabir R. Warren S E: Drainage of Perieardial effusions using the peritoneal and pericardial window lechnique. Surg Gyneeol Obstet 1984; 159: 485-6
Doctores: Patricia Yugueros, R-IlI; Juan Manuel Sarmiento, R-IV; Ricardo Ferrada, Pro! Titular, Jefe de la Unid. de Trauma y Quemados, Dpto. de Cirug. Gral., Univ. del Valle, Cali, Colombia.