La supraglotis cuenta con una red linfática muy rica la cual continúa en troncos que atraviesan el espacio pre-epiglótico y la membrana tirohioidea terminando principalmente en los nodos linfáticos del nivel II, con unos pocos troncos que drenan directamente a la vena yugular interna en su tercio medio, nivel III (19).
Los pliegues vocales no tienen esencialmente linfáticos capilares, por lo que solo se presentan metástasis en los tumores glóticos cuando hay extensión a la supraglotis o a la subglotis (19).
El área subglótica tiene escasos capilares linfáticos los cuales drenan por troncos que atraviesan la membrana cricotiroidea a los nodos pretraqueales. También existe drenaje posterior hacia la membrana cricotraqueal con troncos hacia los paratraqueales.
Dichos nodos terminan en la vena yugular interna en el tercio inferior, nivel IV (19).
La distribución de las metástasis del área supraglótica en pacientes con cuello N0 es: 48% nivel lI, 38% nivel lII, 10% paratraqueales y 5% al nivel IV (1).
Analizando también la distribución de las metástasis en los pacientes con cáncer de la región glótica, se puede observar 55% al nivel II, 27% al nivel III y 18% a los ganglios paratraqueales (1).
Los tumores únicos de la región subglótica son inusuales, especialmente en nuestro medio. Cuando el paciente consulta estas lesiones presentan compromiso de la glotis y supraglotis.
Por lo anterior, se puede inferir que la mayoría de los pacientes con lesiones laríngeas avanzadas y cuello N0 pueden tener metástasis ocultas a los niveles II, III, IV y VI del cuello; por lo cual se hace imperativo, dentro del tratamiento quirúrgico del mismo, considerar la disección ganglionar funcional o selectiva.
Imagenología preoperatoria
En el meta-análisis realizado por el Dr. Merrit en 647 disecciones de cuello, se comparó la sensibilidad del examen físico y de la tomografía axial computadorizada (TAC) de cuello para detectar metástasis en pacientes con lesiones escamocelulares de cabeza y cuello (19).
Se definen las lesiones sospechosas por la tomografía de acuerdo con el tamaño del nodo mayor de 15 mm, evidencia de necrosis central, extensión extranodal o nódulos múltiples en promedio 8 a 10 mm en diámetro mayor (21).
Si se compara la sensibilidad de la TAC que es del 83%, con el examen físico 74%, así como la especificidad 83% para la primera y 81% para el segundo, se puede observar una diferencia no significativa, sin embargo, uniendo los dos métodos de evaluación la efectividad puede subir hasta el 91% (18).
El factor pronóstico más importante en carcinoma escamocelular de cuello es la presencia de metástasis ganglionares; cuando están presentes baja al 50%.
Es importante practicar la TAC preoperatoriamente para analizar la laringe y los compartimentos del cuello; si existe duda diagnóstica se recomienda la aspiración por aguja fina (AAF) dirigida con ecografía, ya que ésta puede detectar nodos menores de 3 mm (2).
Factores de riesgo para metástasis ganglionares
El tratamiento profiláctico del cuello en tumores del tracto aerodigestivo superior es necesario en N0 si el riesgo es mayor al 20%. En tumores supraglóticos T3-T4, las metástasis ipsilaterales son del 50%, y en los localizados en la subglotis se presentan a nivel del grupo VI (13).
Los principales factores de riesgo para metástasis ocultas son:
A. Clínicos:
– Tamaño tumoral: Los T3-T4 tienen mayor probabilidad de presentarlas
– Tipo macroscópico: Los que se encuentran ulcerados se asocian a sobreinfección y por consiguiente embolización tumoral
– Extensión tumoral: A cartílago, hueso y tejidos blan-dos extralaríngeos, aumentan las posibilidades de metástasis regionales
B. Patológicos
– Grado histológico: Los mal diferenciados son más agresivos localmente
– Invasión vascular y perineural: Hasta el 77% de los casos que las presentan pueden asociarse a enfermedad nodal positiva (2,15)
– Grosor tumoral: Lesiones con profundidad mayor a 2 – 4 mm tienen incidencia del 40% de metástasis ganglionares (2,15)
Tratamiento del cuello no
El objetivo en el tratamiento del cuello clínicamente negativo depende del riesgo de metástasis. También es importante analizar los factores pronósticos dependientes de los hallazgos patológicos en la disección de cuello, como son la invasión extracapsular del ganglio comprometido o el número de ellos positivos con enfermedad (9, 10).
La probabilidad de recaída regional aumenta si existe algún nodo con invasión extracapsular, al igual cuando se encuentran comprometidos más de dos nodos con supervivencia a cinco años del 30% solamente. Algunos autores sostienen que el pronóstico es menor cuando el compromiso de ganglios se presenta en los niveles bajos del cuello (14).
Cuando se inicia el tratamiento del cuello negativo surgen los siguientes interrogantes:
– ¿Qué pacientes cuello negativo pueden tener células tumorales en los ganglios?
– ¿Qué pacientes cuello negativo podrían desarrollar enfermedad clínica?
– ¿Cuántos pacientes con enfermedad clínica ganglionar morirán por la enfermedad?
– ¿Qué tipo de tratamiento es más efectivo y de menor morbilidad? ( 3, 8)
Una vez se han resuelto los anteriores, existen otros factores como son los:
– Dependientes del tumor eligiendo el mismo tratamiento para el primario como para el cuello.
– Dependientes de la experiencia del médico tratante para realizar cirugía o radioterapia.
– Dependientes del paciente: Tales como la edad, estado general, soporte de la familia, rehabilitación y expectativas del mismo (3).
A. Laringe supraglótica
La localización de las lesiones en los diferentes subsitios de la laringe tiene marcada importancia en el pronóstico. Los tumores de la zona marginal, repliegue ariepiglótico y epiglotis suprahioidea, tienen un comportamiento más agresivo con mayor número de metástasis ganglionares homolaterales y contralaterales. Los carcinomas del área supraglótica tienen la más alta frecuencia de metástasis oculta en relación con el resto de la laringe, la cual es del 30% (1).
Usualmente el compromiso es de los niveles II, III, IV, siendo muy escaso el de los niveles I y V, menor del 5%. Es por eso que se recomienda el manejo del cuello con disección radical modificada profiláctica homolateral y selectiva contralateral de los niveles II, III, IV, además de la disección del nivel VI (3).
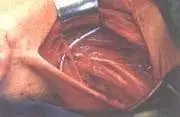
Foto 2. DRMC tipo III. Se preserva nervio espinal, vena yugular interna y músculo esternocleidomastoideo
B. Laringe glótica
La tasa de metástasis para los carcinomas T1 y T2 es menor al 7%, sin embargo, en los recurrentes aumenta hasta el 22%. En los estadios T3, T4 puede presentarse una incidencia entre el 16% y el 40% (3,14).
En los T1, T2 es pertinente observar el cuello y manejarlo con radioterapia dependiendo del tratamiento instaurado para el primario en los tumores T3, T4 disección anterior de cuello acompañada de disección radical modificada homolateral, debido a que la gran mayoría de ellos se encuentran con extensión hacia la supraglotis (1, 3).
C. Laringe subglótica
Esta presentación del carcinoma laríngeo es poco usual, del 1% al 8% y se disemina hacia afuera de la laringe a través de los nodos prelaríngeos, pretraqueales, paratraqueales y del mediastino superior, por lo que es necesario retirar la laringe en conjunto con la hemitiroides homolateral al tumor, y los ganglios del nivel VI. La disección homolateral del cuello es recomendada del tipo modificado y selectivo contralateral de los niveles II, III, IV (1, 3, 6, 8).
En todos los casos de disección selectiva, si se encuentran adenopatias altamente sospechosas, deben ser analizadas con biopsia por congelación intraoperatoria, si es positiva hay que cambiar la conducta a disección modificada de cuello (15).
Tratamiento del cuello positivo
Clásicamente se ha descrito la disección radical de cuello como único tratamiento efectivo en los pacientes quienes presentan compromiso clínico ganglionar, sin embargo, desde hace unos años se ha iniciado el tratamiento de estos casos por ciertos grupos con otro tipo de disecciones (4, 11,12).
La disección radical clásica del cuello presenta gran morbilidad postoperatoria con defectos cosméticos importantes, funcionales como es la deformidad y el hombro doloroso, además de alteraciones en el drenaje venoso facial (11,16).
Suárez inició el cambio en el abordaje del cuello positivo, en estudios anatómicos demostró que los ganglios se encuentran entre fascias bien definidas; por lo que es posible preservar estructuras musculares, nerviosas y vasculares durante una disección de cuello sin que se altere de esta forma el control regional (15).
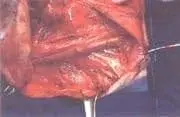
Foto 3. DRMC tipo II. Se preservan el nervio espinal accesorio y la vena yugular interna
La disección modificada de cuello preserva estructuras no linfáticas como son la vena yugular interna, el músculo esternocleidomastoideo y el nervio accesorio del espinal, sin embargo, esto no garantiza del todo la funcionalidad del hombro. Se han reportado alteraciones en la función del hombro después de disección radical de cuello hasta en 60% de los pacientes, en los de DRMC tipo I (foto 4) en 50% y en los de DRMC tipo III (foto 2) en 30% (15). En estos pacientes se hace necesario practicar fisioterapia postoperatoria lográndose buena recuperación.
La elección del tipo de disección a realizar en los pacientes con cuello positivo depende de diferentes factores tales como el estado de fijación de los nodos, hallazgos intraoperatorios, localización del tumor primario y tratamientos previos con cirugía o radioterapia. Aunque algunos grupos promueven el uso de las disecciones selectivas de cuello en pacientes con nodos positivos, sólo la recomendamos para los cuellos negativos.
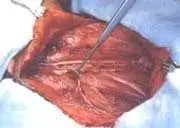
Foto 4. DRMC tipo I. Preservación del nervio espinal accesorio
Los nodos palpables clínicamente siempre se han considerado como positivos, sin embargo, en adultos se pueden encontrar adenopatías hasta de 2 cm por tuberculosis, sobreinfección tumoral, mala higiene oral o por el SIDA. Los falsos positivos para malignidad son hasta del 21% en T1 y T2 de supraglotis; el concepto intraoperatorio del cirujano puede tener también falsos positivos hasta del 73%. Por esto se recomienda para los pacientes con adenopatías por fuera de los sitios de drenaje usual de la laringe, practicar estudio histológico con AAF, para modificar la disección electiva del cuello (15).
Al momento del análisis de la patología se pueden encontrar factores adversos:
– Invasión perineural: Se asocia con alta recurrencia y disminución en la supervivencia; se ha observado la extensión del tumor a través del espacio neural hasta en 12 cm, por eso si existe invasión a los pares craneales, plejo braquial o raíces nerviosas, es mandatorio sopesar el riesgo beneficio de la resección (15).
– Compromiso extracapsular: En los casos clínicamente N0 se observan nodos positivos por histopatología en 28,1%; en N1 el compromiso extracapsular se presenta 35%, N2 55% y para los N3 es del 74% (10). La presencia de extensión más allá de la cápsula se asocia con alta recurrencia disminuyendo la tasa de supervivencia en los pacientes que la presentan (15).
– Invasión vascular: Se observa un aumento en la probabilidad de recurrencia de los pacientes que la presentan.
En los casos con nodos positivos se recomienda DRMC tipo III siempre y cuando no sean fijos, sin invasión extracapsular o de lo contrario se les debe realizar una DRMC tipo I, II ó DRC, esta decisión depende de la localización de los ganglios comprometidos.
Radioterapia postoperatoria
En el postoperatorio es importante definir qué pacientes se beneficiarán de radioterapia complementaria (15).
– Invasión extracapsular en uno o más ganglios comprometidos por tumor: Johnson sugiere que el uso de quemo – radiación postoperatoria podría incrementar la supervivencia en los pacientes con compromiso más allá de la cápsula (25).
– Compromiso de tres o más ganglios
– Invasión perineural: Como se comentó antes, es un factor que aumenta la tasa de recurrencia regional por lo que es recomendado que se administre radioterapia complementaria en el postoperatorio.
– Invasión vascular: al igual que el anterior debe ser manejado con terapia complementaria.
– Compromiso ganglionar de sitios que no son accesibles fácilmente por cirugía, como son los retrofaríngeos, parafaríngeos y del mediastino.
La radioterapia postoperatoria debe ser administrada entre la sexta y séptima semana.
Bibliografía
Byers M, Wolf P, Ballantyne A. Rationale for elective modified neck dissection. Head Neck Jan-feb 1998.
Houck J, Medina J. Management of cervical limph nodes in squamus carcinomas of the head and neck. Semin Surg Oncol 1995; 11:228.
Pillsbury H, Clark M. A rationale for therapy of the N0 neck. Laryngoscope 19897; 107:1.294.
Andersen P, Shah J, Cambrero E. The role of comprehensive neck dissection with preservation of the spinal accesory nerve in the clinically positive neck. Am J Surg 1994; 168: 499.
Suen Y, Goepfert H, Standardization of neck dissetion. Head Neck, nov-dec, 1987
Traynor S, Cohen J, Gray J. Selective neck dissection and management of the node- positive neck. Am J Surg, 1996; 172: 654.
Byers R. Neck dissection: concepts, controversies and technique. Sem Surg Oncol 1991; 7: 9.
Clayman G, Frank D. Selective neck dissection of anatomically appropriate levels is a efficacious as modified radical neck dissection for elective treatment of the cilincally negative neck in patients with squamous cell carcinoma of the upper respiratory and digestive tracts. Arch Otolaryngol Head Neck Surg 1998; 124: 348.
Mamelle G, Pampurik J, Luboinski. Lymph node prognostic factors in head and neck squamous cell carcinomas. Am J Surg 1994; 168: 494.
Pinsolle J, Pinsolle V, Majoufre C. Prognostic value of histologic findings in neck dissections for squamous cell carcinoma. . Arch Otolaryngol Head Neck Surg 1997; 123: 145.
Byers R. Modified neck dissection. Am J Surg 1985; 150: 414.
Jesse R, Ballantyne A, Larson D. Radical or modified neck dissection: a therapeutic dilemma. Am J surg 1978; 136: 516.
Kowalski L, Medina J. Nodal metastases. Otolaryngol Clin NA 1998; 31: 621.
Breau R, Suen J. Management of the N0 neck. Otolaryngol Clin NA 1998; 31: 657.
Myers E, Fagan J. Treatment of the N positive neck in squamous cell carcinoma of the upper aerodigestive tract. Otolaryngol clin NA 1998; 31: 671.
Kóybasioglu A, Tokcaer A, Uslu S. Accesory nerve function after modific radical and lateral neck dissections. Laryngoscope 2000; 110: 73.
Carew J, Spiro R. Extended neck dissection. Am J Surg 1997; 174: 485.
Merrit R, Williams M, James T. Detection of cervical metastasis. Arch Otolaryngol Head Neck Surg 1997; 123:149.
Million R, Cassisi N, Mancuso A. Larynx. Management of the head and neck cancer. J.B. Lippincott Company, 2nd ed, 1994.
Robbins T. Neck dissection. Otolaryngology head and neck surgery, 3rd ed, 1998.
Don D, Anzai Y, Lufkin R. Evaluation of cervical lymph node metastases in squamous cell carcinoma of the head and neck. Laryngoscope 1995; 105: 669.
Robbins T. Classification of neck dissection. Otolaryngol Clin NA 1998; 31: 639.
Atula T, Grenman R, Varpula M. Palpation ultrasound-guided fine-needle aspiratin cytology in the assessment of cervical lymph node status in head and neck cancer patients. Head Neck, nov-dec 1996; 545.
Spiro R, Strong E, Shah J. Classification of neck dissection: Variations on a new theme. Am J Surg 1994; 168: 415.
Johnson J, Wagner R, Myers E. A long-term assesment of adjuvant chemotherapy on outcome of patientswith extracapsular spread of cervical metastases from squamous carcinoma of head and neck. Cancer 1996; 77: 181.