Una Actualización
José Ramón García Berrocal*, Rafael Ramírez-Camacho, MD*,
Luis Fernando Ochoa Sánchez, MD**Isabel Millán Santos, MD***
* Servicio de Otorrimolaringología. Clínica Puerta de Hierro. Universidad Autónoma. Madrid. España.
** Profesor de Otorrinolaringología. Universidad de Antioquía. Medellín. Colombia.
*** Departamento de Bioestadística. Clínica Puerta de Hierro. Universidad Autónoma. Madrid. España.
Resumen
La enfermedad inmuno-mediada del oído interno (EIOI) incluye una serie de situaciones clínicas asociadas con hipoacusia sensorineural súbita y rápidamente progresiva. Pacientes con hipoacusia fluctuante, vértigo episódico, desequilibrio y presión aural, también son incluidos en este grupo de patologías del oído interno, diferenciándose de una enfermedad de Ménière clásica en que no presenta una remisión completa de los síntomas vestibulares durante las intercrisis y la hipoacusia muestra un carácter más progresivo. La existencia de una enfermedad autoinmune sistémica en la tercera parte de los pacientes dificulta el diagnóstico de las formas aisladas de la EIOI. La importancia de esta enfermedad estriba en que es una de las escasas formas de hipoacusia sensorineural que puede ser reversible con una terapia inmunosupresora. De ahí, que el otólogo debe mantener un alto índice de sospecha, que complementará con los tests de laboratorio , para instaurar precozmente un tratamiento que permita conservar la función cocleovestibular. El propósito del presente trabajo consiste en la búsqueda de un perfil de paciente típico de EIOI basado en el cuadro clínico y las pruebas inmunológicas que permiten detectar autoanticuerpos órgano y no órgano-específicos del oído interno así como la participación de las diversas subpoblaciones linfocitarias en la respuesta inmune.
Palabras clave: Oído Interno – Inmunología – Linfocitos – Autoanticuerpos.
Introducción
Aunque el oído interno había sido considerado tradicionalmente como un órgano aislado de la reacción inmune, algunas publicaciones (1) sospechaban el error de esta concepción, lo que fue confirmado por Mc Cabe en 1979 (2), cuando describe el cuadro clínico del paciente sospechoso de padecer una enfermedad inmuno-mediada del oído interno (EIOI) . Esta entidad se encontraba en el contexto de determinadas enfermedades autoinmunes sistémicas, pero, para el otólogo, el reto es su reconocimiento en las formas aisladas, dado que sus manifestaciones son indistinguibles del perfil de múltiples afectaciones cocleovestibulares de origen idiopático hasta el momento, como la sordera súbita, la hipoacusia rápidamente progresiva y la enfermedad de Ménière.
El conocimiento de los mecanismos inmunopatológicos de la afectación cocleovestibular basados en diversos modelos experimentales animales (3-11) están aportando nuevas perspectivas en el abordaje de las disfunciones que constituyen la enfermedad inmunomediada del oído interno. La detección de marcadores en la sangre de pacientes afectos por EIOI ha supuesto el principal esfuerzo de los investigadores interesados por este problema; sin embargo, la falta de especificidad de los hallazgos en los estudios serológicos (autoanticuerpos no específicos y específicos del oído interno) han obligado a profundizar en estos estudios empleando la citometría de flujo y el análisis de Western blot (12-26). Sin embargo, la ausencia de un marcador específico obliga a la búsqueda de un perfil en el qué apoyar la sospecha clínica, a través de un estudio inmunológico protocolizado, lo que constituye el objeto del presente estudio.
Pacientes y Métodos
Hemos estudiado 49 pacientes con sordera súbita (35 hombres y 15 mujeres; edad media 41.7 años, rango, 15-64 años), 23 pacientes con sordera progresiva (9 hombres y 14 mujeres; edad media 41.3 años; rango, 15-69 años) y 12 pacientes afectos de sordera fluctuante (5 hombres y 7 mujeres; edad media 39.7 años; rango, 8-67 años). Catorce voluntarios sanos (9 hombres y 5 mujeres; edad media 36 años; rango, 24-55 años) sin historia de hipoacusia o patología ótica, constituyen el grupo control.
El oído derecho se afectó en 21 enfermos con sordera súbita, 9 con sordera progresiva y 5 con sordera fluctuante. El oído izquierdo estaba alterado en 28 pacientes con sordera súbita, 4 con hipoacusia progresiva y 4 con sordera fluctuante. Una afectación bilateral apareció en un paciente con sordera súbita, diez con hipoacusia progresiva y tres con sordera fluctuante.
Vértigo y/o inestabilidad fue descrito en 25 (51 %) pacientes con sordera súbita, 4 (17.3 %) con hipoacusia progresiva y en los 12 (100%) pacientes con sordera fluctuante.
Una infección del tracto respiratorio superior apareció en 14 pacientes (28.5 %) afectos de sordera súbita.
A todos los pacientes se les aplicó un protocolo diagnóstico que incluye audiometría tonal liminar (ATL), batería inmunológica, microbiología y resonancia magnética (RM). (Tabla 1) (27).
Tabla 1 Protocolo diagnóstico aplicado en pacientes
con enfermedad inmuno-mediada del oído interno (EIOI)

La ATL se realizó en el momento de asistir al paciente, a las 48 horas, 7 días, al mes, y de forma bimensual hasta el año de evolución en el grupo de la sordera súbita. Los pacientes con sordera progresiva fueron evaluados mensualmente durante 1 año, y los casos de hipoacusia fluctuante se exploraron en función de su evolución clínica. Los parámetros utilizados para evaluar la recuperación auditiva, medida un mes después de finalizar el tratamiento, fueron la ganancia auditiva que expresa en dB el cambio en la media de los umbrales auditivos en cinco frecuencias, 250-4000 Hz y la tasa de recuperación auditiva (se calcula al dividir la ganancia auditiva por la diferencia en el nivel auditivo inicial entre el oído afecto y el no afecto y se expresa en %) en los casos de sordera súbita. En los pacientes con hipoacusia progresiva se considera una respuesta positiva al tratamiento cuando existe un incremento medio de 15 dB en tres frecuencias en la ATL o más de un 20% de discriminación en la audiometría verbal (AV). Una ganancia de más de 10 dB en la ATL en 250-4000 Hz y/o de un 15% de discriminación se considera mejoría en la sordera fluctuante.
El estudio microbiológico se realizó en el momento de atención inicial al paciente, durante la fase aguda del proceso, y un mes después, durante la fase de convalecencia, al objeto de objetivar una seroconversión del título de anticuerpos frente a los virus estudiados en los pacientes con sordera súbita (28).
La batería inmunológica fue efectuada antes de la administración del tratamiento protocolizado, que incluye 6-metilprednisolona a la dosis de 1 mg/Kg de peso/día en pauta descendente durante tres semanas. Sólo en el grupo de la sordera súbita se añadió nimodipino, oxígeno, heparina de bajo peso molecular y reposo en cama (29). La administración de dexametasona transtimpánica (Tabla 2) ha comenzado a emplearse recientemente en los casos de mal pronóstico.
Tabla 2 Indicaciones del tratamiento con esteroides transtimpánicos.
1- Patología médica que contraindique el empleo de esteroides sistémicos (Diabetes mellitus, ulcus gastroduodenal, osteoporosis, intolerancia al fármaco).
2- Hipoacusia no reversible con la terapéutica corticoidea habitual.
3- Deficiencia auditiva grave (pérdida media superior a 70 dB).
La comparación entre los grupos se ha realizado mediante un análisis de la varianza (ANOVA) seguido por el test de comparaciones múltiples Newman-Keuls. En algunos casos, si no se cumple la hipótesis de normalidad (CD8, CD8RO) se utilizó el contraste U de Mann-Whitney. Valorando la tasa de recuperación auditiva con un punto de corte en el 80%, la comparación respecto as los ANA se realizó mediante el contraste Chi-cuadrado de Pearson.
Resultados
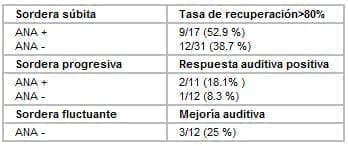
La aplicación de la batería inmunológica permitió objetivar la presencia de ANA en 28 pacientes (39.4 %); de ellos, en 17 (35.4 %) afectos de sordera súbita y en 11 (47.8 %) con sordera progresiva. En ninguno de los pacientes con sordera fluctuante se detectaron estos autoanticuerpos (Tabla 3).
Tabla 3 Pacientes incluidos en el estudio
 * En un paciente con sordera súbita no se pudo determinar la presencia de ANA.
* En un paciente con sordera súbita no se pudo determinar la presencia de ANA.
El análisis inmunofenotípico de los linfocitos de sangre periférica mediante citometría de flujo mostró una población disminuída de células T nativas (CD4RA) en los grupos de sordera súbita y sordera progresiva al compararlos frente a los controles, presentando una diferencia estadísticamente significativa (p<0.05). Así mismo pudo detectarse una reducción significativa de las células T supresoras (CD8 y CD8RO) en el grupo de la sordera súbita cuando se comparó con los casos de sorderas progresivas (Tabla 4). Al comparar los enfermos ANA + con los ANA – en los grupos de sordera súbita y sordera progresiva no se observaron diferencias estadísticamente significativas.
Tabla 4 Resultado del análisis inmunofenotípico de los linfocitos de sangre periférica donde se muestran
las medias y entre paréntesis, la desviación típica

Se comprobó una tasa de recuperación auditiva superior al 80% en 21 (43.7 %) pacientes con sordera súbita y una respuesta positiva en tres (13 %) pacientes con sordera progresiva. Sólo pudo objetivarse una mejoría auditiva en tres (25 %) pacientes con sordera fluctuante. No se incluyen en estos resultados los obtenidos con la administración intratimpánica de dexametasona por carecer hasta el momento de un número de casos suficiente para el análisis estadístico. Entre los pacientes con sordera súbita existe una mayor recuperación auditiva en los pacientes ANA+ (52.9 %) frente a los ANA- (38.7%). Dos pacientes ANA+ y uno ANA- del grupo de la sordera progresiva presentaron una respuesta positiva . Ninguno de los pacientes afectos de sordera fluctuante que mostraron una mejoría auditiva presentó ANA (Tabla 5).
Tabla 5 Recuperación auditiva tras la administración de esteroides
Discusión
La búsqueda de un perfil clínico-serológico en las entidades patológicas que forman la enfermedad inmuno-mediada aislada del oído interno representa un objetivo prioritario para el otólogo. La presencia de autoanticuerpos no específicos de oído interno, como los anticuerpos antinucleares (ANA), presentes en numerosas enfermedades autoinmunes sistémicas, en un porcentaje superior al esperado en la población sana (35.4 % en nuestros pacientes con sordera súbita y 47.8 % en el grupo de la sordera progresiva frente al 5 % de la población general), obliga a descartar una afectación sistémica, ya que, la pérdida de función cocleovestibular podría ser la primera manifestación de un lupus eritematoso sistémico (LES)(30,31) o de un síndrome de Sjögren (32).
Posteriormente debe plantearse la existencia de factores desencadenantes de esta respuesta inmune como agentes infecciosos, estrés y factores genéticos (33). Estudios microbiológicos recientes (28) sitúan en menos de un 30 % la presencia de un agente infeccioso en la sordera súbita idiopática, entidad en la que tradicionalmente se consideraba prioritaria la etiología vírica (34-37). Estos agentes, no sólo aparecen en la génesis de las enfermedades autoinmunes sistémicas, sino que podrían participar también en el desencadenamiento de una respuesta inmunológica responsable del daño tisular en la enfermedad inmuno-mediada del oído interno. La dificultad para aislar estos agentes y la hipótesis de posibles infecciones latentes o recurrentes (38) justifican estos resultados y requieren nuevas tecnologías como hibridación in situ y reacción en cadena de la polimerasa (PCR) que puedan aplicarse a los huesos temporales de estos pacientes, lo que confirmaría esta teoría. Las recurrencias desencadenan una respuesta celular, de ahí la dificultad en el diagnóstico serológico, mientras que la infección primaria provoca una doble respuesta, humoral y celular.
Dentro del contexto de las enfermedades autoinmunes clásicas como el LES, resulta difícil correlacionar las fases activas de la enfermedad con la pérdida auditiva (39) lo que sugiere otro mecanismo fisiopatológico diferente; así el depósito de inmunocomplejos circulantes con desencadenamiento de una vasculitis no sería el único mecanismo del daño al laberinto membranoso, debiendo considerarse también la autorreactividad mediada por las células T. Así, ha podido objetivarse un defecto en las células T supresoras CD8, lo que facilita la agresión autoinmune (40).
La búsqueda de anticuerpos frente al colágeno tipo II y frente a la proteína de choque térmico 70 (heat shock protein 70) se está incorporando a la batería de pruebas diseñada para el diagnóstico de estas patologías. Sin embargo, se puede especular con la hipótesis de que estos elementos estructurales no específicos del oído interno pueden representar el efecto de la agresión inmune y no la causa de la misma, al quedar expuestos durante esta reacción en el oído interno, al igual que sucede en la artritis reumatoide. Además existe una destacable controversia en cuanto a los resultados obtenidos al emplear estas sustancias en modelos de laberintitis experimental inmunoinducida (3). No obstante, existe una aceptación creciente de estos marcadores que, en el caso de la proteína de choque térmico, se ha correlacionado con la respuesta clínica, aunque en nuestra opinión su uso debe considerarse en el contexto del resto del estudio y no de una forma aislada.
La determinación de anticuerpos frente a otros elementos celulares o tisulares no específicos (microsomas, laminina, reticulina, sarcolema, músculo liso, endotelio) y específicos de oído interno (proteínas cocleares, saco endolinfático) no es justificable dado la gran variabilidad de resultados y su difícil aplicación clínica (12).
El estudio de las subpoblaciones linfocitarias ha mostrado un déficit de las células T nativas (CD4RA) tanto en el grupo de la sordera súbita como en el grupo de las sorderas progresivas, lo que sugiere la existencia de una respuesta inmune desencadenada por un agente o antígeno, infeccioso o no, o bien la presencia de una población deficitaria, así como un número reducido de células T supresoras CD8 y CD8RO en el grupo de sordera súbita , lo que facilitaría la autorreactividad mostrada en estos pacientes (13), descrita en enfermedades autoinmunes sistémicas como el LES (40). Estos hallazgos apoyarían el papel de la respuesta celular en la génesis de las lesiones del oído interno, lo que ha sido demostrado en modelos de laberintitis experimental autoinmune (3-10).
La respuesta clínica positiva al tratamiento con esteroides y/o otros medicamentos inmunomoduladores es un argumento más en el diagnóstico de presunción de la enfermedad inmuno-mediada del oído interno, aunque la intensidad de la pérdida auditiva es determinante en la consecución de su reversibilidad (34); una pérdida profunda puede tener un origen inmuno-mediado y no responder a los esteroides, incluso administrados en pulsos de altas dosis. De ahí que se estén diseñando abordajes terapéuticos directos al oído interno mediante la inyección transtimpánica de esteroides con o sin tubos de ventilación(41) o por medio de microcatéteres dirigidos a la ventana redonda con los que se consigue una liberación más lenta y sostenida del fármaco durante varias semanas (42). Estos nuevos diseños permiten la administración de fármacos y factores de crecimiento neurotróficos que posibilitan la conservación de las células ciliadas del órgano de Corti y las células ganglionares del ganglio espiral, así como frenar la agresión inmune de forma directa.
La utilización de estudios de resonancia magnética (RM) puede ser útil en estadios muy precoces de la afectación, pudiéndose demostrar hiperintensidades en el interior del laberinto membranoso concordantes con vasculitis inmune (Figura1) (27,43,44), habiéndose correlacionado la intensidad de la pérdida auditiva con el incremento de la señal, además de ser imprescindibles para descartar una lesión tumoral del CAI y ángulo pontocerebeloso.
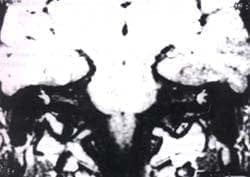
Figura 1. Proyección coronal de imagen de RM donde se observa una hiperintensidad precontraste en T-1 en el interior del laberinto membranoso, de forma bilateral, correspondiente a una vasculitis inmuno-mediada de un paciente afecto de un síndrome de Cogan.
La consecución de un perfil inmunológico de la enfermedad inmuno-mediada del oído interno en función de los resultados obtenidos al aplicar el estudio protocolizado diseñado en nuestro servicio complementa y facilita el diagnóstico clínico de sospecha y justifica la utilización de fármacos inmunomoduladores, no exentos de reacciones adversas indeseables. Así, la presencia de una hipoacusia sensorineural súbita o rápidamente progresiva, en un paciente adulto de edad media, con ANA positivos , déficit de células T nativas y células T supresoras junto con una respuesta positiva al tratamiento esteroideo sugiere fuertemente el diagnóstico de enfermedad inmuno-mediada del oído interno y representa el perfil típico de estos pacientes (45) (Tabla 6). La presencia de anticuerpos frente a colágeno tipo II y frente a la proteína de choque térmico 70 reforzaría este diagnóstico proporcionando posiblemente una mayor sensibilidad y especificidad al perfil descrito, facilitando la inclusión de los pacientes con sordera fluctuante en este perfil.
Tabla 6 Perfil del paciente típico con enfermedad inmuno-mediada del oído interno
Cuadro clínico:
Paciente adulto jóven que presenta:
Hipoacusia sensorineural súbita
Hipoacusia sensorineural rápidamente progresiva
Hipoacusia fluctuante con acúfenos y vértigo sin recu- peración intercrisis
Anticuerpos antinucleares positivos
Déficit de células T nativas (CD4RA) y células T supresoras (CD8)
Respuesta positiva al tratamiento con esteroides
El estudio de nuevas proteínas cocleares, el perfeccionamiento de los estudios de imagen basados en modificaciones metabólicas a nivel celular, la aplicación de PCR a los huesos temporales obtenidos en el curso de necropsias de pacientes sospechosos de padecer una enfermedad inmuno-mediada del oído interno, y la aplicación de nuevos planteamientos terapéuticos crearán nuevas perspectivas en el diagnóstico y tratamiento de estas entidades patológicas y dirigirán las investigaciones futuras.
Abstract
Immune-mediated inner ear disease (IIED) includes a variety of clinical conditions associated with sudden and rapidly progressive sensorineural hearing loss. Patients affected by fluctuating hearing loss, episodic vertigo, imbalance and aural pressure are also included in this group of inner ear disorders, and they difference from classic Ménière´s disease in the lack of vestibular symptoms remission after the attacks and the more progressive hearing loss. The presence of a systemic autoimmune disease in one-third of patients makes difficult the diagnosis of the isolated IIED. It represents one of the few reversible forms of sensorineural hearing loss with immunosuppressive therapy. Therefor, the clinician ought to mantain a high index of suspicion, supported in laboratory tests and promptly initiate therapy to preserve cochleovestibular function. The objective of this work is the search of the profile of the typical patient suffered isolated IIED in base to clinical picture and immunological tests that detect the existence of organ-specific and nonspecific autoantibodies that target the inner ear tissues and the lymphocyte subpopulations in the immune response.
Key Words: inner ear, Immunology, lymphocytes, autoantibodies.
Correspondencia: J.R.García Berrocal. Servicio de Otorrinolaringología. Clínica Puerta de Hierro San Martín de Porres 4 28035 Madrid España. tlf. 91.3162240 ext 5409. fax 91.3730535. E-mail : jrgarciab@seorl.org
Bibliografia
1- Lehnhardt E. Plötzliche horstörungen auf beiden seiten gleichzeiting oder nacheinader aufgetreten. Z Laryngol Rhinol Otol 1958; 37:1-16.
2- McCabe BF. Autoimmune sensorineural hearing loss. Ann Otol Rhinol Laryngol. 1979; 88:585-589.
3- García Berrocal JR, Vicente J, Arellano B, González F, Ramírez Camacho R. Laberintitis experimental autoinmune: evaluación de diversos modelos en cobayas. Acta Otorrinolaring Esp 1997; 48:5-10.
4- Harris JP, Woolf NK, Ryan AF. Elaboration of systemic immunity following inner ear immunization. Am J Otol 1985; 6:148-52.
5- Woolf NK, Harris JP. Cochlear pathophysiology associates with inner ear immune responses. Acta Otolaryngol (Stockh) 1986; 102:353-64.
6- Tomiyama S, Harris JP. The role of endolymphatic sac in inner ear immunity. Acta Otolaryngol (Stockh) 1987; 103:182-8.
7- Stearns GS, Keithley EM, Harris JP. Development of high endothelial venule-like characteristics in the spiral modiolar vein induced by viral labyrinthitis. Laryngoscope 1993; 103:890-8.
8- Suzuki M, Harris JP. Expression of intercellular adhesion molecule-1 in the inner ear during experimental labyrinthitis in rat. Ann Otol Rhinol Laryngol 1995; 104:69-75.
9- Ichimiya I, Kurono Y, Hirano T, Mogi G. Changes in immunostaining of inner ears after antigen challenge into the scala tympani. Laryngoscope 1998; 108:585-91.
10- Chen M, Harris JP, Keithley EM. Immunohistochemical analysis of proliferating cells in a sterile labyrinthitis animal model. Laryngoscope 1998; 198:651-6.
11- Takasu T, Harris JP. Reduction of inner ear inflammation by treatment with anti-ICAM-1 antibody. Ann Otol Rhinol Laryngol 1997; 106:1070-5.
12- García Berrocal JR, Pinilla Urraca M, Ramírez Camacho R, González Martin F, López Cortijo C. Patología de oído interno de probable origen autoinmune y su respuesta al tratamiento esteroideo. Acta Otorrinolaring Esp 1995; 46:416-20.
13- García Berrocal JR, Vargas JA, Ramírez Camacho R et al. Deficiency of naive T cells in patients with sudden deafness. Arch Otolaryngol Head Neck Surg 1997; 123: 712-7.
14- Mayot DM, Bene MC, Dron K, Perrin C, Faure GC. Immunological alterations in patients with sensorineural hearing disorders. Clin Immunol Immunopathol. 1993; 68:41-45.
15- Veldman JE, Hanada T, Meeuwsen F. Diagnostic and therapeutic dilemmas in rapidly progressive sensorineural hearing loss and sudden deafness. Acta Otolaryngol (Stockh) 1993; 113:303-306.
16- Harris JP, Sharp PA. Inner ear autoantibodies in patients with rapidly progressive sensorineural hearing loss. Laryngoscope. 1990; 100:516-524.
17- Yamanobe S, Harris JP. Inner specific autoantibodies. Laryngoscope. 1993; 103:319-325.
18- Joliat T, Seyer J, Bernstein J et al. Antibodies against a 30 kilodalton cochlear protein and type II and IX collagens in the serum of patients with inner ear diseases. Ann Otol Rhinol Laryngol. 1992; 101:1000-1006.
19- Mosciscki RA, San Martín JE, Quintero CH, Rauch R, Nadol JB, Bloch KJ. Serum antibody to inner ear proteins in patients with progressive hearing loss. JAMA. 1994; 272:611-616.
20- Ikeda K, Kobayashi T, Itoh Z, Suzuki H, Kusakari J, Takasaka T. Immunological abnormality of the serological test in bilateral sensorineural hearing loss. ORL. 1989; 51:268-275.
21- Kanzaki J, Inove Y, O-uchi T. Immunological findings of serological tests in steroid-responsive sensorineural hearing loss. Acta Otolaryngol (Stockh).1994; Suppl 514:66-69.
22- Helfgott SM, Mosciscki RA, San Martín J et al. Correlation between antibodies to type II collagen and treatment outcome in bilateral progressive sensorineural hearing loss. Lancet. 1991; 337:387-389.
23- Billings PB, Keithley EM, Harris JP. Evidence linking the 68 Kilodalton antigen identified in progressive sensorineural hearing loss patient sera with heat shock protein 70. Ann Otol Rhinol Laryngol 1995; 104: 181-188.
24- Rauch SD, San Martin JE, Moscicki RA, Bloch KJ. Serum antibodies against heat shock protein 70 in Meniere´s disease. Am J Otol 1995; 16: 648-652.
25- Bloch DB, San Martin JE, Rauch SD, Moscicki RA, Bloch KJ. Serum antibodies to heat shock protein in sensorineural hearing loss. Arch Otolaryngol Head Neck Surg 1995; 121: 1167-1171.
26- Shin SO, Billings PB, Keithley EM, Harris JP. Comparison of anti-heat shock protein (anti-hsp 70) and anti-68 Kd inner ear protein in the sera of patients with Meniere´s disease. Laryngoscope 1997; 107: 222-227.
27- García Berrocal JR, Vargas JA, Vaquero M, Ramón y Cajal S, Ramírez Camacho R. Cogan´s syndrome: an oculo-audiovestibular disease. Postgrad Med J 1999;75:262-4.
28- García Berrocal JR, Ramírez Camacho R, Portero F, Vargas JA. Viral infection in sudden hearing loss. Role of seroconversion. Arch Otolaryngol Head Neck Surg (en revisión)
29- Arellano B, García Berrocal JR, Górriz C, González FM, Vicente J, Ramírez Camacho R. Protocolo de tratamiento de la sordera súbita. Acta Otorrinolaring Esp 1007; 48:513-6.
30- Bowman CA, Linthicum FH, Nelson RA, Mikami K, Quismorio F. Sensorineural hearing loss associated with systemic lupus erythematosus. Otolaryngol Head Neck Surg 1986; 94:197-204.
31- Naarendorp M, Spiera H. Sudden sensorineural hearing loss in patients with systemic lupus erythematosus or lupus-like syndromes and antiphospholipid antibodies. J Rheumatol 1998;25:589-92.
32- García Berrocal JR, Arellano B, Vargas JA, Trinidad A, Ramírez Camacho R, Vergara J. Enfermedad inmunomediada del oído interno: presentación de casos clínicos. Acta Otorrinolaring Esp 1997; 48:565-70.
33- Cutolo M, Sulli A, Villaggio B, Seriolo B, Accardo S. Relations between steroid hormones and cytokines in rheumatoid arthritis and systemic lupus erythematosus. Ann Rhem Dis 1998;57:573-77.
34- Wilson WR, Veltri RW, Laird N, Sprinkle PM. Viral and epidemiologic studies of idiopathic sudden sensorineural hearing loss. Otolaryngol Head Neck Surg. 1983;91:653-658.
35- Jaffe BF. Viral causes of sudden inner ear deafness. Otolaryngol Clin North Am. 1978;11:63-69.
36- Maasab H. The role of virus in sudden deafness. Adv Otorhinolaryngol. 1973;20:229-235.
37- Jaffe BF. Viral causes of sudden inner ear deafness. Otolaryngol Clin North Am. 1978;11:63-69.
38- Veltri RW, Wilson WR, Sprinkle PM, Rodman SM, Kavesh DA. The implication of viruses in idiopathic sudden hearing loss: primary infection or reactivation of latent viruses? Otolaryngol Head Neck Surg. 1981;89:137-141.
39- Sperling NM, Tehrani K, Liebling A, Ginzler E. Aural symptoms and hearing loss in patients with lupus. Otolaryngol Head Neck Surg 1998;118:762-5.
40- Morimoto C, Steinberg AD, Letvin NL et al. A defect of immunoregulatory T cell subsets in systemic lupus erythematosus patients demonstrated with anti-2H4 antibody. J Clin Invest. 1987; 79:762-768.
41- Silverstein H, Choo D, Rosenberg SI, Kuhn J. Intratympanic steroid treatment of inner ear disease and tinnitus (preliminary report). ENT-Ear, Nose & Throat J 1996; 75:568-88.
42- Seidman MD. Glutamate antagonists, steroids, ans antioxidants as therapeutic options for hearing loss and tinnitus and the use of an inner ear drug delivery system. International Tinnitus J 1998;2:148-154.
43-Kano K,Tono T, Ushisako Y, Morimitsu T, Suzuki Y, Kodama T. Magnetic resonance imaging in patients with sudden deafness. Acta Otolaryngol (Stockh) 1994; Suppl 514:32-6.
44- Mark AS, Seltzer S, Nelson-Drake J, Chapman JC, Fitzgerald DC, Gulya AJ. Labyrinthine enhancement on Gd-MRI in patients with sudden deafness and vertigo: correlation with audiologic and electronystagmographic studies. Ann Otol Rhinol Laryngol 1992; 101: 459-64.
45- García Berrocal JR, Ramírez-Camacho RA, Arellano B. Isolated immune-mediated sudden sensorineural hearing loss. Profile of the typical patient. XXIV Congreso mundial de Audiología. Buenos Aires 30 Ag-3 Sep,1998.
