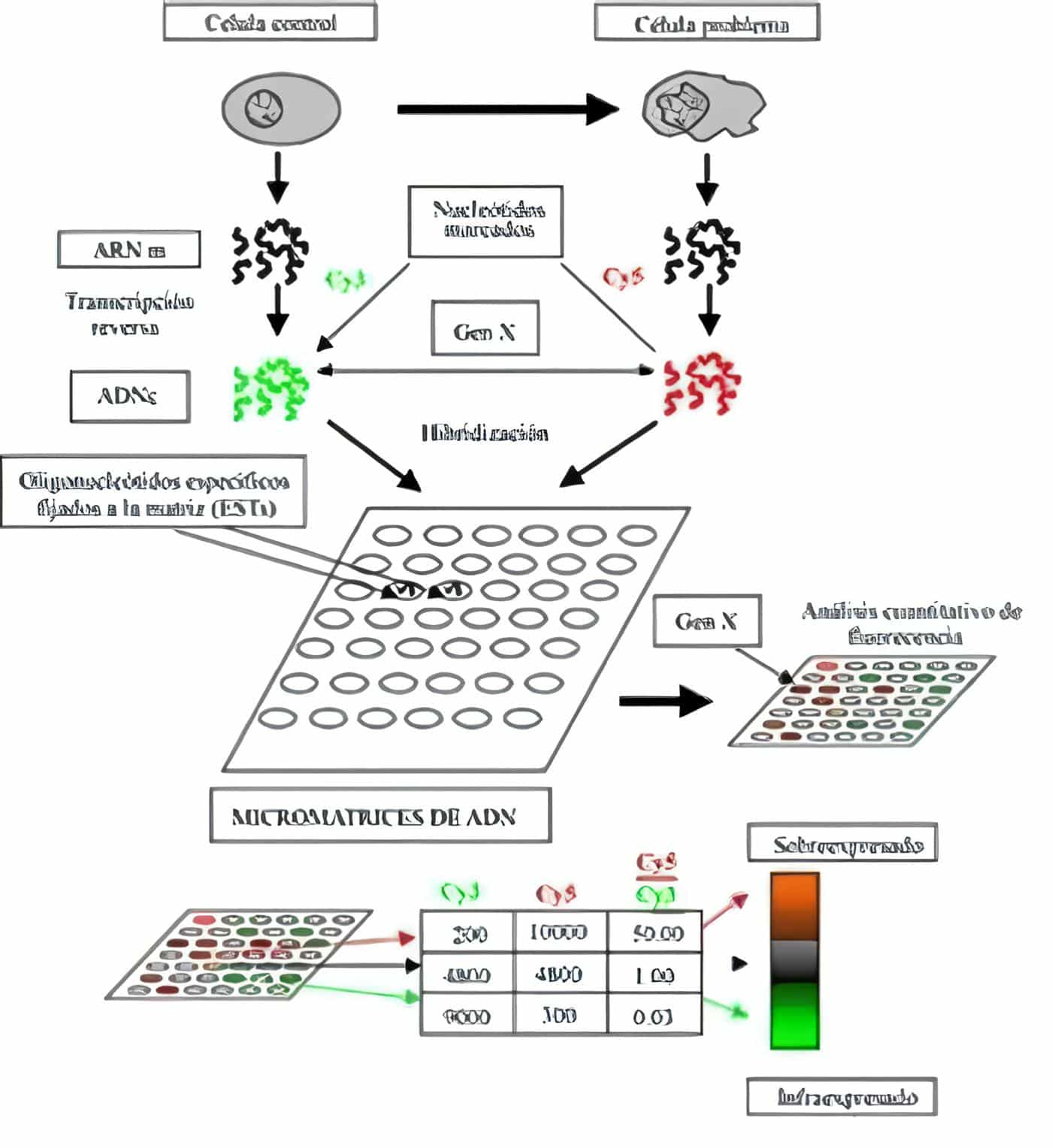
Cáncer
Uno de los campos de mayor aplicabilidad de las micromatrices es el estudio de las neoplasias en áreas tales como:
-
-
La comprensión de las bases moleculares de la carcinogénesis:
Las micromatrices han facilitado enormemente el estudio global de los patrones de expresión génica que conducen a la pérdida de la regulación del ciclo de división celular y de la muerte celular programada (apoptosis), como mecanismos esenciales de control involucrados en la transformación maligna (11, 12). Particularmente, en neoplasias inducidas por virus las micromatrices han permitido dilucidar algunas de las vías de señalización que ellos emplean para inducir la transformación (13).
-
-
La clasificación y el pronóstico:
Las metodologías que existen actualmente para clasificar y establecer un pronóstico en muchos tipos de neoplasias (por ejemplo leucemias) aún son de difícil interpretación y en algunos casos no ofrecen mayor información. El estudio y clasificación de estos tumores mediante el uso de micromatrices ha facilitado la definición de patrones de expresión diferenciales que hacen posible un acercamiento más profundo a su origen molecular (14).
La comparación de estos resultados con los obtenidos por métodos convencionales como la citometría flujo para marcadores de membrana y la citogenética, han permitido establecer no sólo una excelente correlación diagnóstica, sino que han impactado en aspectos como la clasificación, el tratamiento y el pronóstico (15-17). Se espera que estas matrices simplifiquen en tiempo y en costos el diagnóstico, el manejo y la determinación del pronóstico de muchos tipos de neoplasias (18).
Un marcador tumoral es cualquier parámetro bioquímico cuya detección en tejido o líquido biológico pueda indicar la presencia de un tumor. Las matrices también han permitido hallar potenciales marcadores tumorales específicos. Las células en un tejido normal expresan diferentes genes cuya expresión es afectada por el proceso de transformación maligna (antígeno asociado a tumor) que generan moléculas “únicas” en forma anómala (19). Un ejemplo de ello es el cáncer de próstata en el cual el estudio con micromatrices ha facilitado la identificación de genes que se expresen sólo en próstata, pero que alteran su expresión únicamente en el tejido neoplásico y no en otras alteraciones como hipertrofia prostática o prostatitis (19).
-
Seguimiento de metástasis:
En tumores tales como en el melanoma se ha podido determinar la expresión diferencial negativa de genes relacionados en la adhesión celular y con el complejo mayor de histocompatibilidad, que hacen posible diferenciar los melanomás con potencial metastásico (20).
Alergia
Aunque son pocos los trabajos publicados acerca del uso de micromatrices en esta área, ESTUDIOS preliminares en primates han revelado perfiles de expresión diferencial de genes obtenidos de células del fluido bronquial, luego de estimulación con alergenos e interleuquina 4.
En este estudio se pudo determinar el pico máximo de expresión génica 4 horas después de la inhalación del alérgeno específico y expresión diferencial de quimioquinas, así como de factores de remodelación tisular y agentes antioxidantes (21). Estos estudios y otros que utilicen modelos de expresión global podrán mejorar el entendimiento de la fisiopatología de las enfermedades alérgicas.
En el campo del diagnóstico alergológico, las micromatrices brindan otra la posibilidad de detectar IgE específica para los alergenos sensibilizantes (22). Es de esperarse que en las enfermedades alérgicas se intensifiquen los ESTUDIOS con micromatrices, pues el hallazgo de nuevos blancos terapéuticos para estas enfermedades tiene una amplia relación costo beneficio.
Inmunodeficiencias Primarias
En años recientes el estudio molecular de las inmunodeficiencias primarias ha permitido conocer en detalle el funcionamiento de múltiples componentes del sistema inmune. No obstante el empleo de las micromatrices promete ofrecer una visión global de los trastornos celulares que resultan de la ausencia de un producto crítico para el adecuado funcionamiento del sistema inmune.
En un estudio reciente con dos pacientes que sufrían inmunodeficiencia combinada severa de origen molecular desconocido se trató de determinar el origen y consecuencia de la activación defectuosa de los linfocitos T. Los resultados no sólo permitieron establecer las posibles vías de activación de los linfocitos que estaban comprometidas sino que también lograron demostrar la complejidad y las posibilidades de cambios en la expresión génica durante la activación de las células T (10).
En otro estudio se comparó la expresión génica por medio de micromatrices de ADN de linfocitos B transformados provenientes de un paciente con agamaglobulinemia congénita y un control sano, se encontró una expresión disminuida en 9 secuencias de función desconocida y expresión aumentada de Fyn, Hck y Cyp1B1. Estos hallazgos demostraron la posibilidad de utilizar esta metodología para estudiar la influencia de las mutaciones del gen Btk en los linfoctios B de estos pacientes (23).
Enfermedades Autoinmunes
El amplio espectro de genes involucrados en la patogenia de las enfermedades autoinmunes y que potencialmente afectan el curso de éstas, hace que las micromatrices sean prácticas para el análisis de estas afecciones.
En casos tales como en la artritis reumatoidea, en la que se observa una respuesta inflamatoria crónica del tejido sinovial y cartilaginoso, los estudios realizados con micromatrices han revelado la sobreexpresión de genes, tales como la interleuquina 3, la quimioquina GROa, la metaloproteasa de matriz metaloelastasa, el inhibidor de la metaloproteasa 1 y la cadena liviana de la ferritina. Se postula que estos genes podrían participar en el desarrollo inflamatorio característico de esta enfermedad (24).
Enfermedades Infecciosas
En el estudio de las enfermedades infecciosas las micromatrices de ADN han sido de gran utilidad ya que es posible visualizar la manera como los diferentes genes se modulan del sistema inmune simultáneamente en respuesta al reto infeccioso. Así, se han encontrado patrones de expresión génica diferenciales en las células afectadas por microorganismos como: Helicobacter pilory (25), Bordetella pertussis (26), Toxoplasma gondii (27), Tripanosoma cruzi (28), virus coxsackie B3 (29), citomegalovirus (30), papilloma virus humano 3 (31) y virus del sarampión (32) entre otros.
Estos estudios han permitido dilucidar la forma en la cual las células hospederas son influenciadas por los diferentes tipos de infección y la respuesta que ellas generan.
Estos estudios no sólo han permitido conocer la interacción entre el hospedero y los microorganismos (32-34); sino que también han facilitado la identificación de nuevos blancos de vacunas (35) e incluso el reconocimiento de nuevos factores de virulencia (36). La identificación molecular de microorganismos (37) y una mayor precisión de las pruebas serológicas (38), constituyen otras de las aplicaciones de las micromatrices que en un futuro cercano se beneficiarán de esta tecnología.
Identificación de polimorfismos y mutaciones
En los últimos dos años los proyectos de secuenciamiento del genoma han provisto más de dos millones de polimorfismos de un sólo nucleótido denominados (single nucleotide polymorphisms -SNPs) que han servido como marcadores genéticos. Los análisis de estos polimorfismos han permitido la identificación de patrones comunes de expresión de polimorfismos en enfermedades genéticamente complejas como la diabetes, el asma, la enfermedad inflamatoria intestinal y el cáncer, entre otras.
Con las matrices de ADN es posible genotipificar más de 2000 polimorfismos por placa, con lo cual se podría determinar la susceptibilidad a padecer enfermedades y la posible respuesta a terapias específicas de una manera más rápida y práctica (39).
Al igual que con los polimorfimos, también se pueden buscar mutaciones conocidas o probables de hasta un sólo nucleótido en diferentes regiones del ADN, como un método de resecuenciamiento o búsqueda, con lo cual se podría evaluar en un sólo experimento múltiples mutaciones causantes de una enfermedad en particular (39).
Perspectivas y conclusiones
El conocimiento de la función y los procesos que regulan las interrelaciones de los genes para el funcionamiento óptimo de la célula es fundamental para dilucidar las alteraciones que interrumpen o modulan estos mecanismos moleculares que conducen a la enfermedad.
Hasta el momento las micromatrices han mostrado gran versatilidad y confiabilidad permitiendo a los investigadores obtener gran cantidad de datos acerca de la regulación y de la expresión global de genes que pueden ser interpretados y analizados a la luz del conocimiento celular actual, generando nuevos enfoques para el diagnóstico y el manejo de muchas enfermedades.
En el campo de la inmunología las micromatrices han hecho posible comprender la regulación celular y la interacción huésped – hospedero en infecciones; además, están permitiendo diferenciar, evaluar terapias y ofrecer un pronóstico en cáncer. Pero tal vez su mayor utilidad se encuentre en la farmacogenómica en donde las micromatrices permiten evaluar nuevas terapias y conocer nuevos blancos para el tratamiento de las enfermedades del sistema inmune.
Una consecuencia lógica del uso de las micromatrices de ADN:
Es el entendimiento global de las funciones celulares en salud y enfermedad, así como la de las interacciones que gobiernan la función global de las proteínas. Las proteínas son las moléculas efectoras que conducen el comportamiento celular de acuerdo con los “comandos” impartidos por los genes. La proteómica es la ciencia que estudia los procesos de expresión y regulación global de interacciones entre todas las proteínas que contiene la célula (proteoma).
El desarrollo de la proteómica se ha logrado por medio de la utilización de técnicas como la cristalografía y la inferencia computacional de estructura y función a partir de la secuencia de nucleótidos conjuntamente con las micromatrices de ADN hacen posible estudiar en detalle el funcionamiento simultáneo de los genes y de las proteínas. De esta manera podemos finalmente integrar todas las bases moleculares de los procesos fisiológicos y su impacto en el desarrollo de las enfermedades y podrán ofrecer nuevas alternativas terapéuticas altamente específicas y efectivas.
Referencias Bibliográficas
- 1. Dhand R. Functional genomics. Nature 2000;405:819.
- 2. Fields S, Hohara Y, Lockhart D. Functional genomics. Proc. Natl. Acad. Sci. 1999;96:8825-8826.
- 3. Staudt LM, Brown PO. Genomic views of the immune system*. Annu Rev Immunol 2000;18:829-59.
- 4. Lockhart DJ, Winzeler EA. Genomics, gene expression and DNA arrays. Nature 2000;405(6788):827-36.
- 5. Fahrer A, Bazan J, Papathanasiou P, Nelms K, Goodnow C. A Genomic view of inmunology. Nature 2001;409:836-837-838.
6. Vucmirovic O, Tilghman S. Exploring genome space. Nature 2000;405:820-822. - 7. Eyster KM, Lindahl R. Molecular medicine: a primer for clinicians. Part XII: DNA microarrays and their application to clinical medicine. S D J Med 2001;54(2):57-61.
- 8. Cheung VG, Morley M, Aguilar F, Mássimi A, Kucherlapati R, Childs G. Making and reading microarrays. Nat Genet 1999;21(1 Suppl):15-9.
- 9. Eisenberg D, Marcotte EM, Xenarios I, Yeates TO. Protein function in the post-genomic era. Nature 2000;405(6788):823-6.
- 10. Feske S, Giltnane J, Dolmetsch R, Staudt LM, Rao A. Gene regulation mediated by calcium signals in T lymphocytes. Nat Immunol 2001;2(4):316-24.
- 11. Modur V, Nagarajan R, Evers BM, Milbrandt J. FOXO Proteins Regulate Tumor Necrosis Factor-related Apoptosis Inducing Ligand Expression. Implications for ten mutation in prostate cancer. J Biol Chem 2002;277(49):47928-37.
- 12. Alizadeh AA, Staudt LM. Genomic-scale gene expression profiling of normal and malignant immune cells. Curr Opin Immunol 2000;12(2):219-25.
- 13. Iizuka N, Oka M, Yamada-Okabe H, Mori N, Tamesa T, Okada T, et al. Comparison of gene expression profiles between hepatitis B virus- and hepatitis C virus-infected hepatocellular carcinoma by oligonucleotide microarray data on the basis of a supervised learning method. Cancer Res 2002;62(14):3939-44.
- 14. Davis RE, Staudt LM. Molecular diagnosis of lymphoid malignancies by gene expression profiling. Curr Opin Hematol 2002;9(4):333-8.
- 15. Shipp MA, Ross KN, Tamayo P, Weng AP, Kutok JL, Aguiar RC, et al. Diffuse large B-cell lymphoma outcome prediction by gene-expression profiling and supervised machine learning. Nat Med 2002;8(1):68-74.
- 16. Alizadeh AA, Eisen MB, Davis RE, Ma C, Lossos IS, Rosenwald A, et al. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature 2000;403(6769):503-11.
- 17. Ramáswamy S, Tamayo P, Rifkin R, Mukherjee S, Yeang CH, Angelo M, et al. Multiclass cancer diagnosis using tumor gene expression signatures. Proc Natl Acad Sci U S A 2001;98(26):15149-54.
- 18. Ramáswamy S, Golub TR. DNA microarrays in clinical oncology. J Clin Oncol 2002;20(7):1932-41.
- 19. Xu J, Stolk JA, Zhang X, Silva SJ, Houghton RL, Matsumura M, et al. Identification of differentially expressed genes in human prostate cancer using subtraction and microarray. Cancer Res 2000;60(6):1677-82.
- 20. Brem R, Hildebrandt T, Jarsch M, Van Muijen GN, Weidle UH. Identification of metastasis-associated genes by transcriptional profiling of a metastasizing versus a non-metastasizing human melanoma cell line. Anticancer Res 2001;21(3B):1731-40.
- 21. Zou J, Young S, Zhu F, Gheyas F, Skeans S, Wan Y, et al. Microarray profile of differentially expressed genes in a monkey model of allergic asthma. Genome Biol 2002;3(5):research0020.
- 22. Bacarese-Hamilton T, Mezzasoma L, Ingham C, Ardizzoni A, Rossi R, Bistoni F, et al. Detection of allergen-specific IgE on microarrays by use of signal amplification techniques. Clin Chem 2002;48(8):1367-70.
- 23. Holm AM, Bjerkeli V, Yndestad A, Aukrust P, Frôland SS. Gene expresion in common variable immunodeficiency. 10th Meeting of the European Society for Immunodeficiencies (ESID) 2002.
- 24. Heller RA, Schena M, Chai A, Shalon D, Bedilion T, Gilmore J, et al. Discovery and analysis of inflammatory disease-related genes using cDNA microarrays. Proc Natl Acad Sci U S A 1997;94(6):2150-5.
- 25. Guillemin K, Salama NR, Tompkins LS, Falkow S. Cag pathogenicity island-specific responses of gastric epithelial cells to Helicobacter pylori infection. Proc Natl Acad Sci U S A 2002;99(23):15136-41.
- 26. Belcher CE, Drenkow J, Kehoe B, Gingeras TR, McNamara N, Lemjabbar H, et al. From the cover: the transcriptional responses of respiratory epithelial cells to Bordetella pertussis reveal host defensive and pathogen counter-defensive strategies. Proc Natl Acad Sci U S A 2000;97(25):13847-52.
- 27. Blader IJ, Manger ID, Boothroyd JC. Microarray analysis reveals previously unknown changes in Toxoplasma gondii-infected human cells. J Biol Chem 2001;276(26):24223-31.
- 28. de Avalos SV, Blader IJ, Fisher M, Boothroyd JC, Burleigh BA. Immediate/early response to Trypanosoma cruzi infection involves minimal modulation of host cell transcription. J Biol Chem 2002;277(1):639-44.
- 29. Taylor LA, Carthy CM, Yang D, Saad K, Wong D, Schreiner G, et al. Host gene regulation during coxsackievirus B3 infection in mice: assessment by microarrays. Circ Res 2000;87(4):328-34.
- 30. Zhu H, Cong JP, Mamtora G, Gingeras T, Shenk T. Cellular gene expression altered by human cytomegalovirus: global monitoring with oligonucleotide arrays. Proc Natl Acad Sci U S A 1998;95(24):14470-5.
- 31. Chang YE, Laimins LA. Microarray analysis identifies interferon-inducible genes and Stat-1 as major transcriptional targets of human papillomavirus type 31. J Virol 2000;74(9):4174-82.
- 32. Bolt G, Berg K, Blixenkrone-Moller M. Measles virus-induced modulation of host-cell gene expression. J Gen Virol 2002;83(Pt 5):1157-65.
- 33. Becker Y. Herpes simplex virus evolved to use the human defense mechanisms to establish a lifelong infection in neurons—a review and hypothesis. Virus Genes 2002;24(2):187-96.
- 34. Fisher MA, Plikaytis BB, Shinnick TM. Microarray analysis of the Mycobacterium tuberculosis transcriptional response to the acidic conditions found in phagosomes. J Bacteriol 2002;184(14):4025-32.
- 35. Grifantini R, Bartolini E, Muzzi A, Draghi M, Frigimelica E, Berger J, et al. Previously unrecognized vaccine candidates against group B meningococcus identified by DNA microarrays. Nat Biotechnol 2002;20(9):914-21.
- 36. Graham MR, Smoot LM, Migliaccio CA, Virtaneva K, Sturdevant DE, Porcella SF, et al. Virulence control in group A Streptococcus by a two-component gene regulatory system: global expression profiling and in vivo infection modeling. Proc Natl Acad Sci U S A 2002;99(21):13855-60.
- 37. Cleary MD, Singh U, Blader IJ, Brewer JL, Boothroyd JC. Toxoplasma gondii asexual development: identification of developmentally regulated genes and distinct patterns of gene expression. Eukaryot Cell 2002;1(3):329-40.
- 38. Mezzasoma L, Bacarese-Hamilton T, Di Cristina M, Rossi R, Bistoni F, Crisanti A. Antigen microarrays for serodiagnosis of infectious diseases. Clin Chem 2002;48(1):121-30.
- 39. Aitman TJ. DNA microarrays in medical practice. BMJ 2001;323(7313):611-615.