Resumen
Debido a la pandemia por COVID-19 se han propuesto múltiples estrategias para prevenir su transmisión, siendo la vacunación la principal a nivel mundial. Se han aplicado más de 75 millones de dosis de vacunas contra COVID-19 en Colombia para 2022.
Documentamos e informamos un caso de síndrome de Guillain-Barré posterior a la aplicación del biológico ChAdOx1 nCoV-19 en Colombia, caracterizado por debilidad ascendente, parálisis facial, compromiso respiratorio y disautonomía. El diagnóstico se confirmó correlacionando la presentación clínica con el análisis del líquido cefalorraquídeo, estudios de neuroconducción y resonancia magnética cerebral.
Se trató con inmunoglobulina, con posterior estabilización y mejoría clínica. Los clínicos deben estar alertas ante este posible evento adverso asociado con la vacunación contra COVID-19 y reportarlo a los entes de farmacovigilancia.
Keywords: COVID-19; SARS-CoV-2; vacunación; síndrome de Guillain-Barré; AstraZeneca.
Guillain-Barré Syndrome Associated with Chadox1-S Vaccine Against Covid-19
Abstract
Due to the COVID-19 pandemic, multiple strategies have been proposed to prevent its transmission, with vaccination being the main one worldwide.
More than 75 million doses of COVID-19 vaccines have been applied in Colombia by 2022. We documented and reported a case of Guillain-Barré syndrome after the application of the biological ChAdOx1 nCoV-19 in Colombia, characterized by ascending weakness, facial paralysis, respiratory compromise and dysautonomia.
The diagnosis was confirmed by correlating the clinical presentation with cerebrospinal fluid analysis, neuroconduction studies and brain magnetic resonance imaging.
It was treated with immunoglobulin, with subsequent stabilization and clinical improvement. Clinicians should be alert to this possible adverse event associated with COVID-19 vaccination and report it to pharmacovigilance entities.
Key words: COVID-19; SARS-CoV-2; vaccination; Guillain-Barré syndrome; AstraZeneca
Introducción – Síndrome de Guillain-Barré Asociado a la Vacuna Chadox1-S contra Covid-19
Según cifras de la Organización Mundial de la Salud, hay más de 387 millones de casos confirmados por enfermedad del coronavirus de 2019 (COVID-19) y más de 5 millones de muertes para febrero de 2022 (1).
La vacunación masiva contra la infección por “severe acute respiratory síndrome coronavirus 2” (SARS-CoV-2) es prioridad global, por lo que, desde 2020 se han aprobado varias vacunas con carácter de emergencia, con el objetivo de disminuir la curva de la pandemia.
La vacuna ChAdOx1 nCoV-19 (AstraZeneca) es una vacuna efectiva (70,4 % luego de dos dosis) y bien tolerada contra COVID-19. Consiste en un vector adenoviral deficiente de chimpancé, que contiene la proteína de espiga de superficie del SARS-CoV-2 (2-4).
Sin embargo, las preocupaciones con la seguridad de dicha vacuna son crecientes, ya que, ésta se ha relacionado con eventos adversos luego de su administración, tales como mielitis severa, eventos tromboembólicos, trombocitopenia y síndrome de Guillain-Barré (SGB) (2,3,5).
En este manuscrito, informamos un caso de SGB luego de la primera dosis de la vacuna ChAdOx1 nCoV-19.
Descripción del caso – Síndrome de Guillain-Barré Asociado a la Vacuna Chadox1-S contra Covid-19
Femenina de 21 años, sin antecedentes patológicos relevantes, ingresa a urgencias con clínica de 6 horas de evolución de cuadriparesia iniciando en miembros inferiores y posterior progresión a miembros superiores, lo que dificultaba la marcha, asociada a parestesias generalizadas. Además, cefalea occipital y disartria.
Al examen físico: parálisis hemicraneana izquierda, cifras tensionales elevadas, taquicárdica, taquipneica, saturación de oxígeno periférico adecuada, arreflexia e hipoestesia de miembros inferiores, sin signos meníngeos, y el resto del examen físico sin alteraciones, orientándose como polineuropatía inflamatoria aguda.
Se documentó aplicación de primera dosis del biológico ChAdOx1 nCoV-19 (AstraZeneca) 10 días antes de la sintomatología.
Evoluciona tortuosamente, con compromiso para la deglución, asociando rigidez de nuca y disautonomía, por lo que, ante el carácter ascendente del compromiso neurológico es enviada a unidad de cuidados intensivos (UCI) bajo sospecha de SGB.
Química sanguínea de ingreso sin alteraciones, TSH (1,10 mUI/L) y T4 libre (2,48 ng/dL) normales, tomografía de cráneo simple normal, realizándose punción lumbar, electromiografía y velocidad de conducción de 4 extremidades.
Evolución tórpida con compromiso en mecánica ventilatoria y progresión de parálisis ascendente, ameritando soporte ventilatorio invasivo. Estudio de LCR muestra disociación albumino-citológica y desestima otras etiologías (tabla 1).
Tabla 1. Análisis del líquido cefalorraquídeo.
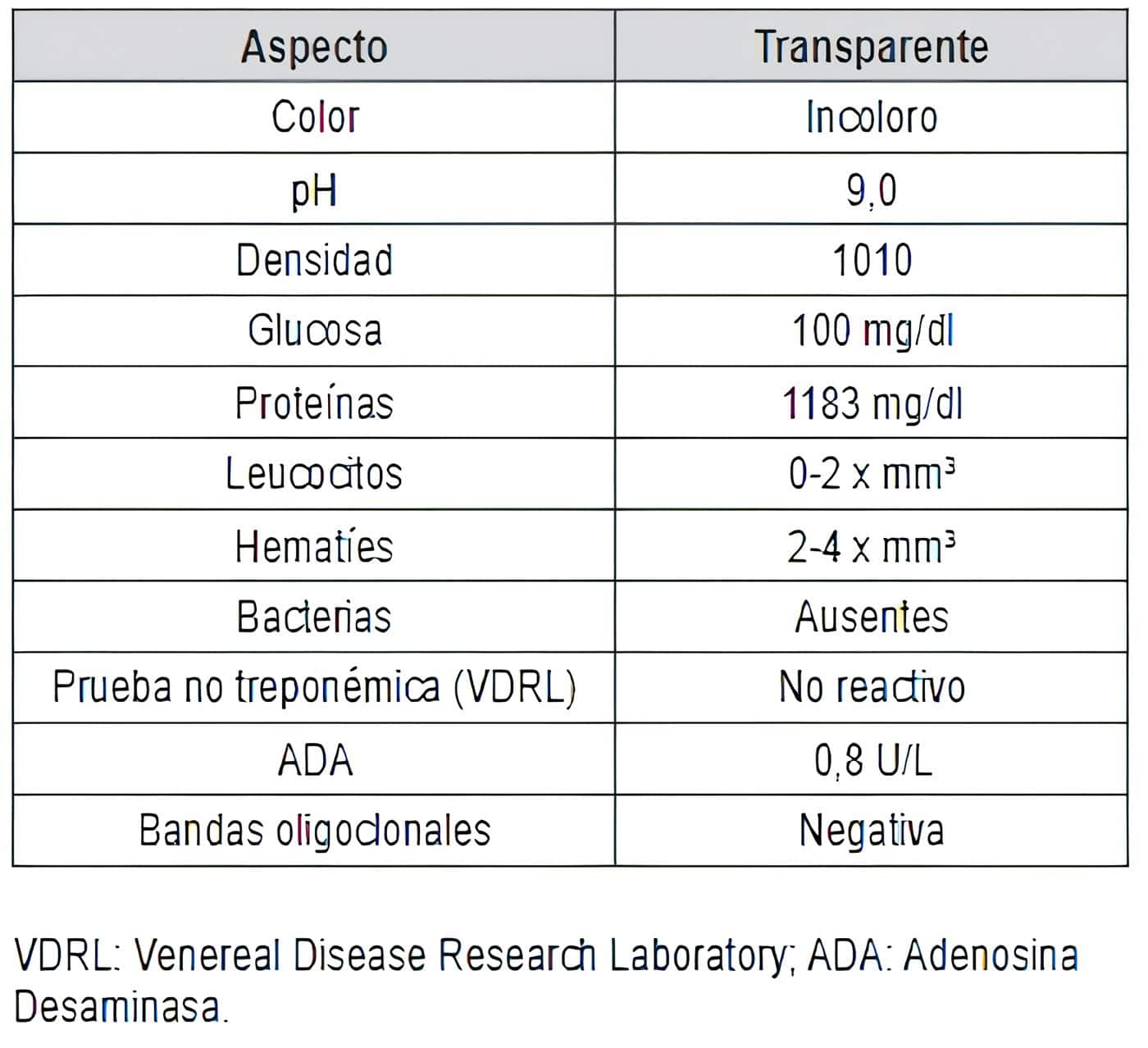
Perfil inmunológico e infeccioso negativos en paciente sin antecedentes. Electromiografía y velocidad de neuroconducción con ausencia de denervación, pero con bloqueo de la conducción de los nervios mediano, cubital, peroneo y tibial lateral, hallazgos compatibles con polineuropatía inflamatoria aguda.
Por otro lado, le realizan resonancias magnéticas nucleares de todo el neuroeje, evidenciando malformación de Chiari tipo I, sin alteraciones de la columna cervical, escoliosis leve de convexidad izquierda a nivel de S1 sin lesiones hemorrágicas ni ocupantes de espacio a través de todo el canal medular, hallazgos desestimados como causantes del cuadro clínico descrito (figura 1).
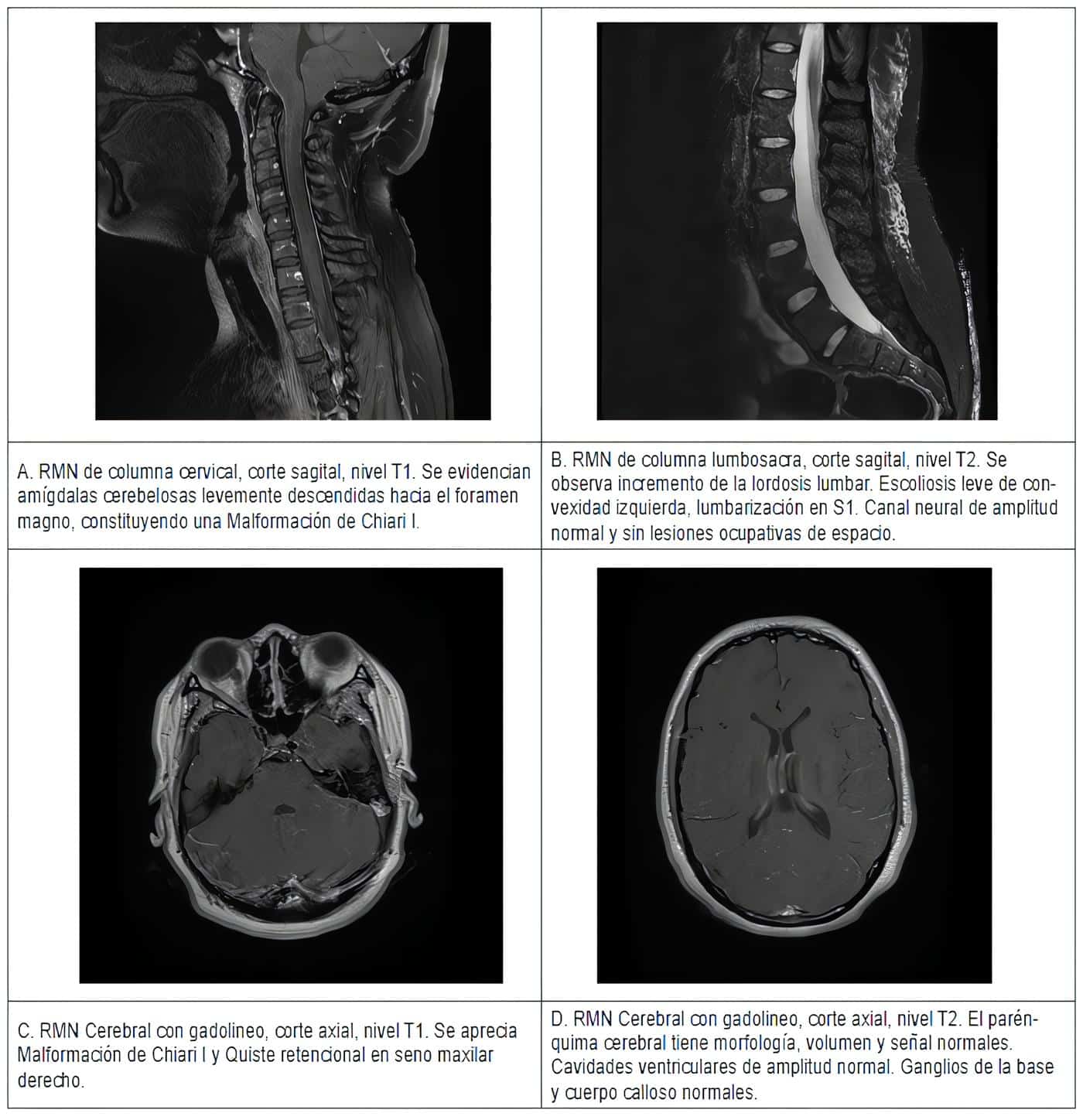
Figura 1. Imágenes de resonancia magnética nuclear (RMN) del paciente.
Con estos datos se configura diagnóstico de SGB y se inicia terapia inmunomoduladora con inmunoglobulina G humana a 0,4 g/kg/d por 5 días. Adicionalmente, se realiza rehabilitación integral con mejoría progresiva de fuerza muscular y mecánica ventilatoria, favoreciendo extubación programada.
Es egresada de la UCI en programa de rehabilitación, lográndose recuperación de independencia funcional, con posterior egreso a domicilio, con debilidad muscular residual leve, bajo seguimiento ambulatorio con neurología clínica y suplemento vitamínico con tiamina y complejo B. No se documentaron otras vacunaciones. No se evaluó evolución luego del egreso.
En resumen, se consideró un SGB secundario a la inmunización contra la COVID-19 con el biológico de AstraZeneca, dado el curso clínico, compromiso motor, evidencia en estudios neurofisiológicos, disociación albumino-citológica en el LCR y la mejoría marcada posterior al inicio de la inmunoterapia.
Actualmente la paciente está asintomática, por indicación de infectología no se realizó vacunación posterior.
Discusión – Síndrome de Guillain-Barré Asociado a la Vacuna Chadox1-S contra Covid-19
El SGB es la causa más común de debilidad neuromuscular aguda alrededor del mundo, estimando unos 100.000 casos anuales (6-8).
Es una enfermedad inmunomediada de los nervios periféricos, puede ser de origen infeccioso, incluyendo el SARS-CoV-2. Se han descrito casos raros de SGB posterior a inmunización con distintas vacunas.
En la campaña de vacunación global contra la COVID-19 se ha establecido una probable relación causal entre estas (8-9). Se han reportado varios casos de SGB luego de vacunación con ChAdOx1 nCoV-19 (2,9-13,16-18) (Tabla 2).
Tabla 2. Casos de SGB asociado a vacunación con ChAdOx1-S en la búsqueda bibliográfica realizada .
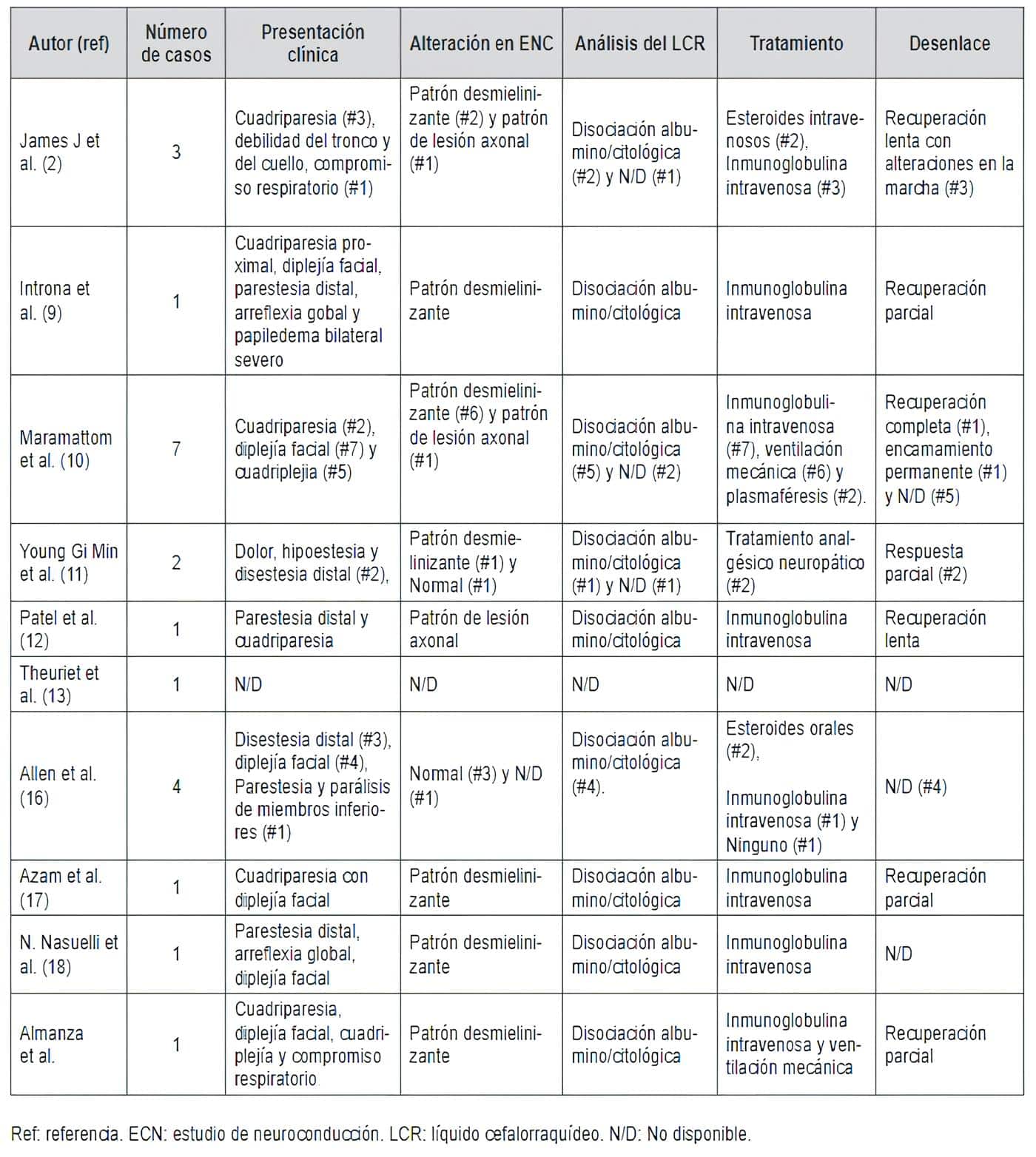
En la literatura revisada, este sería el primer reporte de caso de SGB posterior a vacunación con el biológico ChAdOx1 nCoV-19 en Colombia. Con las vacunas restantes disponibles, se identificó un caso relacionado con Sinovac (6).
Se estableció el diagnóstico de SGB siguiendo los criterios de Brigthon8 , ya que la paciente presentó cuadriparesia, arreflexia, ausencia de un diagnóstico alternativo, un cuadro clínico dentro de los primeros 28 días luego de la exposición al biológico, disociación albumino-citológica en el LCR y la evidencia electromiográfica de neuropatía (bloqueo de la conducción), alcanzando un nivel 1.
Se calculó la escala de reacción adversa de Naranjo, obteniendo 3 puntos, lo cual sugiere una asociación posible entre la vacunación y el SGB (14).
Los síntomas y signos de nuestro paciente son compatibles con otros informes posteriores a vacunación con ChAdOx1 nCoV- 19, principalmente déficit sensitivomotor, compromiso respiratorio y disautonomía (2,11), neuroimágenes normales12, proteínas elevadas en LCR (2,10-12), alteraciones en la conducción nerviosa (2,9-11) y mejoría clínica luego de la administración de inmunoglobulina (2,11).
No se documentaron infecciones recientes, incluyendo COVID-19 y se descartaron etiologías adicionales, proponiéndose la vacunación con ChAdOx1 nCoV-19 como causa del SGB.
Las infecciones por adenovirus humanos pueden producir SGB (2), por lo que, el adenovirus de simio que es usado como vector en la vacuna ChAdOx1 nCoV-19 podría ser eventualmente el factor desencadenante del SGB.
Los casos de SGB asociados a la vacunación son raros, no obstante, se ha reportado una incidencia considerable de SGB luego de la aplicación de la vacuna contra el H1N115. A pesar del hallazgo de malformación de Chiari tipo I, se descartó como etiología ante respuesta clínica favorable a tratamiento con inmunoglobulina, tratamiento de elección para SGB junto a la plasmaféresis (7,8).
Al ser un reporte único de caso, no es posible establecer una relación causal directa, sin embargo, a medida que aumenta la vacunación, también debería aumentar la vigilancia activa en estos casos, logrando una detección y manejo oportuno.
Estudios más grandes deben ser realizados para determinar si hay una relación entre el SGB y la vacunación con ChAdOx1 nCoV-19.
Consideraciones Éticas – Síndrome de Guillain-Barré Asociado a la Vacuna Chadox1-S contra Covid-19
Este manuscrito ha sido realizado con el aval del comité de ética de la Clínica y con el consentimiento de la paciente estudiada.
Referencias – Síndrome de Guillain-Barré Asociado a la Vacuna Chadox1-S contra Covid-19
1.Geo-Hub COVID-19 6. Geo-Hub COVID-19 – Information System for the Region of the Americas [Internet]. Paho-covid19-response-who.hub.arcgis.com. 2022 [consultado 31 enero 2022]. Disponible en:
https://pahocovid19-response-who.hub.arcgis.com/
2. James J, Jose J, Gafoor VA, Smita B, Balaram N. Guillain-Barré syndrome following ChAdOx1 nCoV-19 COVID-19 vaccination: A case series. Neurol Clin Neurosci. 2021;9(5):402-405. .
3. Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med. 2021;384(22):2092-2101.
4. Falsey AR, Sobieszczyk ME, Hirsch I, Sproule S, Robb ML, Corey L, et al. Phase 3 Safety and Efficacy of AZD1222 (ChAdOx1 nCoV-19) Covid-19 Vaccine. N Engl J Med. 2021;385(25):2348-2360.
5. Tobaiqy M, Elkout H, MacLure K. Analysis of Thrombotic Adverse Reactions of COVID-19 AstraZeneca Vaccine Reported to EudraVigilance Database. Vaccines (Basel). 2021;9(4):393.
6. Angarita Diaz JA, Cardenas Sandoval MP. Síndrome de Guillain-Barré tras vacunación contra SARSCoV-2 con Sinovac®. Acta Neurológica Colombiana. 2021;37(2):107-108.
7. Liu S, Dong C, Ubogu EE. Immunotherapy of Guillain-Barré syndrome. Hum Vaccin Immunother. 2018;14(11):2568-2579.
8. Shahrizaila N, Lehmann HC, Kuwabara S. Guillain-Barré syndrome. Lancet. 2021;397(10280):1214-1228.
Bibliografía – – Síndrome de Guillain-Barré Asociado a la Vacuna Chadox1-S contra Covid-19
9. Introna A, Caputo F, Santoro C, Guerra T, Ucci M, Mezzapesa DM, Trojano M. Guillain-Barré syndrome after AstraZeneca COVID-19-vaccination: A causal or casual association? Clin Neurol Neurosurg. 2021;208:106887.
10. Maramattom BV, Krishnan P, Paul R, Padmanabhan S, Cherukudal Vishnu Nampoothiri S, Syed AA, Mangat HS. Guillain-Barré Syndrome following ChAdOx1-S/ nCoV-19 Vaccine. Ann Neurol. 2021;90(2):312-314.
11. Min YG, Ju W, Ha YE, Ban JJ, Lee SA, Sung JJ, Shin JY. Sensory Guillain-Barre syndrome following the ChAdOx1 nCov-19 vaccine: Report of two cases and review of literature. J Neuroimmunol. 2021;359:577691.
12. Patel SU, Khurram R, Lakhani A, Quirk B. Guillain-Barre syndrome following the first dose of the chimpanzee adenovirus-vectored COVID-19 vaccine, ChAdOx1. BMJ Case Rep. 2021;14(4):e242956.
13. Theuriet J, Richard C, Becker J, Pegat A, Bernard E, Vukusic S. Guillain-Barré syndrome following first injection of ChAdOx1 nCoV-19 vaccine: First report. Rev Neurol (Paris). 2021;177(10):1305-1307.
14. LiverTox: Clinical and Research Information on DrugInduced Liver Injury. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases; 2012–. Adverse Drug Reaction Probability Scale (Naranjo) in Drug Induced Liver Injury. 2019;.
15. Salmon DA, Proschan M, Forshee R, Gargiullo P, Bleser W, Burwen DR, et al. Association between Guillain-Barré syndrome and influenza A (H1N1) 2009 monovalent inactivated vaccines in the USA: a meta-analysis. Lancet. 2013;381(9876):1461-8..
Autores – Síndrome de Guillain-Barré Asociado a la Vacuna Chadox1-S contra Covid-19
1 Amilkar José Almanza-Hurtado, Tomás Rodríguez-Yanez, Departamento de Medicina Crítica y Cuidados Intensivos. Universidad de Cartagena. Cartagena, Colombia.
2 Ángel Vásquez Jiménez , Juan Camilo Gutiérrez-Ariza, Grupo de investigación de Infectología y enfermedades tropicales. Universidad del Sinú. Cartagena, Colombia
3 María Cristina Martínez-Ávila, Departamento de Epidemiología y Salud Pública. Grupo de investigación ciencias biomédicas toxicológicas y ambientales BIOTOXAM. Universidad de Cartagena. Cartagena, Colombia.
4 Jorge Rico-Fontalvo , Rodrigo Daza-Arnedo, Asociación Colombiana de Nefrología, Bogotá. Colombia
5 Hasmet Gregorio González Macea, Departamento de Medicina Interna. Universidad del Sinú. Cartagena, Colombia.
Recibido: 23 de febrero de 2022
Aceptado: 15 de marzo de 2022
Correspondencia:
María Cristina Martínez-Ávila
cristina.martinezavila@gmail.com