Resumen
La pandemia del nuevo coronavirus, iniciada a finales de diciembre de 2019 en Wuhan, provincia de Hubei, China, como una neumonía causada por un nuevo virus, ha creado un pandemónium en la atención médica y tiene los sistemas de salud desbordados en todo el mundo.
El hemograma, una de las pruebas más solicitadas al laboratorio clínico, imprescindible en la práctica médica del día a día, en el contexto del paciente infectado por SARS-CoV-2 suministra predictores o biomarcadores que han demostrado ser eficientes como la neutrofilia, la linfopenia, la trombocitopenia, el índice neutrófilos/ linfocitos, el ancho de distribución de los eritrocitos y el ancho de distribución de los monocitos para predecir la evolución del COVID-19.
Además de los predictores, el hemograma provee parámetros de utilidad clínica como la hemoglobina reticulocitaria, el índice de plaquetas inmaduras y la morfología en los extendidos de sangre periférica que permiten un manejo más eficiente de la enfermedad.
Se presenta una revisión de la literatura médica indexada, orientada a identificar en el hemograma predictores y herramientas de diagnóstico de utilidad en el curso de la infección por SARS-CoV-2.</p>
Palabras clave: SARS-CoV-2; COVID-19; hematología; hemograma; predictores.
Blood Count as a Predictor in Sars-Cov-2 Infection
Abstract
The new coronavirus pandemic, which began in late December 2019 in Wuhan, Hubei province, China, as a pneumonia caused by a new virus, has created a pandemonium in medical care and has overwhelmed health systems around the world.
The complete blood count, one of the most requested tests in the clinical laboratory, essential in day-to-day medical practice, in the context of the patient infected with SARS-CoV-2, provides predictors or biomarkers that have proven to be efficient, such as neutrophilia, lymphopenia, thrombocytopenia, the neutrophil/lymphocyte ratio, the erythrocyte distribution width, and the monocyte distribution width have been shown to be efficient in predicting the evolution of COVID-19.
In addition to the predictors, the complete blood count provides clinically useful parameters such as reticulocyte hemoglobin, the immature platelet index, and morphology in peripheral blood smears that allow for more efficient management of the disease.
A review of the indexed medical literature is presented, aimed at identifying useful predictors and diagnostic tools in the blood count in the course of SARS-CoV-2 infection.
Key words: SARS-CoV-2; COVID-19; hematology; complete blood count; predictors.
Introducción – Hemograma Predictor en la Infección por Sars-Cov-2
La pandemia del nuevo coronavirus, iniciada a finales de diciembre de 2019 en Wuhan, provincia de Hubei, China, como una neumonía causada por el coronavirus 2 (SARS-CoV-2) (por su siglas en inglés Severe Acute Respiratory Syndrome coronavirus 2) (1), ha creado un pandemónium global en la atención médica.
Desde su aparición a finales de diciembre 2019 hasta el 31 de enero de 2022, se han informado 373.3 millones de casos, 5.7 millones de muertes a nivel mundial (2), 5.9 millones de casos y 134 mil muertes en Colombia (3), cifras que están por debajo de la realidad debido al subregistro que se presenta en todo el mundo, ya que se estiman tres a cuatro veces las cifras reales y que continúan en aumento, muy lejos de la solución definitiva.
De acuerdo con el Instituto Nacional de Salud de Estados Unidos de América (NIH por su sigla en inglés National Institute of Health), la infección por SARSCoV-2, que se expresa como COVID-19.
Según los síntomas y signos puede ser clasificada en cinco categorías a saber:
(1) Infección asintomática o presintomática: pacientes con COVID-19 confirmados con una prueba virológica que puede ser una prueba de amplificación de ácido nucleico PCR o una prueba de antígeno en personas que no presentan síntomas;
(2) Enfermedad leve: pacientes con signos y síntomas de COVID-19 como fiebre, tos, dolor de garganta, malestar general, dolor de cabeza, dolor muscular, náuseas, vómito, diarrea y pérdida del gusto y del olfato; sin dificultad para respirar, disnea o imágenes de tórax anormales;
(3) Enfermedad moderada: pacientes con afectación de las vías respiratorias bajas, evidenciada clínica o radiológicamente, pero saturación de oxígeno (SpO2) ≥ 94 % a nivel del mar;
(4) Enfermedad grave: pacientes con frecuencia respiratoria superior a 30 respiraciones/minuto, SpO2 < 94 % a nivel del mar, una relación presión arterial parcial de oxígeno a fracción de oxígeno inspirado (PaO2/FiO2) < 300 mmHg a o compromiso pulmonar de más del 50 %; y,
(5) Enfermedad crítica: pacientes con insuficiencia respiratoria, shock séptico y/o disfunción multiorgánica (4), clasificación que será utilizada en el curso de la presente revisión bibliográfica.
En el mundo entero, con sistemas de salud desbordados por la pandemia por SARS-CoV-2:
Hay una necesidad apremiante de identificar predictores o biomarcadores clínicos y de laboratorio para la estratificación temprana del riesgo de formas graves, críticas e incluso letales de la enfermedad. En el caso del SARS-CoV-2, los predictores pueden ser clínicos o paraclínicos.
Dentro de los predictores clínicos de mal pronóstico se incluyen la edad avanzada, el género masculino y las comorbilidades como hipertensión, diabetes mellitus, enfermedades cardiovasculares, obesidad, enfermedad pulmonar obstructiva crónica, nefropatías, cáncer y la inmunosupresión.
Dentro de los predictores paraclínicos, además del hemograma que será analizado en esta revisión, se dispone de la proteína C reactiva, la ferritina sérica, la procalcitonina, la interleucina 6, el dímero D, el propéptido natriurético de tipo cerebral (proBNP), la troponina I, la deshidrogenasa láctica y la creatinina, entre otros referenciados en la literatura médica indexada.
El objetivo de esta revisión bibliográfica es analizar los cambios que se presentan en el hemograma, una de las pruebas más solicitadas al laboratorio clínico en el curso de la infección por SARS-CoV-2, identificando los parámetros o variables analíticas que puedan utilizarse como predictores de la enfermedad y que permitan tomar decisiones oportunas orientadas a prevenir la progresión hacia formas severas de la enfermedad, para guiar el tratamiento adecuado y el uso óptimo de los recursos médicos.
Alteraciones en el hemograma
El hemograma, con más de 375 publicaciones de análisis de su uso en COVID-19 en la literatura médica indexada, se constituye en un excelente predictor en la infección por SARS-CoV-2.
Para desarrollar el tema, y por conveniencia didáctica, las alteraciones se analizarán subdividiendo arbitrariamente el hemograma de acuerdo con los parámetros relacionados con sus tres componentes básicos: los eritrocitos, los leucocitos y las plaquetas como el eritrograma, el leucograma y el trombograma (5).
Además, se analizarán los cambios de la morfología en los extendidos de sangre periférica y los índices hematológicos de los pacientes con COVID-19.
Alteraciones en el eritrograma
Desde el punto de vista de su valor como predictor, la mayoría de los autores que han explorado los cambios en el eritrograma en pacientes con COVID-19 coinciden en que este grupo de parámetros, en particular la hemoglobina, el recuento de eritrocitos y el hematocrito no muestran cambios significativos que desplacen los valores de los diferentes parámetros más allá de los valores de referencia, y por lo tanto, no son buenos candidatos a predictores del curso de la enfermedad (6).
La infección por SARS-CoV-2 per se, no alcanza a desarrollar anemia (6), y cuando esta se presenta puede asociarse con una ferropenia funcional por infección crónica, por pérdida crónica de sangre (7), incluida la que se puede presentar por las múltiples flebotomías que con destino al laboratorio clínico se le practican regularmente a estos pacientes (8), porque el paciente desarrolle una anemia hemolítica mediada por anticuerpos (9,10) o por medicamentos como la cloroquina en pacientes con una enzimopatía como la deficiencia de la glucosa-6-fosfato (11) o que el paciente tenga una anemia microangiopática (12) o una púrpura trombótica trombocitopénica (13).
De igual manera, los volúmenes corpusculares, también conocidos como los promedios de Wintrobe, como el volumen corpuscular medio, la hemoglobina corpuscular media y la concentración de la hemoglobina corpuscular media, en el caso de los pacientes con COVID-19 no tienen cambios significativos que puedan ser utilizados como trazadores de la infección.
De los nuevos parámetros eritrocitarios desarrollados en los autoanalizadores de hematología, disponibles en la mayoría de los laboratorios clínicos:
El que más llama la atención con carácter de predictor es el ancho de distribución de los eritrocitos, (RDW por su sigla en inglés Red blood cell Distribution Width) que en la práctica expresa el grado de anisocitosis (tamaños diferentes) de los glóbulos rojos (5).
Desde hace años se ha demostrado que el aumento del RDW está asociado con mayor morbilidad y mortalidad en enfermedad cardiovascular, tromboembolismo venoso, cáncer, diabetes, neumonía adquirida en la comunidad, enfermedad pulmonar obstructiva crónica, insuficiencia hepática e insuficiencia renal, entre otras muchas situaciones médicas (14) y en la población general adulta como posible indicador de enfermedad oculta (15).
Con relación al RDW como predictor en la infección por SARSCoV-2, la mayoría de los estudios que han abordado el tema coinciden en que este se encuentra aumentado significativamente en pacientes con COVID-19 en estado grave o crítico, con los pacientes usualmente en unidad de cuidados intensivos, en comparación con los pacientes ambulatorios o con enfermedad en estados asintomáticos, leves o moderados, constituyéndose en un predictor de mal pronóstico (16), íntimamente relacionado con la gravedad de la enfermedad (17) y con la posibilidad de un desenlace mortal (18).
Otros parámetros eritrocitocitarios incorporados a los nuevos autoanalizadores de hematología:
En particular los reticulocitos y la hemoglobina reticulocitaria, han sido poco estudiados en pacientes infectados por SARS-CoV-2, y los datos hasta el momento no permiten evaluarlos como predictores de la infección, pero son de utilidad clínica en el manejo de algunas de sus complicaciones.
En el caso de los reticulocitos, su utilidad clínica se limita a una pocas indicaciones que podrían presentarse en pacientes en estado grave o crítico con manifestaciones de hemólisis de origen autoinmune (19), incluida la que se pueda presentar por cloroquina -cuando esta hace parte del tratamiento- (20), en donde los reticulocitos estarían característicamente elevados.
Con relación a la hemoglobina reticulocitaria, un marcador de deficiencia de hierro (21), ya sea funcional por enfermedad crónica como sucede en las infecciones (22) y la SARS-CoV-2 es una de ellas, y la deficiencia de hierro clásica, por sangrado crónico como se puede presentar en estos paciente (23), incluidas las múltiples flebotomías que se les practican particularmente a pacientes con largas hospitalizaciones (8), en quienes la hemoglobina reticulocitaria estaría característicamente reducida (< 19 pg) (21).
Alteraciones en el leucograma
A lo largo de la infección por SARS-CoV-2 los leucocitos presentan alteraciones en número, distribución y morfología que puede variar con el curso y la gravedad de la infección. Las alteraciones en el leucograma del paciente con COVID-19 pueden estar relacionadas con el recuento total o diferencial de leucocitos como se analizará a continuación.
Recuento total de leucocitos
En las etapas iniciales de la infección por SARS-CoV-2 el recuento total de leucocitos (VR 4.500 a 11.000 por µL) (5) usualmente es normal o presenta cambios mínimos e inespecíficos, y las variaciones cuantitativas solo aparecen en la medida en que la enfermedad progresa a estados más avanzados o críticos (24).
Con relación al recuento de leucocitos en la infección por SARSCoV-2 se presentan dos patrones: el patrón del paciente, en donde la infección cursa como una enfermedad viral típica con resolución después de unos días, y el patrón del paciente que no resuelve la enfermedad y esta avanza a estados graves o críticos.
La leucocitosis se presenta como resultado de la neutrofilia que sucede a la tormenta de citoquinas en las etapas iniciales cuando el virus invade el organismo y depende del inóculo, de la cepa infectante y de la respuesta inmunológica de cada individuo infectado (25).
La prevalencia de los cambios en el leucograma en las etapas tempranas de los pacientes asintomáticos y manifestaciones de enfermedad no grave son escasas en la literatura médica porque simplemente más allá de las pruebas de diagnóstico no se han establecido protocolos de estudios para estos pacientes, de tal manera que se detecten las poblaciones de pacientes con mayor riesgo de cursar a una enfermedad más grave que requiera hospitalización y ponga en riesgo la vida del paciente (26).
Desde el punto de vista de la leucocitosis como predictor de la infección por SARS-CoV-2 en pacientes en estado grave o crítico y de acuerdo con el metaanálisis de Yamada y colaboradores, que incluyó 3.278 pacientes con COVID-19 en estado crítico, la leucocitosis asociada con elevación de la proteína C reactiva y fiebre es un predictor de mal pronóstico y de desenlace fatal (27).
Recuento diferencial de leucocitos
El recuento diferencial de leucocitos expresa en valores absolutos los cinco componentes del leucograma: neutrófilos, eosinófilos, basófilos, linfocitos y monocitos; (5) y en el caso de los pacientes infectados por SARS-CoV-2, pueden ser utilizados como predictores de gravedad de la enfermedad y de mortalidad, como se analizará en los siguientes subtítulos. Para mejor comprensión se analizarán en forma independiente, célula por célula.
Neutrófilos
Dependiendo de la carga del inóculo, de la virulencia de la cepa y de la respuesta inmunológica del paciente, una vez que se inicia la colonización de los órganos blanco se liberan sustancias tóxicas o se destruyen las células relacionadas y causa inflamación, lo que estimula quimio-tácticamente la agregación de neutrófilos y liberación de una gran cantidad de mediadores inflamatorios y citocinas (28-30), situación que lleva a una neutrofilia.
Desde el punto de vista de la neutrofilia como predictor en pacientes infectados por SARS-CoV-2:
Múltiples estudios han demostrado que la elevación del recuento absoluto de neutrófilos se correlaciona positivamente con la gravedad de la enfermedad y la duración de la estancia en el hospital significativamente mayor tanto en adultos (31) como en niños (32).
Cuando se compara con los diferentes grupos de la INH, la neutrofilia, per se, en pacientes con enfermedad grave y crítica es un predictor de mal pronóstico (33), riesgo que se potencia cuando concomitantemente el paciente desarrolla linfopenia, como se analizará más adelante.
Finalmente, al momento de evaluar la neutrofilia en un paciente con COVID-19, hay que recordar la posibilidad de estar frente a un paciente con una infección bacteriana superpuesta (34), situación que se puede presentar en pacientes con estancias prolongadas en la unidad de cuidados intensivos y que agrega un factor más de mal pronóstico (24).
Durante este período y en el curso de la enfermedad también se presentan alteraciones morfológicas de los neutrófilos, alteraciones que serán analizadas más adelante.
Además de la neutrofilia en algunos pacientes, usualmente en aquellos críticamente enfermos, íntimamente relacionados con la tormenta de citosinas o la sobreinfección concomitante:
Se puede encontrar desviación a la izquierda o reacción leucoeritroblástica con la presencia de bandas, metamielocitos y eritroblastos (35) y elevación del ancho de distribución de los neutrófilos (NDW por su sigla en inglés de Neutrophil volume Distribution Width), un nuevo parámetro derivado de los autoanalizadores de hematología, de utilidad en el estudio de los procesos infecciosos agudos (36) y, que en el caso de la infección por SARS-CoV-2 -aunque hasta el momento no hay informes en la literatura médica indexada- podría estar presente en pacientes críticamente enfermos, particularmente en aquellos con sepsis asociada.
Solo para enunciarlo, como un hallazgo hematológico descrito en la infección por SARS-CoV-2 relacionado con el recuento de los neutrófilos es el desarrollo de agranulocitosis (< 1.000 neutrófilos por µL) en la etapa de recuperación en un paciente que estuvo en estado crítico (37).
Eosinófilos
Con los eosinófilos como predictores de la infección por SARS-CoV-2 se presentan dos posibilidades: la eosinofilia y la eosinopenia.
La eosinofilia (> 500 eosinófilos por µL) representa un factor de buen pronóstico, con un curso clínico más leve y mejores resultados de la enfermedad en comparación con aquellos sin eosinofilia (38).
Contario a la eosinofilia, la mayoría de los pacientes con enfermedad grave o crítica tiene eosinopenia (< 100 eosinófilos por µL) de acuerdo con el metaanálisis de Zhang y colaboradores que incluyó 4.663 pacientes gravemente enfermos. El 58,4 % de los pacientes presenta eosinopenia profunda (39).
La eosinopenia como predictor de la infección por SARSCoV-2 es un importante indicador de severidad de la enfermedad (40) y un predictor de muerte en pacientes de la unidad de cuidados intensivos más que una causa de ingreso a la misma (41).
De otro lado, el recuento de eosinófilos se normaliza en la medida en que el paciente se va recuperando, por lo que puede ser considerado como un predictor de mejoría y recuperación en pacientes con COVID-19 (42).
Basófilos
Revisada la literatura médica indexada hay poca información sobre los basófilos en pacientes con COVID-19. De acuerdo con Tong y colaboradores, los basófilos en pacientes con COVID-19 en pacientes no sobrevivientes comparados con sobrevivientes, disminuyen significativamente, llegando a desaparecer del recuento diferencial del hemograma (43).
Solo un grupo de investigadores, Murdaca y colaboradores, considera que la desaparición de los basófilos en el recuento diferencial de leucocitos en pacientes con COVID-19 podría ser un predictor de mal pronóstico (44).
Linfocitos
El papel de los linfocitos es vital en los pacientes con COVID-19 y las variaciones en sangre periférica han demostrado en múltiples estudios su potencial como predictor en pacientes infectados por SARS-CoV-2 (45-48).
La linfopenia en los pacientes infectados por SARSCoV-2 se produce al menos por dos vías: por invasión directa de linfocitos por SARS-CoV-2, posible gracias a la presencia de la enzima convertidora de angiotensina 2 (ACE2) en estas células y posterior lisis celular, y por la atrofia de los órganos linfáticos secundarios a través de la intensa actividad de las citocinas, como la interleucina-4, la interleucina-6 y la interleucina-10 que interrumpen el recambio linfocitario, y aumenta la apoptosis de estas células (49).
Es claro que la disminución de linfocitos está inversamente relacionada con la carga de ARN del SARS-CoV-2, por lo que la linfopenia es más acusada?? en las formas graves, con las subpoblaciones de linfocitos T CD4+ y T CD8+ reducidas significativamente en los pacientes de la unidad de cuidados intensivos (49-52).
Los linfocitos son indispensables en el aclaramiento viral. La linfopenia se entiende como un factor pronóstico negativo dado que los pacientes que no sobreviven tienen un descenso profundo de linfocitos T CD4+ (49).
Además, la linfopenia aumenta el riesgo de muerte durante la hospitalización y, según un metaanálisis de Zhao y colaboradores, que incluyó 2.282 pacientes, se estima que la linfopenia al momento del diagnóstico triplica el riesgo de progresión hacia enfermedad grave, denotando así su carácter predictivo (45).
Monocitos
En relación con los monocitos en pacientes con SARSCoV-2, los informes son conflictivos, cuando para algunos autores hay monocitosis (> 900 monocitos por µL) (53,54) otros no encuentran variaciones significativas en el recuento (55), y unos pocos informan monocitopenia (< 300 monocitos por µL) (56), por lo que no son un buen candidato como predictor en la infección por SARS-CoV-2, esto no significa que no tengan un papel importante en la infección en relación con los cambios morfológicos de los monocitos.
Como se anticipó, dentro de los nuevos parámetros de los autoanalizadores de hematología relacionados con los monocitos está el ancho de distribución de monocitos (MDR por su sigla en inglés Monocyte Distribution Width) que representa los cambios en la distribución del tamaño de los monocitos (5), describe los cambios en el tamaño de los monocitos y puede indicar la progresión de una infección localizada a una infección sistémica (57), superior a la proteína C reactiva, la interleuquina-6 y el recuento de leucocitos para predecir la sepsis (58).
En el caso de la infección por SARS-CoV-2, un estudio reciente ha demostrado que la combinación del MDW elevado (≥ 20) y el índice de neutrófilos/linfocitos (NLR) reducida (< 3,2) es más eficiente para identificar COVID-19 y puede usarse para distinguir la infección por SARS-CoV-2 de la infección por influenza y otras infecciones de las vías respiratorias superiores (59).
Alteraciones en el trombograma – Hemograma Predictor en la Infección por Sars-Cov-2
En el trombograma derivado de los nuevos autoanalizadores de hematología no solo se informa el recuento de las plaquetas, sino que se incluyen nuevos parámetros que, como el volumen medio plaquetario (VMP por la sigla en inglés Mean Platelet Volume), el ancho de distribución de las plaquetas (PDW por la sigla en inglés Platelet Distribution Width) y el índice de plaquetas inmaduras (5) han demostrado ser de utilidad en el manejo de los pacientes con COVID-19.
Después de la neutrofilia y de la linfopenia, la trombocitopenia es el hallazgo más importante en los pacientes infectados por SARS-CoV-2 (60-64).
Se han propuesto algunos posibles mecanismos para el desarrollo de la trombocitopenia en el curso de la infección por SARS-CoV-2 (65).
El virus puede infectar directamente las células hematopoyéticas y estromales de la médula ósea, inhibiendo su crecimiento e induciendo la apoptosis (66,67), las plaquetas pueden ser activadas por complejos antígeno-anticuerpo virales o por respuesta inflamatoria del huésped y estas plaquetas activadas son removidas de la circulación por el sistema reticuloendotelial con reducción del número de plaquetas circulantes. (68)
Los pacientes que desarrollan coagulación intravascular diseminada, usualmente con enfermedad crítica, pueden consumir plaquetas y reducir su concentración en la circulación sanguínea (66).
Además de los mecanismos citados, es pertinente recordar que normalmente los megacariocitos migran a los pulmones desde donde producen hasta el 50 % de las plaquetas circulantes (69) y que en el caso de la infección por SARS-CoV-2, estos pueden ser destruidos allí (62).
La mayoría de los pacientes en sus estados iniciales tienen recuento de plaquetas dentro de los valores de referencia (150.000 a 450.000 por µL).
En uno de los estudios de Wuhan se encontró que la trombocitopenia (< 150.000 por µL) al ingreso se asoció con un riesgo 4,24 veces mayor de mortalidad en pacientes hospitalizados por COVID-19 (70).
En la medida en que el paciente avanza hacia estados más graves, las plaquetas continúan descendiendo en proporción con la gravedad y en estos caso se relaciona con un mayor riesgo de desenlaces mortales (62). Por el contrario, la recuperación de la trombocitopenia en pacientes con COVID-19 puede significar una mejora clínica inminente (70) .
Frente a un paciente con COVID-19 con trombocitopenia hay que considerar otras causas diferentes a la infección por SARS-CoV-2 como son la trombocitopenia por heparina, especialmente en pacientes críticos o con tratamiento ECMO (por su sigla en inglés Extra Corporeal Membrane Oxygenation), en donde el paciente debe estar heparinizado (71).
Además, aunque solo se han descrito unos pocos casos, es importante reconocer la seudotrombocitopenia por satelitismo plaquetario relacionado con el anticoagulante EDTA, utilizado para la muestra del hemograma, fenómeno que se ha informado en pacientes con COVID-19 (72).
Contrario a la trombocitopenia, algunos pacientes con COVID-19 presentan trombocitosis (> 450.000 por µL) moderada (plaquetas > 450.000 y < 1.000.000 por µL) como un fenómeno de rebote una vez que se ha resuelto la enfermedad, similar a lo que sucede con otras enfermedades virales (73).
De acuerdo con Lucijanic y colaboradores, la trombocitosis reactiva se presenta en 4,6 % con recuentos entre 450.000 y 6.000.000 por µL y 1,1 % con recuento superiores a 600.000 plaquetas por µL (74).
También se ha descrito trombocitosis por el uso del biológico ruxolitinib en el manejo de pacientes con COVID-19 (75).
Respecto a los otros parámetros plaquetarios derivados de los autoanalizadores de hematología y la infección por SARS-CoV-2:
Con relación al volumen medio plaquetario (VMP por la sigla en inglés Mean Platelet Volume) y el ancho de distribución de las plaquetas (PDW por la sigla en inglés Platelet Distribution Width) no hay información suficiente para postularlos como predictores en la infección por SARS-CoV-2.
Las plaquetas reticuladas, también conocidas como fracción de plaquetas inmaduras o reticuloplaquetas, son plaquetas jóvenes, de 1 a 2 días, que se caracterizan por una alto contenido de ARN (76), lo que en la práctica refleja un aumento de la trombopoyesis y en la clínica se correlaciona con condiciones inflamatorias activas y severas (77) y puede servir como un predictor de progresión a un estado severo de la enfermedad y desenlaces fatales en pacientes críticos con COVID-19 (78-81), íntimamente relacionadas con aumento del riesgo cardiovascular (79) y desenlace fatal cuando el paciente tiene una sepsis sobreagregada (81).
En la figura 1 a manera de resumen, se presenta el perfil dinámico de cinco parámetros hematológicos (recuento de leucocitos, recuento de neutrófilos, recuento de linfocitos, índice neutrófilos/linfocitos y recuento de plaquetas en enfermedad no severa versus enfermedad severa (82).
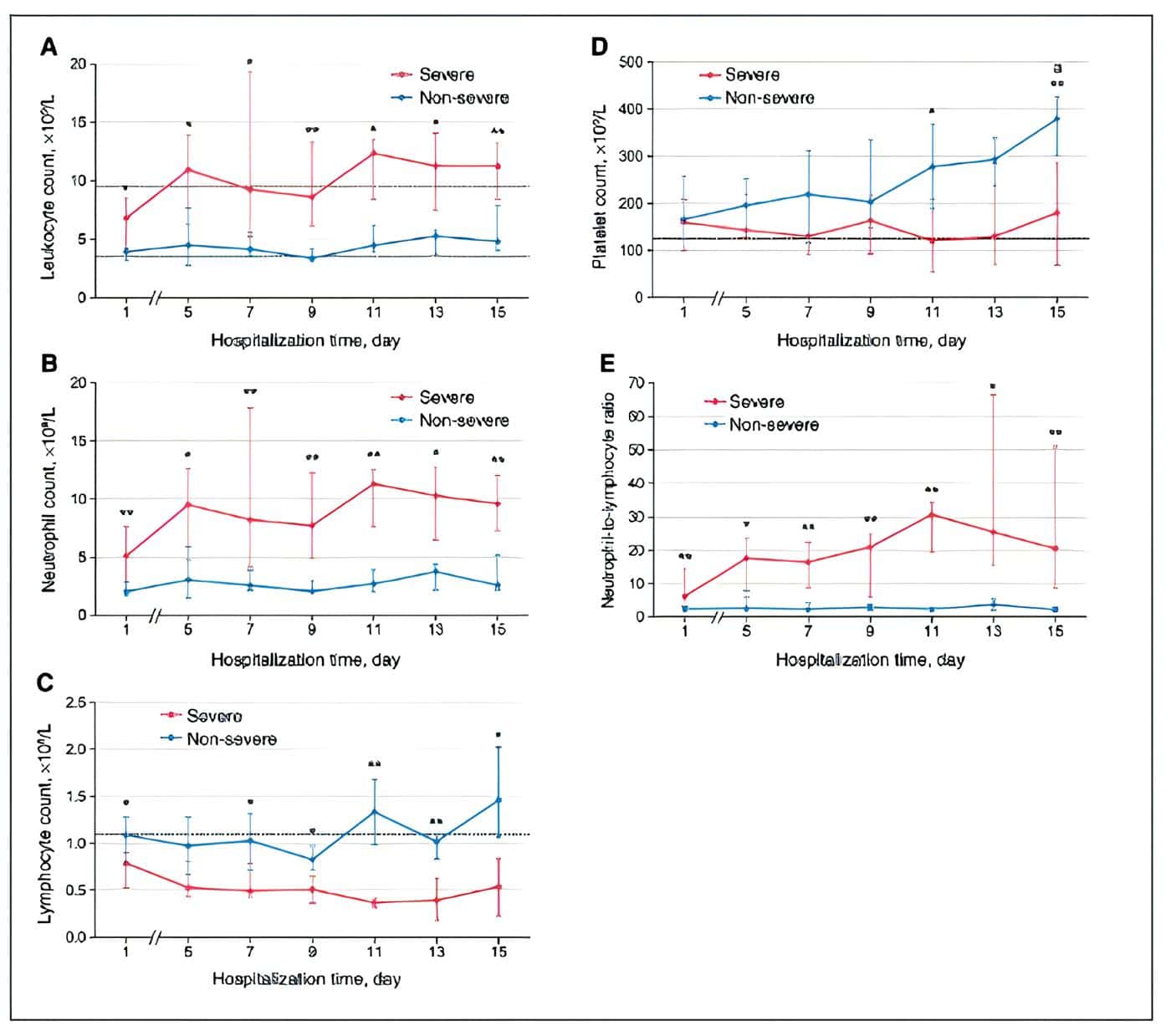
Figura 1. Cambios dinámicos en parámetros hematológicos vitales en pacientes con COVID-19. Los gráficos de línea de tiempo muestran el perfil dinámico de cinco parámetros hematológicos (recuento de leucocitos, recuento de neutrófilos, recuento de linfocitos, índice neutrófilos/linfocitos y recuento de plaquetas) en 31 pacientes hospitalizados con COVID-19 (14 casos graves y 17 casos no graves). Las líneas discontinuas indican el límite normal superior o inferior de cada parámetro. * p<0,05, ** p<0,01 para severa versus. pacientes no graves en el mismo punto de tiempo p<0,01 para el día 15 vs. día 1 después del ingreso en pacientes no graves. Tomado de Ding X, Yu Y, Lu B, et al. Dynamic profile and clinical implications of hematological parameters in hospitalized patients with coronavirus disease 2019. Clin Chem Lab Med 2020; 58:1365-1371. 10.1515/cclm-2020-0411 [82].
Alteraciones en el extendido de sangre periférica – Hemograma Predictor en la Infección por Sars-Cov-2
El examen del extendido de sangre periférica sigue siendo una parte crucial en la evaluación hematológica; a menudo puede ayudar al diagnóstico de muchas afecciones y en el caso de los pacientes infectados por SARS-CoV-2 este estudio es muy rico en hallazgos.
La morfología de los eritrocitos en pacientes con COVID-19 en etapas tempranas usualmente se conserva, solo en pacientes con enfermedad grave o crítica puede haber cambios morfológicos, generalmente relacionados con complicaciones de la enfermedad.
Dentro de estas podría verse hipocromía cuando se desarrolla deficiencia de hierro, policromatofilia cuando hay un componente hemolítico mediado inmunológicamente (9,10) o en pacientes que, teniendo una enzimopatía, por ejemplo una deficiencia de glucosa-6-fostato, reciben cloroquina como parte de tratamiento (11).
Los esquistocitos se presentan en pacientes con coagulación intravascular diseminada (83), en pacientes con anemia microangiopática (12) y en pacientes con purpura trombótica trombocitopénica (13).
Así como los parámetros eritrocitarios no tienen carácter de predictor, el papel de los cambios en la morfología de los eritrocitos no va más allá de su relación con las complicaciones previamente citadas y su reconocimiento en el proceso del diagnóstico.
Los cambios morfológicos de neutrófilos en la infección por SARS-CoV-2 son proporcionales a las respuestas a las citocinas y al grado de la inflamación y al curso de la enfermedad.
En los primeros días se observan neutrófilos hipergranulares con la presencia de granulaciones tóxicas como las que se presentan en los casos de neutrofilia por infección.
En los caso graves o críticos de COVID-19 los neutrófilos tiene grandes cambios morfológicos en donde se incluyen alteraciones en el tamaño, que aumenta coincidiendo con la anisocitosis (diferentes tamaños) que el autoanalizador de hematología informa como el ancho de distribución de los neutrófilos, previamente analizado; el citoplasma de los neutrófilos pierde los gránulos propios de la célula y se observan neutrófilos agranulares y vacuolados en el citoplasma y en el núcleo picnocitosis, retracción del núcleo con condensación de la cromatina, cariolisis, disolución del núcleo y cariorexis, fragmentación del núcleo que producen neutrófilos bizarros con formación de seudo-Pelger-Hüet, neutrófilos en anillo, neutrófilos en U, neutrófilos monolobulados y restos de neutrófilos en disolución, entre otras formas que se presentan como efecto citopático del virus (84).
También es posible observar precursores mieloides, como mielocitos y metamielocitos, y eritroblastos, dentro de una reacción leucoeritroblástica (35).
En la figura 2 se muestran algunas de las alteraciones morfológicas que se presentan en los neutrófilos de pacientes con COVID-19 (84).
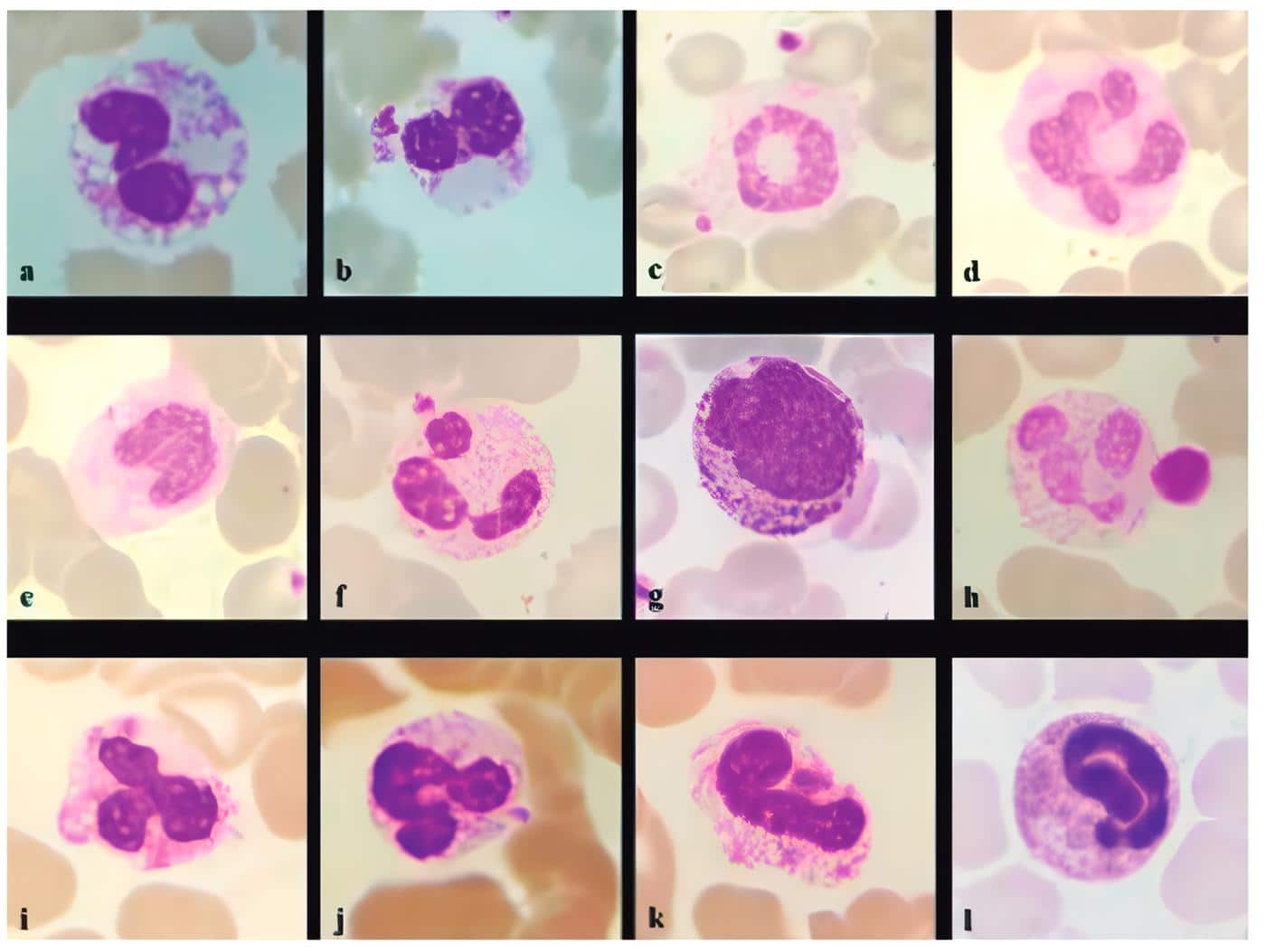
Figura 2: Cambios en los neutrófilos. Neutrófilo con vacuolas intracitoplasmáticas (a), neutrófilo con núcleos de seudo-Pelger-Hüet (b), neutrófilo en anillo (c), maza (d), neutrófilo monolobulado (e), neutrófilo en palillo de tambor con satelitismo plaquetario (f), precursor mieloide (g), neutrófilo hipogranulado con plaqueta gigante (h), neutrófilo tripolar (i), neutrófilo en forma de “U” (j), neutrófilo similar a un feto (k), neutrófilo con nucleoplasma alargado (l). (Coloración de Leishman, 100X). Tomado de Santosh T, Shankaralingappa A. Peripheral smear in COVID 19: a case report. Hematol Transfus Cell Ther 2021. 10.1016/j.htct.2021.02.011 [84].
Los cambios morfológicos en los linfocitos son menos llamativos que los que se observan en los neutrófilos, pero no menos importantes. Lo primero que se presenta, unos días después del contacto viral, el la presencia de “linfocitos atípicos”, caracterizados por mayor tamaño con relación a los linfocitos normales, aumento de la basofilia citoplasmática y cambios en el núcleo, que en los casos de enfermedad grave o crítica puede tener formas plasmocitoides, linfocitos con vacuolas citoplasmáticas, evaginación y plegamiento del del núcleo, linfocitos con lobulaciones nucleares y linfocitos grandes con granularidad aumentada, conocido como “aspecto monocitoides” por su gran parecido con un monocito (84).
En la figura 3 se muestran algunas de las alteraciones morfológicas que se presentan en los linfocitos de pacientes con COVID-19 (84).
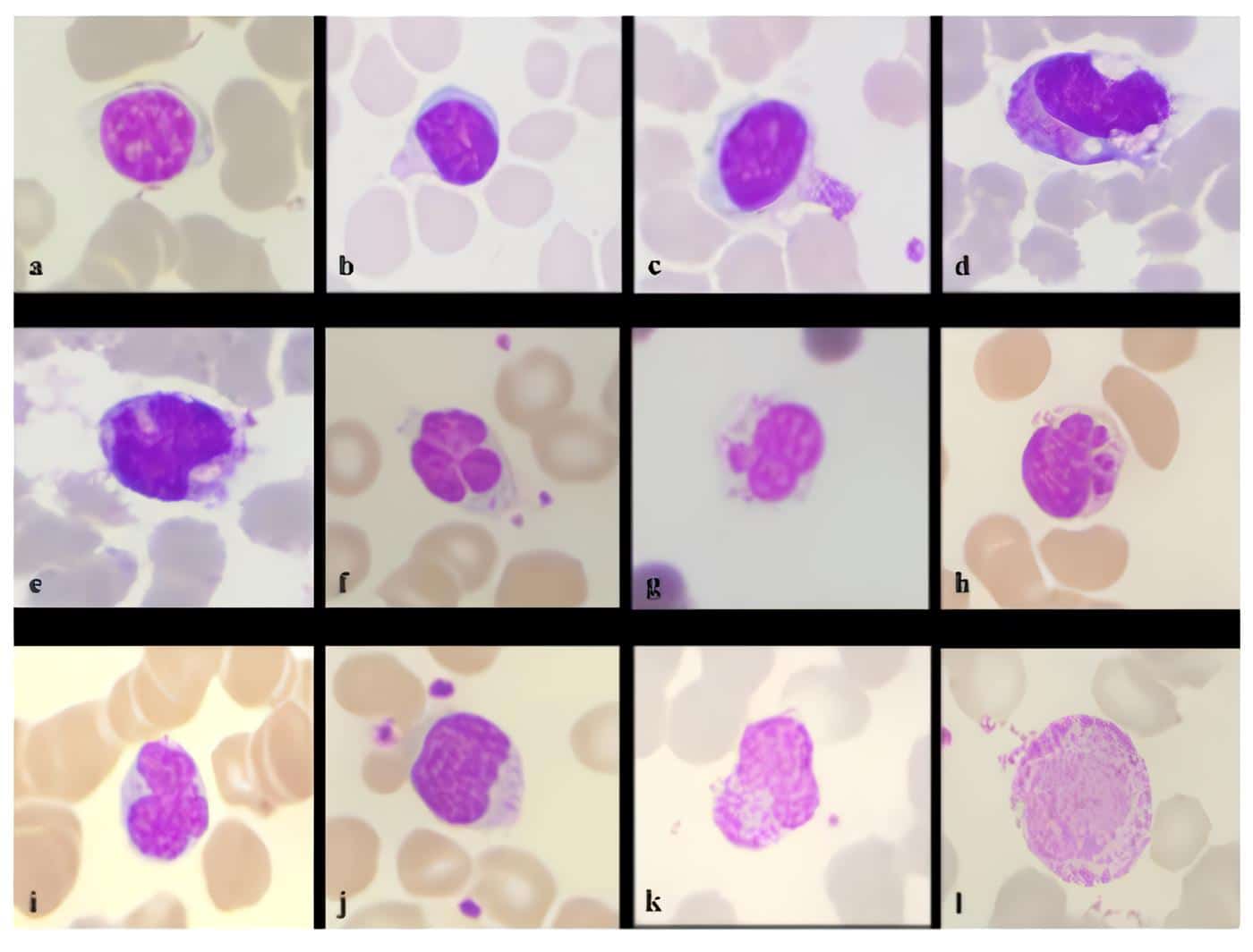
Figura 3. Cambios en los linfocitos. Linfocitos pequeños normales (a), linfocito con evaginación citoplasmática (b), linfocito con vaina citoplasmática (c), linfocitos plasmocitoides con vacuolas citoplasmáticas (d), linfocito con pliegue interno del núcleo (e), linfocito con ampollas nucleares y satelitismo de plaquetas (f,g), linfocito con ampollas múltiples t (h), linfocito con lobulaciones nucleares (i), linfocito con membrana nuclear irregular y satelitismo de plaquetas (j), linfocito con vaina citoplasmática y granularidad (k), linfocito grande con granularidad aumentada (l). (Coloración de Leishman, 100X). Tomado de Santosh T, Shankaralingappa A. Peripheral smear in COVID 19: a case report. Hematol Transfus Cell Ther 2021. 10.1016/j.htct.2021.02.011 [84].
Las manifestaciones de los monocitos, que como los otros cambios en el extendido de sangre periférica no son patognomónicos de la infección por SARS-CoV-2, son muy llamativas y expresan la gravedad de la enfermedad.
Como las demás células, uno de los hallazgos más llamativos en los monocitos es la anisocitosis con la presencia de monocitos grandes alternando con otros más pequeños o de tamaño normal que el autoanalizador de hematología informa como el ancho de distribución de los monocitos, previamente analizado.
Aparte de ser más grandes que los monocitos normales, se observa que muestran un contorno de citoplasma irregular con vacuolización citoplasmática e intranuclear, núcleos prominentes en herradura o en forma de anillos (84).
En la figura 4 se muestran algunas de las alteraciones morfológicas que se presentan en los neutrófilos de pacientes con COVID-19 (84).
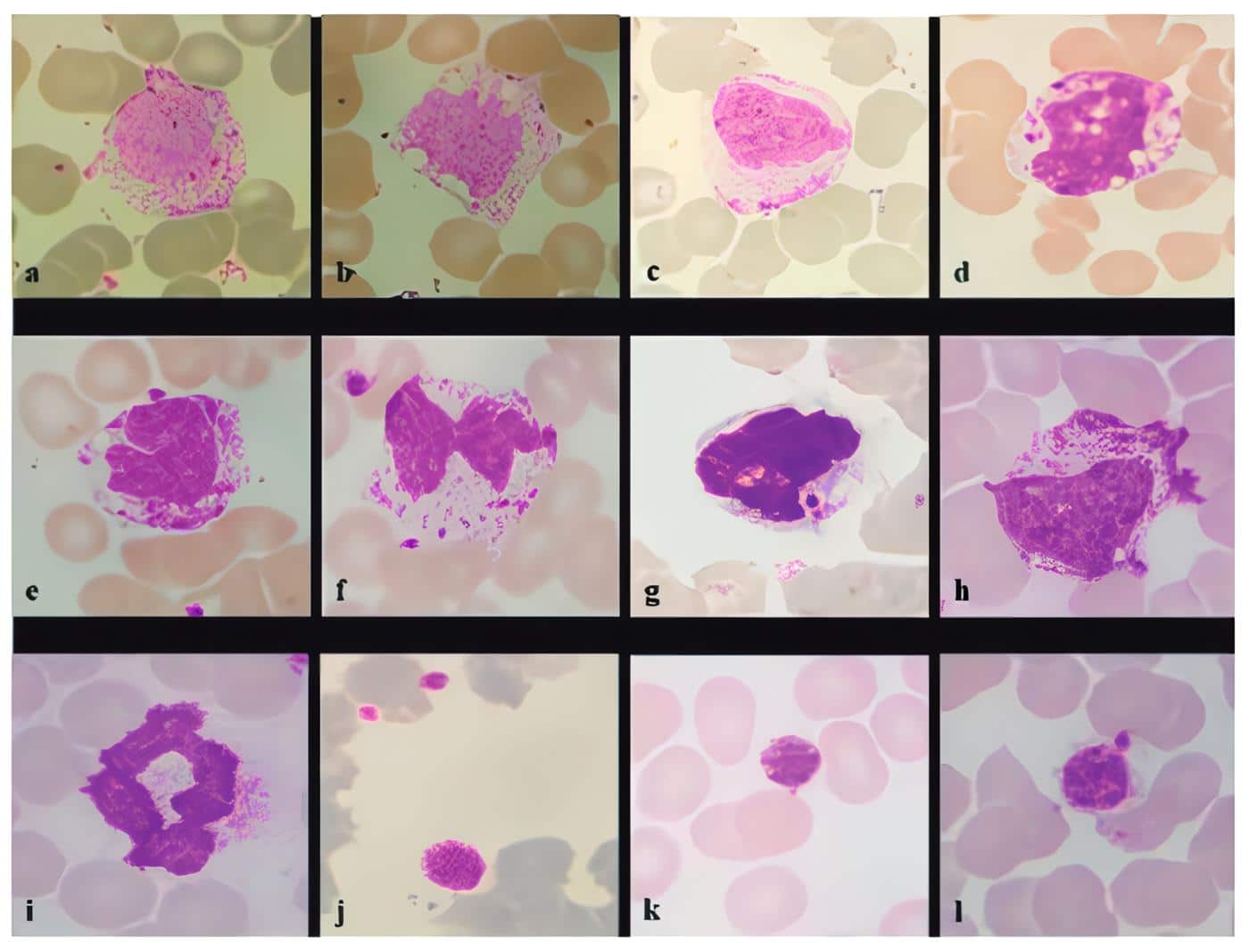
Figura 4. Cambios en los monocitos y plaquetas. Monocitos que muestran un contorno de citoplasma irregular (a), monocitos con vacuolización citoplasmática (b), monocitos con vesícula nuclear (c), monocitos vacuolización intracitoplasmática e intranuclear (d), monocitos con núcleos en herradura (e), monocitos bilobulado y satelitismo plaquetario y (f), monocitos con plaquetas engullidas (g), monocitos con aumento de la granularidad citoplasmática (h), monocitos con núcleo en anillo (i) plaquetas gigante (k) plaquetaria gigante con satelitismo (l). (Coloración de Leishman, 100X). Tomado de Santosh T, Shankaralingappa A. Peripheral smear in COVID 19: a case report. Hematol Transfus Cell Ther 2021. 10.1016/j.htct.2021.02.011 [84].
Los cambios en la morfología de las plaquetas usualmente se presentan en pacientes críticos y consisten en anisocitosis plaquetaria (diferentes tamaños) que el autoanalizador de hematología entrega como ancho de distribución de las plaquetas y la presencia de plaquetas gigantes (megatrombocitos) hipogranulares y vacuoladas (84).
Índices hematológicos – Hemograma Predictor en la Infección por Sars-Cov-2
En los últimos años, tratando de mejorar el desempeño de las pruebas de diagnóstico se han replanteado el uso de marcadores de diagnóstico más sencillos y accesibles y los índices, también llamados relaciones o “ratio”, relacionados con el hemograma son un buen ejemplo de estos avances.
Como una buena práctica médica, los laboratorios clínicos deberían incluir en los informes del hemograma, como un valor agregado, los índices que de acuerdo con literatura médica indexada han demostrado utilidad clínica en el manejo del COVID-19 como el índice neutrófilos/linfocitos y el índice plaquetas/linfocitos.
Índice neutrófilos/linfocitos – Hemograma Predictor en la Infección por Sars-Cov-2
El índice neutrófilos/linfocitos (NLR por su sigla en inglés Neutrophil-to-Lymphocyte Ratio) descrito en 2001 (85), rápidamente se posicionó en la práctica clínica como una prueba sencilla y al alcance de la mayoría de los médicos, de la inflamación sistémica y del estado de estrés en pacientes en estado crítico.
El NLR aumentado (> 3) es un factor de riesgo de mortalidad en varias enfermedades, como fracturas de cadera (86), infección (87), enfermedades malignas (88), infarto agudo de miocardio (89) y polimiositis y dermatomiositis (90), entre otras enfermedades.
Con respecto al desempeño del NLR en pacientes infectados por SARS-CoV-2 se ha evidenciado que su elevación se asocia con la gravedad, la progresión de la enfermedad y la mortalidad en pacientes críticamente enfermos (91-104), con un mayor riesgo de complicaciones cardiovasculares graves y desenlace fatal (97), inflamación pulmonar severa con desenlace fatal (98) y predictor independiente de mal pronóstico al momento del diagnóstico (94,99,100).
Xu y colaboradores, encontraron que por cada unidad de aumento del NLR, el riesgo de muerte en el hospital aumenta en un 8%, es decir, los pacientes con NLR elevado tienen un mayor riesgo de muerte durante la hospitalización siendo el riesgo de muerte en los hombres mayor que en las mujeres (105).
Por lo tanto, en el caso de la infección por COVID-19, el NLR aumentado significativamente indica un mal pronóstico y mayor gravedad de los pacientes. (106).
A medida que la infección empeora y ocurren otras infecciones bacterianas, el número de neutrófilos aumenta significativamente, mientras que el recuento de linfocitos sigue disminuyendo (106,107).
A manera de resumen, en la figura 1 se muestra comportamiento de los linfocitos, los neutrófilos, los linfocitos, las plaquetas y el índice neutrófilos/linfocitos (NLR) en pacientes con enfermedad severa versus enfermedad no severa (82).
Índice plaquetas/linfocitos – Hemograma Predictor en la Infección por Sars-Cov-2
El índice plaquetas/linfocitos, también conocido como PLR (por la sigla en inglés Platelet to Lymphocyte Ratio) se refiere a la proporción de plaquetas a linfocitos, que puede reflejar el grado de inflamación en el cuerpo humano, está relacionado con la tormenta de citoquinas y desde el punto de vista clínico es similar al índice NLR (108).
El PLR elevado al diagnóstico es predictor independiente de una mayor estancia hospitalaria y mal pronóstico en pacientes infectados por SARS-CoV-2 (108).
Conclusiones – Hemograma Predictor en la Infección por Sars-Cov-2
El hemograma es una de las pruebas más solicitadas al laboratorio clínico, ya que es imprescindible en la práctica médica del día a día.
En el contexto del paciente infectado por SARS-CoV-2 suministra al médico predictores que han demostrado ser eficientes como la neutrofilia, la linfopenia, la trombocitopenia, el índice neutrófilos/linfocitos, el ancho de distribución de los eritrocitos y el ancho de distribución de los monocitos, además de proporcionar parámetros de utilidad clínica como el eritrograma, la hemoglobina reticulocitaria, el índice de plaquetas inmaduras y el estudio de la morfología en los extendidos de sangre periférica que le permiten al médico un mejor manejo de la enfermedad, y a los sistemas de salud ser más eficientes y racionales.
Lograr el mejor uso del hemograma implica de la comunidad médica educación continua para incorporar los nuevos conocimientos y a los laboratorios clínicos, como una buena práctica, la puesta en marcha de programas de modernización de equipos e incorporación de nuevos parámetros y la recuperación de viejos parámetros, como el extendido de sangre periférica, cada vez más ausente en la práctica diaria.
Agradecimientos – Hemograma Predictor en la Infección por Sars-Cov-2
Expreso agradecimiento al Dr. Óscar Osio Uribe, médico internista y epidemiólogo clínico, por la acuciosa revisión del manuscrito y sus valiosas contribuciones al mismo.
Referencias – Hemograma Predictor en la Infección por Sars-Cov-2
1.Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020;382:727-733.
2. WHO Coronavirus (COVID-19) Dashboard [Internet]. Covid19.who.int. 2022 [Consultado 31 enero 2022].Disponible en: https://covid19.who.int/.
3. República de Colombia, Instituto Nacional de Salud (INS).Coronavirus Colombia [Internet]. Ins.gov.co. 2022 [consultado 31 enero 2022]. Disponible en:
https://www.ins.gov.co/Noticias/paginas/coronavirus.aspx,
4. COVID-19 Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines.[Internet]. National Institutes of Health.2022 [consultado 31 enero 2022]. Disponible en:
https://www.covid19treatmentguidelines.nih.gov/.
5. Campuzano-Maya G. Del hemograma manual al hemograma de cuarta generación. Medicina & Laboratorio. 2007;13:551-550.
6. Urbano M, Costa E, Geraldes C. Hematological changes in SARS-COV-2 positive patients. Hematol Transfus Cell Ther 2022;.
7. Taneri PE, Gomez-Ochoa SA, Llanaj E, Raguindin PF, Rojas L, Roa-Díaz ZM, et al. Anemia and iron metabolism in COVID-19: a systematic review and meta-analysis. Eur J Epidemiol 2020;35:763-773.
8. Thavendiranathan P, Bagai A, Ebidia A, Detsky AS, Choudhry NK. Do blood tests cause anemia in hospitalized patients? The effect of diagnostic phlebotomy on hemoglobin and hematocrit levels. J Gen Intern Med. 2005;20:520-524.
9. Maslov DV, Simenson V, Jain S, Badari A. COVID-19 and cold agglutinin hemolytic anemia. TH Open. 2020;4(3):e175-e177.
Otras Referencias – Hemograma Predictor en la Infección por Sars-Cov-2
10. Liput JR, Jordan K, Patadia R, Kander E. Warm autoimmune hemolytic anemia associated with asymptomatic SARS-CoV-2 infection. Cureus. 2021;13:e14101.
11. Aguilar J, Averbukh Y. Hemolytic anemia in a Ggucose6-phosphate dehydrogenase-deficient patient receiving hydroxychloroquine for COVID-19: A case report. Perm J. 2020;24:20.158.
12. Sweeney JM, Barouqa M, Krause GJ, Gonzalez-Lugo JD, Rahman S, Gil MR. Evidence for secondary thrombotic microangiopathy in COVID-19. medRxiv 2020;2020.10.20.20215608.
13. Tehrani HA, Darnahal M, Vaezi M, Haghighi S. COVID-19 associated thrombotic thrombocytopenic purpura (TTP). A case series and mini-review. Int Immunopharmacol. 2021;93:107397.
14. Salvagno GL, Sanchis-Gomar F, Picanza A, Lippi G. Red blood cell distribution width: A simple parameter with multiple clinical applications. Crit Rev Clin Lab Sci. 2015;52:86-105.
15. Patel KV, Semba RD, Ferrucci L, et al. Red cell distribution width and mortality in older adults: a meta-analysis. J Gerontol A Biol Sci Med Sci. 2010;65:258-265.
16. Wang C, Zhang H, Cao X, et al. Red cell distribution width (RDW): a prognostic indicator of severe COVID-19. Ann Transl Med. 2020;8:1230.
17. Henry BM, Benoit JL, Benoit S, et al. Red blood cell distribution width (RDW) predicts COVID-19 severity: A prospective, observational study from the Cincinnati SARS-CoV-2 Emergency Department Cohort. Diagnostics (Basel). 2020;10(9):618.
18. Soni M, Gopalakrishnan R. Significance of RDW in predicting mortality in COVID-19-An analysis of 622 cases. Int J Lab Hematol. 2021;43(4):O221-O223.
Bibliografías – Hemograma Predictor en la Infección por Sars-Cov-2
19. Sahu KK, Borogovac A, Cerny J. COVID-19 related immune hemolysis and thrombocytopenia. J Med Virol. 2021;93:1164-1170.
20. Kuipers MT, van Zwieten R, Heijmans J, et al. Glucose6-phosphate dehydrogenase deficiency-associated hemolysis and methemoglobinemia in a COVID-19 patient treated with chloroquine. Am J Hematol. 2020;95:E194- E196.
21. Campuzano-Maya G, Guevara-Arismendy NM. Hemoglobina reticulocitaria: un nuevo parámetro del hemograma de gran valor en el diagnóstico y manejo de la eritropoeyesis deficiente en hierro. Medicina & Laboratorio. 2015;21:11-42.
22. Mitsuiki K, Harada A, Miyata Y. Reticulocyte hemoglobin content in hemodialysis patients with acute infection. Clin Exp Nephrol. 2004;8:257-262.
23. Fernández R, Tubau I, Masip J, Muñoz L, Roig I, Artigas A. Low reticulocyte hemoglobin content is associated with a higher blood transfusion rate in critically ill patients: a cohort study. Anesthesiology. 2010;112:1211-1215. 1
24. Fan BE, Chong VCL, Chan SSW, et al. Hematologic parameters in patients with COVID-19 infection. Am J Hematol. 2020;95:E131-E134.
25. Wang J, Jiang M, Chen X, Montaner LJ. Cytokine storm and leukocyte changes in mild versus severe SARSCoV-2 infection: Review of 3939 COVID-19 patients in China and emerging pathogenesis and therapy concepts. J Leukoc Biol. 2020;108:17-41.
26. Kim GU, Kim MJ, Ra SH, et al. Clinical characteristics of asymptomatic and symptomatic patients with mild COVID-19. Clin Microbiol Infect. 2020;26:948 e941-948 e943.
27. Yamada T, Wakabayashi M, Yamaji T, et al. Value of leukocytosis and elevated C-reactive protein in predicting severe coronavirus 2019 (COVID-19): A systematic review and meta-analysis. Clin Chim Acta. 2020;509:235- 243.
Otras Bibliografías – Hemograma Predictor en la Infección por Sars-Cov-2
28. Bunte K, Beikler T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases. Int J Mol Sci. 2019;20. .
29. Dutzan N, Abusleme L. T Helper 17 Cells as Pathogenic Drivers of Periodontitis. Adv Exp Med Biol. 2019;1197:107-117.
30. Kosmeri C, Koumpis E, Tsabouri S, Siomou E, Makis A. Hematological manifestations of SARS-CoV-2 in children. Pediatr Blood Cancer. 2020;67:e28745.
31. Keski H. Hematological and Inflammatory Parameters to Predict the Prognosis in COVID-19. Indian J Hematol Blood Transfus. 2021;37(4):534-542.
32. Shahin W, Rabie W, Alyossof O, Alasiri M, Alfaki M, Mahmoud E, et al. COVID-19 in children ranging from asymptomatic to a multi-system inflammatory disease: A single-center study. Saudi Med J. 2021;42(3):299-305.
33. Meizlish ML, Pine AB, Bishai JD, Goshua G, Nadelmann ER, Simonov M, et al. A neutrophil activation signature predicts critical illness and mortality in COVID-19. Blood Adv. 2021;5(5):1164-1177.
34. Lippi G, Plebani M. The critical role of laboratory medicine during coronavirus disease 2019 (COVID-19) and other viral outbreaks. Clin Chem Lab Med. 2020;58(7):1063-1069.
35. Mitra A, Dwyre DM, Schivo M, et al. Leukoerythroblastic reaction in a patient with COVID-19 infection. Am J Hematol. 2020;95(8):999-1000.
36. Chaves F, Tierno B, Xu D. Neutrophil volume distribution width: a new automated hematologic parameter for acute infection. Arch Pathol Lab Med. 2006;130(3):378-380.
Lecturas Recomendadas – Hemograma Predictor en la Infección por Sars-Cov-2
37. Lutfi F, Benyounes A, Farrukh N, Bork J, Duong V. Agranulocytosis Following COVID-19 Recovery. Cureus. 2020;12(7):e9463.
38. Karimi Shahri M, Niazkar HR, Rad F. COVID-19 and hematology findings based on the current evidences: A puzzle with many missing pieces. Int J Lab Hematol. 2021;43(2):160-168.
39. Zhang ZL, Hou YL, Li DT, Li FZ. Laboratory findings of COVID-19: a systematic review and meta-analysis. Scand J Clin Lab Invest. 2020;80(6):1-7.
40. Huang R, Xie L, He J, Dong H, Liu T. Association between the peripheral blood eosinophil counts and COVID-19: A meta-analysis. Medicine (Baltimore) 2021;100(23):e26047. 1
41. Xuan W, Jiang X, Huang L, Pan S, Chen C, Zhang X, et al. Predictive aalue of eosinophil count on COVID-19 disease progression and outcomes, a retrospective study of Leishenshan Hospital in Wuhan, China. J Intensive Care Med. 2022;37(3):359-365.
42. Liu F, Xu A, Zhang Y, Xuan W, Yan T, Pan K, et al. Patients of COVID-19 may benefit from sustained lopinavircombined regimen and the increase of eosinophil may predict the outcome of COVID-19 progression. Int J Infect Dis 2020;95:183-191.
43. Tong X, Cheng A, Yuan X, Zhong X, Wang H, Zhou W, et al. Characteristics of peripheral white blood cells in COVID-19 patients revealed by a retrospective cohort study. BMC Infect Dis. 2021;21(1):1236.
44. Murdaca G, Di Gioacchino M, Greco M, Borro M, Paladin F, Petrarca C, et al. Basophils and mast cells in COVID-19 pathogenesis. Cells 2021;10(10):2754.
45. Zhao Q, Meng M, Kumar R, Wu Y, Huang J, Deng, et al. Lymphopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: A systemic review and meta-analysis. Int J Infect Dis. 2020;96:131-135.
Otras Lecturas Recomendadas – Hemograma Predictor en la Infección por Sars-Cov-2
46. Huang I, Pranata R. Lymphopenia in severe coronavirus disease-2019 (COVID-19): systematic review and metaanalysis. J Intensive Care. 2020;8:36.
47. Zaboli E, Majidi H, Alizadeh-Navaei R, HedayatizadehOmran A, Asgarian-Osman H, Larijani LV, et al. Lymphopenia and lung complications in patients with coronavirus disease-2019 (COVID-19): A retrospective study based on clinical data. J Med Virol. 2021;93(9):1524-5431.
48. Ziadi A, Hachimi A, Admou B, Hazime R, Brahim I, Douirek F, et al. Lymphopenia in critically ill COVID-19 patients: A predictor factor of severity and mortality. Int J Lab Hematol 2021;43(1):e38-e40.
49. Allegra A, Di Gioacchino M, Tonacci A, Musolino C, Gangemi S. Immunopathology of SARS-CoV-2 infection: Immune cells and mediators, Prognostic factors, and immune-therapeutic implications. Int J Mol Sci. 2020;21(13):4782.
50. Garcia LF. Immune Response, Inflammation, and the Clinical Spectrum of COVID-19. Front Immunol. 2020;11:1441.
51. Javanian M, Bayani M, Shokri M, Sadeghi M, Babazadeh A, Yaganeh B, et al. Clinical and laboratory findings from patients with COVID-19 pneumonia in Babol North of Iran: a retrospective cohort study. Rom J Intern Med. 2020;58(3):161-167.
52. Rahman A, Niloofa R, Jayarajah U, De Mel S, Abeysuriya V, Seneviratne SL. Hematological abnormalities in COVID-19: A narrative review. Am J Trop Med Hyg. 2021;104(4):1188-1201.
53. Zhou Y, Fu B, Zheng X, Wang D, Zhao C, Qi Y, et al. Pathogenic T-cells and inflammatory monocytes incite inflammatory storms in severe COVID-19 patients. Natl Sci Rev. 2020;7(6):998-1002.
54. Zhang D, Guo R, Lei L, Liu H, Wang Y, Wang Y, Quian H, et al. Frontline Science: COVID-19 infection induces readily detectable morphologic and inflammation-related phenotypic changes in peripheral blood monocytes. J Leukoc Biol. 2021;109(1):13-22.
Referencias Bibliográficas – Hemograma Predictor en la Infección por Sars-Cov-2
55. Liu J, Li S, Liu J, Liang B, Wang X, Wang H, et al. Longitudinal characteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients. EBioMedicine 2020;55:102763.
56. Sanchez-Cerrillo I, Landete P, Aldave B, Sanchez-alonso S, Sanchez-Azofra A, Marcos-Jimenez A, et al. Differential redistribution of activated monocyte and dendritic cell subsets to the lung associates with severity of COVID-19. medRxiv. 2020;2020.05.13.20100925.
57. Crouser ED, Parrillo JE, Martin GS, Huang D, Hausfater P, Grigarov I, et al. Monocyte distribution width enhances early sepsis detection in the emergency department beyond SIRS and qSOFA. J Intensive Care. 2020;8:33.
58. Mardi D, Fwity B, Lobmann R, Ambrosch A. Mean cell volume of neutrophils and monocytes compared with Creactive protein, interleukin-6 and white blood cell count for prediction of sepsis and nonsystemic bacterial infections. Int J Lab Hematol. 2010;32(4):410-418.
59. Lin HA, Lin SF, Chang HW, Lee YJ, Chen RJ, Hou SK. Clinical impact of monocyte distribution width and neutrophil-to-lymphocyte ratio for distinguishing COVID-19 and influenza from other upper respiratory tract infections: A pilot study. PLoS One. 2020;15(11):e0241262.
60. Bashash D, Hosseini-Baharanchi FS, Rezaie-Tavirani M, Safa-M, Dilmaghani NA, Faranouush M, et al. The Prognostic Value of Thrombocytopenia in COVID-19 Patients; a Systematic Review and Meta-Analysis. Arch Acad Emerg Med. 2020;8(1):e75.
61. Bao C, Tao X, Cui W, Yi B, Pan T, Young K, et al. SARSCoV-2 induced thrombocytopenia as an important biomarker significantly correlated with abnormal coagulation function, increased intravascular blood clot risk and mortality in COVID-19 patients. Exp Hematol Oncol. 2020;9:16.
Otras Referencias Bibliográficas – Hemograma Predictor en la Infección por Sars-Cov-2
62. Lippi G, Plebani M, Henry BM. Thrombocytopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: A meta-analysis. Clin Chim Acta. 2020;506:145-148.
63. Pranata R, Lim MA, Yonas E, et al. Thrombocytopenia as a prognostic marker in COVID-19 patients: diagnostic test accuracy meta-analysis. Epidemiol Infect. 2021;149:e40. 1
64. Zong X, Gu Y, Yu H, Li Z, Wang Y. Thrombocytopenia Is Associated with COVID-19 Severity and Outcome: An Updated Meta-Analysis of 5637 Patients with Multiple Outcomes. Lab Med. 2021;52:10-15.
65. Xu P, Zhou Q, Xu J. Mechanism of thrombocytopenia in COVID-19 patients. Ann Hematol. 2020.
66. Yang M, Ng MH, Li CK. Thrombocytopenia in patients with severe acute respiratory syndrome (review). Hematology. 2005;10(2):101-105. 1
67. Seyoum M, Enawgaw B, Melku M. Human blood platelets and viruses: defense mechanism and role in the removal of viral pathogens. Thromb J. 2018;16:16.
68. Bomhof G, Mutsaers P, Leebeek FWG, et al. COVID19-associated immune thrombocytopenia. Br J Haematol. 2020;190:e61-e64.
69. Zucker-Franklin D, Philipp CS. Platelet production in the pulmonary capillary bed: new ultrastructural evidence for an old concept. Am J Pathol. 2000;157:69-74.
70. Liu Y, Sun W, Guo Y, et al. Association between platelet parameters and mortality in coronavirus disease 2019: Retrospective cohort study. Platelets 2020;31:490-496.1
71. Phan XT, Nguyen TH, Tran TT, et al. Suspected heparininduced thrombocytopenia in a COVID-19 patient on extracorporeal membrane oxygenation support: a case report. Thromb J. 2020;18:37. 1
72. Li H, Wang B, Ning L, Luo Y, Xiang S. Transient appearance of EDTA dependent pseudothrombocytopenia in a patient with 2019 novel coronavirus pneumonia. Platelets. 2020;31:825-826.
Fuentes Bibliográficas – Hemograma Predictor en la Infección por Sars-Cov-2
73. Zucker-Franklin D. The effect of viral infections on platelets and megakaryocytes. Semin Hematol. 1994;31:329- 337.
74. Lucijanic M, Krecak I, Soric E, et al. Thrombocytosis in COVID-19 patients without myeloproliferative neoplasms is associated with better prognosis but higher rate of venous thromboembolism. Blood Cancer J 2021;11:189.
75. Anguiano-Alvarez VM, Maza-Larrea JA, Rosado-Hernandez FJ, Rojas-Velasco G, Izaguirre-Avila R. Ruxolitinib-induced extreme thrombocytosis in a COVID-19 patient. Blood Res. 2021;56:201-202.
76. Campuzano-Maya G. Estudio del paciente con hiperferritinemia. Medicicina & Laboratorio 2017;23:411-442.
77. Bat T, Steinberg SM, Childs R, et al. Active thrombopoiesis is associated with worse severity and activity of chronic GVHD. Bone Marrow Transplant 2013;48:1569- 1573.
78. Cohen A, Harari E, Cipok M, et al. Immature platelets in patients hospitalized with Covid-19. J Thromb Thrombolysis 2020.
79. Cohen A, Harari E, Cipok M, Laish-Farkash A, Bryk G, Yahud E, et al. Immature platelets in patients hospitalized with Covid-19. J Thromb Thrombolysis. 2021;51(3):608- 616. 1
80. Welder D, Jeon-Slaughter H, Ashraf B, Choi SH, Chen W, Ibrahim I, et al. Immature platelets as a biomarker for disease severity and mortality in COVID-19 patients. Br J Haematol 2021;194(3):530-536.
81. Nuhrenberg TG, Stockle J, Marini F, Zurek M, Grüning B, Benes V, et al. Impact of high platelet turnover on the platelet transcriptome: Results from platelet RNA-sequencing in patients with sepsis. PLoS One 2022;17(1):e0260222. 1
Otras Fuentes Bibliográficas – Hemograma Predictor en la Infección por Sars-Cov-2
82. Ding X, Yu Y, Lu B, Huo J, Chen M, Kang Y, et al. Dynamic profile and clinical implications of hematological parameters in hospitalized patients with coronavirus disease 2019. Clin Chem Lab Med 2020;58(8):1365-1371.
83. Zhou X, Cheng Z, Luo L, Zhu Y, Lin W, Ming Z, et al. Incidence and impact of disseminated intravascular coagulation in COVID-19 a systematic review and metaanalysis. Thromb Res. 2021;201(8):23-29.
84. Santosh T, Shankaralingappa A. Peripheral smear in COVID 19: a case report. Hematol Transfus Cell Ther. 2021:43(4):545-547.
85. Zahorec R. Ratio of neutrophil to lymphocyte counts- -rapid and simple parameter of systemic inflammation and stress in critically ill. Bratisl Lek Listy 2001;102(1):5- 14.
86. Niessen R, Bihin B, Gourdin M, Yombi JC, Cornu O, Forget P. Prediction of postoperative mortality in elderly patient with hip fractures: a single-centre, retrospective cohort study. BMC Anesthesiol 2018;18(1):183.
87. Faria SS, Fernandes PC, Jr., Silva MJ, Lima VC, Fontes W, Freitas-Junior R, et al. The neutrophil-tolymphocyte ratio: a narrative review. Ecancermedicalscience. 2016;10:702.
88. Guthrie GJ, Charles KA, Roxburgh CS, Horgan PG, McMillan DC, Clarke SJ. The systemic inflammation-based neutrophil-lymphocyte ratio: experience in patients with cancer. Crit Rev Oncol Hematol 2013;88(1):218-230.
89. Azab B, Zaher M, Weiserbs KF, Torbey E, Lacossiere K, Gaddam S, et al. Usefulness of neutrophil to lymphocyte ratio in predicting short- and long-term mortality after non-ST-elevation myocardial infarction. Am J Cardiol. 2010;106(4):470-476.
90. Ha YJ, Hur J, Go DJ, kang EH, Park JK, Lee EY, et al. Baseline peripheral blood neutrophil-to-lymphocyte ratio could predict survival in patients with adult polymyositis and dermatomyositis: A retrospective observational study. PLoS One. 2018;13(1):e0190411.
Reseñas Bibliográficas – Hemograma Predictor en la Infección por Sars-Cov-2
91. Lian J, Jin C, Hao S, Zhang X, Yang M, Jin X, et al. High neutrophil-to-lymphocyte ratio associated with progression to critical illness in older patients with COVID-19: a multicenter retrospective study. Aging (Albany NY). 2020;12(14):13849-13859.
92. Fu J, Kong J, Wang W, Wu M, Yao L, Wang Z, et al. The clinical implication of dynamic neutrophil to lymphocyte ratio and D-dimer in COVID-19: A retrospective study in Suzhou China. Thromb Res 2020;192:3-8.
93. Liao D, Zhou F, Luo L, Xu M, Wang H, Xia J, et al. Haematological characteristics and risk factors in the classification and prognosis evaluation of COVID-19: a retrospective cohort study. Lancet Haematol. 2020; 7(9): e671-e678. 1
94. Nalbant A, Kaya T, Varim C, Yaylaci S, Tamer A, Cinemre H. Can the neutrophil/lymphocyte ratio (NLR) have a role in the diagnosis of coronavirus 2019 disease (COVID-19)? Rev Assoc Med Bras. (1992). 2020;66(6):746-751.
95. Pirsalehi A, Salari S, Baghestani A, Vahidi M, Khave LJ, AKbari ME, et al. Neutrophil-to-lymphocyte ratio (NLR) greater than 6.5 may reflect the progression of COVID-19 towards an unfavorable clinical outcome. Iran J Microbiol. 2020;12(5):466-474.
96. Vafadar Moradi E, Teimouri A, Rezaee R, Morovatdar N, Foroughian M, Layegh et al. Increased age, neutrophil-to-lymphocyte ratio (NLR) and white blood cells count are associated with higher COVID-19 mortality. Am J Emerg Med. 2020;40:11-14.
97. Zhan L, Liu Y, Cheng Y, Guo W, Yang J. Predictive value of neutrophil/lymphocyte ratio (NLR) on cardiovascular events in patients with COVID-19. Int J Gen Med. 2021;14:3899-3907.
98. Paul O, Tao JQ, Litzky L, Feldman M, Montone K, Rajapakse C, et al. Vascular inflammation in lungs of patients with fatal coronavirus disease 2019 (COVID-19) infection: Possible role for the NLRP3 inflammasome. medRxiv. 2021;rs3.rs-842167.
99. Kerboua KE. NLR: A cost-effective nomogram to guide therapeutic interventions in COVID-19. Immunol Invest 2021;50(1):92-100.
Otras Reseñas Bibliográficas – Hemograma Predictor en la Infección por Sars-Cov-2
100.Abensur Vuillaume L, Le Borgne P, Alame K, Lefebvre F, Bérard L, Delmas N, et al. Neutrophil-to-lymphocyte ratio and early variation of NLR to predict In-hospital mortality and severity in ED patients with SARS-CoV-2 infection. J Clin Med. 2021;10(12):2563.
101. Liu L, Zheng Y, Cai L, Wu W, Tang S, Ding Y, et al. Neutrophil-to-lymphocyte ratio, a critical predictor for assessment of disease severity in patients with COVID-19. Int J Lab Hematol. 2021;43(2):329-335. 102.Zhang JJ, Cao YY, Tan G, Dong X, Wang BC, Lin J, et al. Clinical, radiological, and laboratory characteristics and risk factors for severity and mortality of 289 hospitalized COVID-19 patients. Allergy. 2021;76(2):533- 550.
103.Yilmaz E, Ak R, Doganay F. Usefulness of the neutrophil-to-lymphocyte ratio in predicting the severity of COVID-19 patients: a retrospective cohort study. Sao Paulo Med J. 2022;140:81-86.
104.Oguz EG, Yeter HH, Akcay OF, Besli S, Selem T, Derici U, et al. Predictive value of neutrophil-to-lymphocyte ratio in terms of need for intensive care unit and mortality in maintenance hemodialysis patients with COVID-19. Hemodial Int. 2022;.
105.Xu B, Fan CY, Wang AL, Zou YL, Yu YH, He C, et al. Suppressed T cell-mediated immunity in patients with COVID-19: a clinical retrospective study in Wuhan, China. J Infect. 2020;81(1):e51-e60.
106.Zhao D, Yao F, Wang L, Zheng L, Gao Y, Ye J, et al. A comparative study on the clinical features of coronavirus 2019 (COVID-19) pneumonia with other pneumonias. Clin Infect Dis. 2020;71(15):756-761. 107.Tosato F, Giraudo C, Pelloso M, Musso G, Piva E, Plebani M. One disease, different features: COVID-19 laboratory and radiological findings in three Italian patients. Clin Chem Lab Med. 2020; 58(7):1149-1151.
108.Qu R, Ling Y, Zhang YH, Wei L, Chen X, Li XM, et al. Platelet-to-lymphocyte ratio is associated with prognosis in patients with coronavirus disease-19. J Med Virol. 2020;92(9):1533-1541.
Autores – Hemograma Predictor en la Infección por Sars-Cov-2
1 Germán Campuzano Maya, MD. Médico especialista en Hematología y Patología Clínica. Profesor, Ad honorem, Facultad de Medicina, Universidad de Antioquia. Expresidente y Miembro Honorario Academia de Medicina de Medellín.
Recibido: 7 de marzo de 2022
Aceptado: 9 de marzo de 2022
Correspondencia:
Germán Campuzano Maya
gcm.hema@gmail.co