Segunda línea: una nueva expectativa
Al mismo tiempo que se abordaba la búsqueda de una intervención óptima en primera línea, surgió el concepto revolucionario de una segunda alternativa. Hasta la década de 1990 aún existía un intenso debate sobre el valor de la quimioterapia inicial, incluso en los pacientes con buen estado funcional.
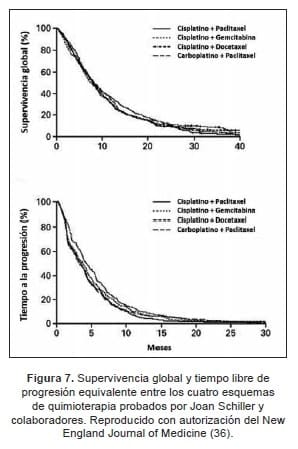
De cara al nuevo milenio, Fossella y colaboradores presentaron los datos del estudio TAX 320. Diseño que incluyó 373 pacientes asignados aleatoriamente a recibir docetaxel 100 mg/m2 (D100) vs. 75 mg/m2 (D75) y un régimen de control constituido por vinorelbina o ifosfamida. La tasa de respuesta global (TRG) fue del 10,8 y 6,7% con D100 y 75, respectivamente.
Este hallazgo fue significativamente superior a lo encontrado con vinorelbina o ifosfamida (0,8%), y se tradujo en la mejoría de la SLP (26 semanas) sin impacto aparente en la SG (supervivencia a un año del 32% vs. 19% para el grupo control; P=0,025). En adición, se encontró una mejor eficacia con el docetaxel en el grupo de sujetos refractarios al platino, y en aquellos con un mejor estado funcional (38).
En paralelo, Shepherd y colaborares desarrollaron y presentaron un estudio:
Comparó dos niveles de dosis del docetaxel vs. la mejor terapia de soporte en pacientes con cáncer de pulmón de células no pequeñas.
El estudio incluyó 104 pacientes y encontró una mejoría discreta en la respuesta (7,1%) con prolongación de la SLP (10,6 vs. 6,7 semanas, para la quimioterapia y la terapia de soporte).
Esta diferencia fue más significativa para los pacientes tratados con Docetaxel 75 mg/m2, intervención que mejoró la supervivencia en 2,9 meses y la tasa para esta cuantificado a 1 año de 37 vs. 11% para los pacientes expuestos al taxano vs. el cuidado de soporte paliativo, respectivamente (39).
Esta información dio paso a la introducción del pemetrexed que se comparó con el docetaxel en la configuración de la segunda línea. Aunque diseñado para demostrar superioridad, el ensayo clínico demostró una eficacia similar en términos de supervivencia pero mejoró la tolerabilidad. Y condujo a la aprobación del antifolato globalmente (40).
De igual forma, el estudio NCIC CTG BR21 demostró una mejoría significativa en la duración de la respuesta para el erlotinib (7,9 meses) en comparación con el placebo (3,7 meses; P <0,001). No obstante, la diferencia para la SLP entre los dos grupos fue de 2,2 y 1,8 meses, respectivamente, y la extensión de la SG solo fue 2 meses (41).
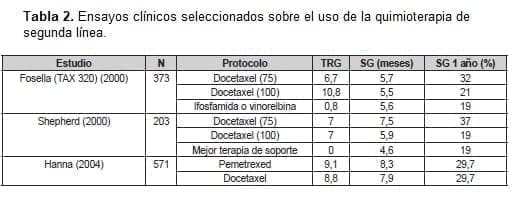
Por lo tanto, a mediados de la década del 2000, tres agentes habían demostrado una mejora menor, pero real. En la supervivencia durante la segunda e incluso la tercera línea de tratamiento del cáncer de pulmón de células no pequeñas. La Tabla 2 incluye los principales resultados de los estudios con quimioterapia en segunda línea.
La importancia de las variantes histológicas del carcinoma de células no pequeñas
Con el advenimiento de la broncoscopia flexible, las biopsias dirigidas por tomografía computarizada (TC), y el uso cada vez mayor de la aspiración con aguja fina para el diagnóstico. Una de las preguntas más relevantes fue cual era el linaje histológico del primario, células pequeñas o no pequeñas, y la variante fenotípica del último (adenocarcinoma o carcinoma de células escamosas).
Hasta ese momento el tratamiento se mantenía uniforme para el cáncer de pulmón de células pequeñas. Sin discriminar el subtipo como predictor de respuesta lo que hacia innecesario un esfuerzo adicional del patólogo para estratificar la enfermedad.
Sin embargo, la toxicidad asociada con el bevacizumab en los pacientes con carcinomas escamosos, y la eficacia del pemetrexed en los adenocarcinomas, ambos en el contexto de la primera línea. Renovaron la importancia de un diagnóstico más preciso.
En un experimento clínico fase II con asignación aleatoria Johnson y colaboradores:
Evaluaron la introducción del bevacizumab, un antiangiogénico revolucionario en diferentes niveles de dosis y en combinación con carboplatino y paclitaxel.
Además de observar un nivel prometedor de actividad, que finalmente se confirmó en el ensayo ECOG 4599. También notaron seis episodios de hemoptisis masiva, cuatro de los cuales fueron fatales (42,43).
Todos los casos ocurrieron en pacientes con carcinoma de células escamosas y resultó en la exclusión de esta histología en el estudio confirmatorio que condujo a la aprobación. El estudio ECOG 4599 demostró una SG de 12,3 meses en el grupo asignado a quimioterapia más bevacizumab en comparación con 10,3 meses para el control (reducción del riesgo de muerte del 21%; P=0,003). De igual forma, la mediana de LSP en los dos grupos fue 6,2 y 4,5 meses, lo que se tradujo en unas tasas de respuesta del 35 y 15% para el tratamiento con y sin el bevacizumab, respectivamente (P <0,001).
Los resultados para el bevacizumab dividieron al planeta en dos frentes, Estados Unidos y Europa. El segundo aferrado al uso de las combinaciones con gemcitabina.
El estudio AVAIL demostró una extensión de la SLP con la adición del bevacizumab a la quimioterapia en comparación con el placebo (HR 0,75, P=0,0003) sin claras diferencias entre dos niveles de dosis (7,5 y 15 mg/kg). La mediana para la SG fue superior a 13 meses en todos los grupos de tratamiento. Sin embargo, esta no aumentó con el uso del antiangiogénico (HR 0,93, P=0,42) (44).
La importancia de la histología se afirmó de manera positiva con la introducción del pemetrexed en la primera línea.
Un análisis estratificado por la histología realizado por Scagliotti y colaboradores demostró una ventaja terapéutica con el antifolato para el carcinoma no escamoso (SG para el adenocarcinoma 12,6 frente a 10,9 meses, P=0,03).
Por el contrario, hubo una supervivencia superior para los pacientes con carcinoma escamoso que recibieron gemcitabina (10,8 frente a 9,4 meses, P=0,05) (45).
Curiosamente, esta cuestión aparentemente básica permaneció confusa. Ya que existió una marcada discordancia entre los patólogos sobre la realización de diagnósticos basados en muestras quirúrgicas y porque ninguno de los estudios que demostraron la importancia de la histología en realidad se basó en técnicas de inmunohistoquímica.
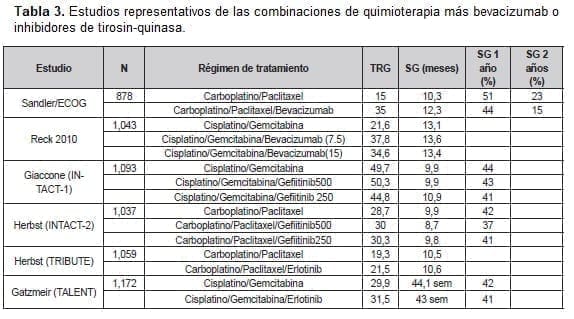
Tiempo después la discusión se concentraría en el principio biológico relacionado con la expresión diferencial de la timidilato sintasa entre los diferentes fenotipos del carcinoma de pulmón de células no pequeñas (46). La Tabla 3 hace un recuento de los estudios más representativos combinando quimioterapia más o menos bevacizumab o inhibidores de tirosin-quinasa.
La era molecular
La era molecular del cáncer de pulmón nació de forma inadvertida hacia el 2004, momento en que los inhibidores del receptor para el factor de crecimiento epidérmico (epidermal growth factor receptos, EGFR) se usaban de forma irrestricta y sin guía molecular.
El factor de crecimiento epidérmico (epidermal growth factor, EGF) fue descubierto hace más de 40 años, y la purificación y caracterización de su receptor de superficie celular. El EGFR, se describió por primera vez en 1980 (47,48); este hallazgo, realizado por Stanley Cohen le llevó a ganar el premio Nobel en Medicina.
El EGFR fue el primer receptor de superficie celular asociado al cáncer (49) y, posteriormente. Se documentó que su actividad está mediada por un estímulo específico cuya interacción supone la activación de una tirosin-quinasa (v-erbB). Que fue identificada como una proteína homóloga del oncogén viral aviar (50) (Figura 8).
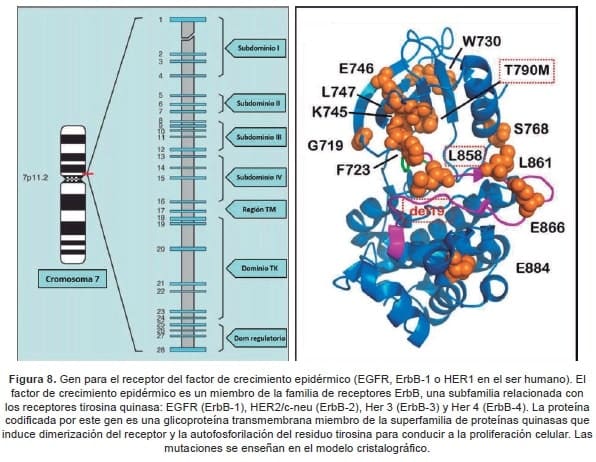
El EGFR es un miembro de la familia ErbB de receptores transmembrana de tirosin-quinasa. Dentro de los cuales se incluyen ErbB1 (HER-1 o EGFR), ErbB2 (o Her-2/neu), ErbB3 (o HER-3) y el ErbB4 (o HER-4).
El primero, es una glicoproteína transmembrana de 170 Kd de peso molecular que posee un dominio extracelular. Una porción transmembrana y un componente intracelular; este receptor se encuentra en la membrana celular como monómero inactivo y cuando se produce la unión del ligando con el componente extracelular se genera una dimerización con algún receptor homónimo (homodimerización), o bien una unión pareada con otro miembro de la superfamilia ErbB, o incluso con otros receptores (heterodimerización) (51).
Una gran cantidad de ligandos endógenos pueden activar el EGFR, entre otros el EGF, el TGF-α (transforming growth factor alfa), el HB-GF (heparin-binding growth factor), la betacelulina y la epirregulina (52).
La dimerización del EGFR produce una fosforilación cruzada del carbono-terminal del residuo de la tirosina que se encuentra en el dominio intracelular; esta fosforilación origina una cascada de señales de transducción intracelulares que incluyen las vías MAPK (Ras/mitogen-activated protein kinase) y PI3-K/Akt (phosphatidylinositol-3-kinase/Akt) (80), generando reacciones intracelulares en serie que se traducen en un incremento de la proliferación celular, en la movilidad, adhesión, invasión tisular, bloqueo de la apoptosis y resistencia a la quimioterapia (53).
La expresión del EGFR es común en diversos tejidos epiteliales normales, no obstante, se encuentra elevada en numerosos tumores sólidos (54). Se ha estimado que aproximadamente 50% de los carcinomas de pulmón de células no pequeñas presentan sobreexpresión del EGFR, 40% demuestran amplificación del gen, y entre el 15% y 50%, exhiben mutaciones en los exones 18 a 21 (54,55).
(Lea También: ALK en Cáncer de Pulmón)
En dos estudios clínicos fase III se exploró el efecto de la adición de gefitinib a un tratamiento de quimioterapia estándar; ambos estudios recibieron el nombre INTACT (The Iressa NSCLC Trial Assesing Combination Treatment) y utilizaron una dosis de gefitinib entre 250 y 500 mg/día, o placebo más los agentes citotóxicos.
Las dosis empleadas de gefitinib se eligieron atendiendo los hallazgos de Giaccone y colaboradores (56), que encontraron que las combinaciones eran seguras y eficaces, sin existir grandes interacciones farmacológicas entre los compuestos.
En el estudio INTACT-1 (57) se utilizó la combinación de cisplatino (80 mg/m2 día 1) y gemcitabina (1.250 mg/m2 días 1 y 8 cada 21 días), mientras que en el INTACT-2 (58), se utilizó la combinación de carboplatino (AUC 6) y paclitaxel (225 mg/m2 cada 21 días). La quimioterapia, en ambos casos, se administraba por seis ciclos y el placebo o el gefitinib se mantuvieron hasta el momento de la progresión de la enfermedad.
Entre los dos estudios se logró reclutar 2.130 pacientes en menos de un año; a pesar de lo que cabría esperar, ambos estudios fracasaron a la hora de demostrar un aumento significativo en la SG para quienes recibieron gefitinib respecto al control con placebo. Los objetivos secundarios de los dos estudios (SLP y TRG) fueron igualmente negativos. Posiblemente por la acción citostática del inhibidor de tirosin-quinasa que pudo reducir el efecto potencial de la quimioterapia al administrarse de manera concomitante (59).
Luego, se reportaron los resultados del estudio ISEL (Iressa Survival Evaluation in Lung Cancer) que comparó gefitinib 250 mg/día frente a placebo en pacientes en recaída tras un régimen de quimioterapia con base en platino (60); este experimento clínico incluyó 1.692 pacientes, en él no se documentaron diferencias estadísticamente significativas entre el grupo tratado con gefitinib y el de placebo en términos de incremento en la SG (5,6 vs. 5,1 meses; P = 0,11), ni siquiera, en la población de sujetos con adenocarcinoma (6,3 vs. 5,4 meses; P = 0,07) (60).
Al igual que con el gefitinib, se realizaron varios estudios con erlotinib junto a quimioterapia, en los que se obtuvieron resultados similares.
Existen datos de dos grandes estudios clínicos en los que se comparó el erlotinib 150 mg/día frente a placebo en combinación con esquemas basados en platino (la medicación oral se continuó hasta la progresión de la enfermedad).
Ambos experimentos fracasaron al no encontrar ningún beneficio para el grupo de pacientes tratados con el inhibidor tirosin-quinasa. El estudio TALENT (Tarceva Lung Cancer Investigation) reclutó 1.172 pacientes a los que se administró cisplatino y gemcitabina utilizando las mismas dosis que en el INTACT-1, con o sin erlotinib sin encontrar diferencias positivas para la SG (43 vs. 44,1 semanas para el grupo que recibió erlotinib y placebo respectivamente; HR 1,06), la SLP, TRG y para la calidad de vida (61).
El segundo estudio se denominó TRIBUTE (Tarceva Responses in Conjunction with Paclitaxel and Carboplatin), en él se aleatorizaron 1.079 pacientes de la misma forma que en el estudio previo. Pero el régimen de quimioterapia empleado fue carboplatino más paclitaxel usando las dosis del estudio INTACT- 2 (62).
La mediana de SG para quienes recibieron erlotinib fue 10,6 meses y para el control 10,5 meses (HR 0.99, IC95% 0,86-1,16; P = 0,95), no hubo diferencias estadísticamente significativas para la SLP ni para la TRG a favor del grupo de intervención, sin embargo, el análisis por subgrupos demostró que los no fumadores que recibieron el inhibidor tirosin-quinasa tuvieron una mayor SG (23 vs. 10 meses; HR 0,49) (63).
Este hallazgo, y el reporte de varios casos de respuesta extraordinario con un prolongado control de la enfermedad supuso la presencia de un predictor positivo. Lo que hizo que la discusión se concentrará alrededor de la expresión proteica y de la amplificación del gen.
En el año 2004, tres grupos independientes identificaron las mutaciones somáticas en el dominio tirosina-quinasa del gen EGFR en pacientes con respuesta clínica a gefitinib (64-66).
Dichas mutaciones no se evidenciaron entre quienes no respondieron y, por tanto, se postuló que este hallazgo podría identificar a los pacientes susceptibles de recibir los inhibidores específicos del EGFR. Reversibles y no reversibles (67).
Hasta la fecha se han identificado cerca de 300 alteraciones, distribuidas entre las sustituciones de bases (51%), microdeleciones (38%), microdeleciones con microinserciones (microindels, 8%), microinserciones (2%), y modificaciones tipo tandem (1%) (http://www.egfr.org).
Un análisis que incluyó 809 casos de pacientes con mutaciones permitió determinar que 46% presenta la deleción del exón 19 (Glu746_Ala750del), seguida por la mutación puntual del exón 21 (L858R) en 42% de los casos, y en menor proporción, por la mutación del exón 18 (G719L, 6%), y por la presentación basal de la mutación en el exón 20 (T790M) en 3%-7% de los pacientes (http://www.somaticmutations-egfr.info/NSCLC.html). Múltiples estudios han confirmado que las mutaciones en el gen EGFR son más frecuentes entre las mujeres de origen asiático, en quienes no se han expuesto al humo por combustión del tabaco (consumo inferior a 100 cigarrillos durante la vida), y entre los que presentan adenocarcinoma, especialmente del tipo lepidico (64).
En los Estados Unidos se ha estimado una incidencia anual de 10.000 – 20.000 casos de carcinoma de pulmón con mutaciones en el gen EGFR, lo que corresponde con el 15% de la población con esta neoplasia.
En Europa la incidencia se ha calculado en 16% (68), mientras en Asia podría estar alrededor del 40% (69). Hoy sabemos que la prevalencia en América Latina es del 35%, punto intermedio entre las dos latitudes y que responde a la ancestría de agrupaciones génicas concentradas alrededor de genes aborígenes (70).
En los pacientes con mutaciones, el tratamiento con inhibidores de tirosin-quinasa proporciona una respuesta clínica e imagenológica significativa; Costa y colaboradores integraron la información de cinco estudios que incluyeron 101 pacientes asiáticos tratados con gefitinib en primera línea encontrando una TRG de 80,8%, sin evidenciar inicialmente diferencias entre los sujetos con la deleción del exón 19 y la mutación L858R (80,3% vs. 81,8%) (71).
La mediana de SLP osciló entre los 7,7 y 12,9 meses y la SG no se alcanzó en cuatro de los cinco reportes, y en el otro fue de 15,4 meses. La administración del inhibidor de tirosin-quinasa resultó segura pues menos de 50% de los pacientes desarrolló una toxicidad cutánea menor y diarrea, y 2% presentó enfermedad pulmonar intersticial.
Un estudio homólogo valoró el papel del gefitinib y del erlotinib como intervenciones de primera línea en 121 pacientes tratados en cinco experimentos clínicos realizados en Estados Unidos y Europa (72); la TRG fue de 67%, el tiempo libre de progresión (TLP) de 11,8 meses y la SG de 23,9 meses. En contraposición, los pacientes con la deleción del exón 19 tuvieron una mejor SG y TLP respecto de aquellos que presentaron la mutación L858R.
Luego, el Grupo Español de Cáncer de Pulmón (GECP) diseñó el registro monográfico de seguimiento SLADB (Spanish Lung Adenocarcinoma Data Base) que incluyó 2.105 pacientes con adenocarcinoma a partir de 129 centros hospitalarios (73); la mediana del tiempo requerido para la obtención del estudio de las mutaciones del EGFR fue siete días (rango, 5 a 9) y en 350 casos (16.6%) esta prueba fue positiva.
Las mutaciones fueron más frecuentes entre las mujeres (69,7%; P < 0,001) y en los no fumadores (66%; P < 0,001), y 217 sujetos recibieron erlotinib en primera (N = 113 / 52,1%) y segunda línea (N = 104 / 47,9%). La deleción del exón 19 y la mutación L858R se detectaron en el tumor y en el suero en 62,2% y 39%, y en 37,8% y 20%, respectivamente.
En el grupo de pacientes con enfermedad evaluable (N = 197) la TRG fue 70,6% (IC95% 63,8%-76,5%; respuesta completa 12,2% y parcial 58,4%), 19,3% alcanzó la enfermedad estable y 10,2% tuvo progresión de la enfermedad. En paralelo se presentaron los resultados del estudio iPASS (Iressa Pan Asian Study) que permitió la inclusión del gefitinib como tratamiento de primera línea para pacientes con mutaciones del EGFR (74).
Este experimento clínico reclutó 1.217 pacientes con adenocarcinoma según una serie de características clínicas como el sexo y el antecedente de exposición al humo por combustión del tabaco (nunca fumadores o exfumadores que hubieran dejado el consumo hace más de 15 años y que éste fuera inferior o igual a 10 paquetes/ año).
Los sujetos fueron asignados en forma aleatoria a recibir gefitinib 250 mg/día o carboplatino (AUC 5 o 6/paclitaxel 200 mg/m2 cada tres semanas); la TRG fue superior en el grupo de sujetos tratados con el inhibidor tirosin-quinasa (43% vs. 32,2% para la quimioterapia con base en platino), el análisis global de la SLP demostró diferencias positivas a favor del gefitinib (5,7 vs. 5,8 meses, HR 0,74, IC 95% 0,65-0,85; P < 0,0001), al igual que para la SG (18,6 vs. 17,3 meses, HR 0,91, IC 95% 0,76-1,10).
La evaluación del subgrupo de pacientes con mutaciones del EGFR (N = 261) demostró una diferencia dramática a favor del gefitinib para la TRG (71,2% vs. 47,3% para la quimioterapia, OR 2,75, IC 95% 1,65-4,60; P = 0,0001), la SLP (9,5 vs. 6,3 meses, HR 0,48, IC 95% 0,36- 0,64; P < 0,0001) y la SG (no alcanzada vs. 19,5 meses, HR 0,78, IC 95% 0,50-1,20) (74) confirmando el impacto de una sola alteración genómica conductora.
Desde entonces, la introducción de los inhibidores de segunda generación (afatinib y dacomitinib), del único que representa la tercera (osimertinib), y de las combinaciones con quimioterapia y bevacizumab o ramucirumab han transformado la historia natural de la enfermedad (75).
Recientemente, se informaron los resultados finales del estudio FLAURA que incluyó pacientes con cáncer de pulmón EGFR con mutaciones comunes (Ex19del/L858R) y adecuado estado funcional. Se incluyeron sujetos con enfermedad metastásica cerebral estable que no tuvieron requerimiento de esteroides por más de dos semanas.
La población se dividió para recibir osimertinib (N=279) o gefitinib/erlotinib (N=277). Los sujetos se estratificaron por el tiempo de mutación y la raza, y se permitió el entrecruzamiento tras la confirmación de la progresión y la positividad para la mutación T790M. El desenlace principal fue la SLP y la SG se definió como un criterio de evaluación coprimario. La tasa de entrecruzamiento fue del 25% y tras alcanzar el 58% de la madurez de la información se documentó una reducción en el riesgo de progresión del 54%. La mediana de SG para el osimertinib y los inhibidores de primera generación fue de 38,6 meses (IC 95% 34,5-41,8) frente a 31,8 meses (IC 95% 26,6-36,0), respectivamente (HR 0,79, P=0,0462).
De igual forma, las tasas de SG a 12, 24 y 36 meses fueron 89, 83 y 74% vs. 59, 54, y 44%, respectivamente. Durante el seguimiento, se produjeron 155 (56%) muertes en los brazo de osimertinib vs. 166 (60%) en el comparador. Los eventos adversos ocurrieron en el 98% de los pacientes en ambas cohortes; de estos, el 42% fueron de grado ≥3 con osimertinib y el 47% con los inhibidores del EGFR de primera generación. Además, la toxicidad que llevó a la interrupción de la intervención se produjeron en el 15% de los pacientes tratados con osimertinib frente al 18% de los pacientes tratados con gefitinib o erlotinib (75,76).