Una causa de error en la interpretación del GAP, consiste en no advertir la influencia de la albúmina. Un hecho común e plicaciones de base. Representa la más importante limitación del cálculo del anión GAP. Por lo cual debe ser ajustado según las concentraciones de albúmina sérica. (24) La equivalencia aniónica de la albúmina es igual a 0,25 mEq/l por cada gramo de albúmina por litro (22).
Métodos para corregir el GAP por la influencia de la albúmina
Se han propuesto 3 métodos para corregir el GAP por la influencia de la albúmina, en los pacientes con hipoalbuminemia:
Anión GAP
Uno de ellos consiste en calcular el anión GAP esperado usando las concentraciones de albumina y fosfato respectivamente. Ya que estas variables, responden a una gran parte del hiato Aniónico normal: AG esperado (mEq/l) = (2 x albumina (g/dl))+ (0,5 x PO4 (g/dl)).
Se compara luego el valor calculado usando el método tradicional (Na+)–(Cl– + HCO3 -) con el valor esperado. Si el GAP calculado es mayor que el esperado, la diferencia se atribuye a aniones no medidos de ácidos no volátiles. (27)
Ajuste al GAP
El segundo método, es un método de ajuste al GAP de la albúmina, mediante la siguiente ecuación: GAPajustado=GAPcalculado + 2,5 x (4,5 – Albúmina (g/dl)) (5, 24, 28-30). La equivalencia aniónica de la albúmina es igual a 0,25 mEq/l por cada gramo de albúmina por litro. (22) Los autores del presente artículo utilizan este método para corregir el GAP.
Valor de lactato
El tercer método involucra el valor de lactato y se describe de la siguiente manera: GAP corregido= AG + 0,25 × (40 − Albúmina) − lactato. Valor normal de AG: 3-11 mEq/l (31). Jiménez Murillo y colaboradores (32) expresan que en estas situaciones es necesario ajustarlo incrementando el Anión GAP en una unidad por cada cuatro que descienda la albúmina de su valor normal.
Sin embargo expresan que un descenso de la albúmina desde 4,0 hasta 2,0 g/dL reduce el GAP por 5,0 mEq/dL (por cada gramo que desciende el valor normal de la albúmina, el GAP lo hace por 2,5). Otras causas de descenso del GAP además de la hipoalbuminemia lo son: mieloma igG, intoxicación por bromuros, sobredosis de salicilatos, hipercalcemia, hipermagnesemia, hipertrigliceridemia y toxicidad por litio (33).
Determinación del hiato-hiato, para las acidosis metabólicas con GAP aumentado
Cuando exista una acidosis metabólica con GAP aumentado, es posible determinar otro trastorno acidobásico metabólico (una acidosis metabólica GAP normal o una alcalosis metabólica); al comparar el exceso de anión GAP (diferencias entre el medido y el normal) con el déficit de HCO3 – (diferencia de la concentración plasmática de HCO3 – medido y la normal).
A continuación, se presentan 3 métodos por los cuales se puede realizar este cálculo.
Fórmula del HCO3
Una a través de la fórmula del HCO3 – corregido, la cual representa la usada por los autores de este artículo en la práctica clínica: HCO3 − Corregido= HCO3 − med + (GAP – 12). Se interpreta de la siguiente forma: Si HCO3− Corregido < 22 mmol/l: acidosis metabólica no anión GAP asociada (acidosis metabólica hiperclorémica). Si HCO3− Corregido >26 mmol/l: alcalosis metabólica asociada (15).
Exceso de GAP/déficit de HCO3
La segunda manera presenta la proporción (exceso de GAP/déficit de HCO3 -) o (ΔGAP/Δ HCO3 -). Usando 12 mEq/l como valor del anión GAP normal y 24 mEq/l como concentración plasmática normal de HCO3 – en el líquido extracelular se establece: Exceso de GAP/déficit de HCO3- = (GAP calculado – 12) / (24 – HCO3- medido) o (ΔGAP/ΔHCO3-) (3, 7, 12, 18).
Cuando un ácido fijado, se acumula en el líquido extracelular (acidosis metabólica GAP aumentado), la disminución del HCO3 – sérico es equivalente al aumento del anión GAP y la proporción ΔGAP/ΔHCO3 – =1.
Sin embargo, cuando aparece una acidosis hiperclorémica, la disminución del HCO3 – sérico es mayor que el aumento del anión GAP y la proporción ΔGAP/ΔHCO3 – cae por debajo de la unidad (<1). Por lo tanto, cuando existe una acidosis metabólica con anión GAP elevado, una proporción ΔGAP/Δ HCO3 – inferior a 1 indica la coexistencia de una acidosis metabólica GAP normal (hiperclorémica).
Por otra parte, cuando en presencia de una acidosis GAP elevado se añaden bases (HCO3 -), la disminución del bicarbonato sérico es menor que el aumento del anión GAP y la proporción ΔGAP/ΔHCO3 – es mayor que la unidad (>1).
Y por lo tanto, cuando exista una acidosis metabólica con anión GAP elevado, una proporción ΔGAP/ΔHCO3 – >1 indica coexistencia de una alcalosis metabólica (7, 34). Varios autores han probado esta fórmula con diferentes resultados y aclaran que no se ha llegado a consenso en cuanto a los valores de laboratorio que se pueden tomar (3).
Reveron y colaboradores (12) refieren este algoritmo de manera cualitativa, o sea solo comparando los resultados de la Δ GAP y Δ HCO3 -. Las posibles interpretaciones de esta fórmula se exponen en la Tabla 3.
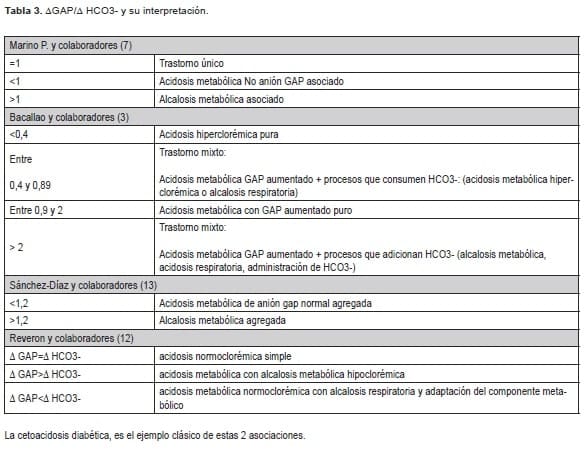
Incremento del AG
El tercer método, está concerniente al ΔGAP, que relaciona el incremento del AG (AG calculado – 12) y la disminución del bicarbonato (24 – HC03 – actual).
Para su cálculo se utiliza la siguiente fórmula: ΔGAP= (AG calculado – 12) – (24 – HC03 actual) Pueden ocurrir tres situaciones:
1. El ΔGAP es normal (O±6). La cuantía de la elevación del ΔGAP es igual que el valor de disminución del bicarbonato. Se trata de una acidosis metabólica simple con GAP elevado.
2. El ΔGAP es superior a +6. La cuantía del incremento del GAP es mayor que el grado de disminución del bicarbonato. En ese caso hay una alcalosis metabólica o una acidosis respiratoria asociada a la acidosis metabólica con GAP elevado, es decir, hay que identificar otro proceso que esté aumentando el bicarbonato.
3. El GAP es inferior a -6. La cuantía de la elevación del GAP es menor que el valor de disminución del bicarbonato. En esa situación hay una acidosis metabólica con GAP normal o una alcalosis respiratoria asociada a la acidosis metabólica con AG elevado (32).
El cálculo del intervalo osmolar (lO) (llamado también gap osmolar) a través de la fórmula: IO= osmolaridad medida – osmolaridad calculada (normal<10 mOsm/l) es útil en el diagnóstico diferencial de las acidosis metabólicas con GAP elevado por tóxicos exógenos, así: lO aumentado: en intoxicaciones por metanol (por cada 100 mg/ dl aumenta el gap osmolar en 32 mg/dl), etilenglicol (incrementa el gap osmolar en 16mOsmol/kg por cada 100 mg/dl) o alcohol isopropílico (14, 32, 35).
Bacallao y colaboradores (3) recomiendan agregar las concentraciones de etanol en el cálculo de la osmolaridad.
Determinación de la brecha aniónica urinaria (BAu) para las acidosis anión GAP normal (hiperclorémica)
Ante acidemia metabólica con brecha aniónica normal, es útil la determinación de la brecha aniónica urinaria (BAu) para definir si la alteración se debe a causas renales, o extrarrenales.
En términos prácticos, si la brecha aniónica es normal ante una acidosis metabólica, hay una pérdida de HCO3 – (principalmente del tubo digestivo o a nivel renal) o un aumento en el volumen de líquido extracelular (acidosis hiperclorémica inducida por la administración parenteral de solución de cloruro de sodio). La fórmula es: BAu = (Na+ + K+) – Cl- (2, 13, 24, 32).
Cuando el pH urinario es menor de 6,5 se excluye el HCO3 – (como en la fórmula). Su cálculo es muy similar al Anión GAP pero esta incluye al potasio debido a sus altas concentraciones urinarias (3).
Si la brecha aniónica está aumentada, hay un exceso de ácidos fuertes que se están agregando o no pueden eliminarse. No obstante, también se debe tener en cuenta que la disminución de los cationes principales (K+, Ca+) y la concentración falsamente elevada del Na+ aumentan la brecha aniónica (2; 13).
Otra posible interpretación de estos resultados sería:
Si Cloro > (Na+ + K+) Causa extrarrenal: Indica la existencia de ion NH4 en orina o acidificación orina normal (Diarrea, íleo, fístulas pancreáticas y biliares, derivación urétero-intestinal, laxantes, cloruro de calcio, sulfato de magnesio o colestiramina)
Si Cloro < (Na+ + K+) Causa renal: No se produce excreción de NH4. Hay pérdida renal de bicarbonato. Por otro lado, si hay hipopotasemia + pH Urinario > 5,5: Acidosis tubular renal tipo II: primaria (transitoria, genética o idiopática), alteración anhidrasa carbónica (déficit acetazolamida), sulfanilamida y síndrome de Fanconi (36).
Solo hay 2 condiciones donde el GAP urinario no es útil para estimar las diferencias descritas: Acidosis metabólica con GAP sérico muy elevado o depleción de volumen con elevada contención de sodio (12).
Compensación respiratoria para acidosis metabólica
En el estado estable de la acidosis metabólica existe una relación precisa, bien definida y predecible entre la magnitud del descenso del bicarbonato y el grado de hipocapnia. Existen al menos tres fórmulas que proveen una estimación de la compensación respiratoria:
PCO2esperado=últimos 2 dígitos del pH x 100 (37)
PCO2 esperado=(HCO3- medido)+ 15 defendida por Agrifoglio Rotaeche y colaboradores (18) y Lovesio (37) como la más ampliamente usada por su rapidez práctica.
PCO2 esperado = (1,5 x HCO3-) + 8 (±2). Esta última, la más utilizada por autores consultados (5, 32, 37-39) y recomendada por los autores del presente artículo.
De esta manera, al revisar la gasometría, debemos compararlo con la PCO2 medida y concluir lo siguiente: Si la PCO2 medido es igual a la PCO2 esperado entonces el Trastorno está Compensado (acidosis metabólica compensada), si la PCO2 medido es menor a la PCO2 esperado entonces estamos en presencia de una alcalosis respiratoria asociada (el trastorno se llamaría entonces acidosis metabólica primaria con alcalosis respiratoria asociada) por el contrario si la PCO2 medido es mayor al PCO2 esperado entonces hay una acidosis respiratoria asociada y el trastorno se denominaría acidosis metabólica primaria con acidosis respiratoria asociada (2, 40-42).
Por otra parte, Ayus, Caramelo y Tejedor (43), muestran un método cualitativo que consiste en el descenso por debajo de 1mmHg de la PCO2 desde 4 mmHg por cada mEq/l que baja el HCO3 – desde 25 mEq/. Si el deceso es mayor que 4 mmHg o más, existe alcalosis respiratoria asociada. Si el deceso es menor que 4 mmHg o más, coexiste una dificultad de la compensación ventilatoria y se halla una acidosis respiratoria subyacente.
Muchos autores varían en cuanto al grado de compensación respiratoria para determinado ph:
Algunos plantean que la PCO2 disminuye 1,2 mmHg por cada mEq/l de descenso del HCO3 -, (31) por lo que la formula quedaría: PCO2 Normal – (ΔHCO3 – x 1,2) = PCO2 esperado (±2) (42).
Otros plantean que por cada 1 mEq/l de descenso del HCO3 – (desde 25 mEq/l), la PCO2 disminuye 1 mmHg. (44)
Consideración especial de la gasometría arterial: la altura sobre el nivel del mar
A medida que ascendemos sobre el nivel del mar la presión barométrica disminuye y en consecuencia también lo hacen la presión inspirada de oxígeno (PiO2) y la presión arterial de oxígeno (PaO2). La hipoxemia aumenta la ventilación minuto (VE) disminuyendo PCO2 (45).
Este fenómeno evidentemente altera el patrón gasométrico, debido a los mecanismos primarios y compensadores antes expuestos (Toda compensación respiratoria, conlleva a una respuesta metabólica (46)). A razón de los autores de este artículo, los valores tomados como referencia se establecen a nivel del mar. Coincidiendo con investigadores consultados (5, 47).
A manera de conclusiones, podemos decir, que el trastorno acido-básico más complejo de determinar en toda su extensión es la Acidemia por Acidosis metabólica, debido que junto a este trastorno pueden aparecer hasta dos defectos más asociados (Acidemia por Acidosis Metabólica anión GAP y No anión GAP con una alcalosis respiratoria compensatoria).
El cálculo correcto de cada fórmula (independientemente del algoritmo escogido), representa la semiología del trastorno, lo que establecerá el diagnóstico definitivo.

Conflictos de interés
Los autores declaran no tener conflicto de interés.
Referencias
-
1. Márquez González H, Pámanes González J, Márquez Flores H, Gómez Negrete A, Muñoz Ramírez MC, Villa Romero AR. et al. Lo que debe conocerse de la gasometría durante la guardia. Revista Médica del Instituto Mexicano del Seguro Social [Internet] 2012 [Consultado 29 de septiembre de 2019];50(4):389-396. Disponible en: https://www.medigraphic.com/pdfs/imss/im-2012/im124j.pdf
-
2. Caballero López A, Caballero López AD. Trastornos del equilibrio acido básico. En: Quesada Pantoja J. ed. Terapia Intensiva T 2. Imagenología en el paciente grave. Medio Interno. [Internet].4ta edición. La Habana. Editorial Ciencias Médicas. 2019 [Consultado 29 de septiembre de 2019]. p 188 – 245. Disponible en: http://www.bvs.sld.cu/libros_texto/terapia_intensiva2_imagenologia_cuartaedicion/terapia%20intensivaii_4taed_cap18.pdf
-
3. Bacallao Méndez R, Mañalich Comas R. Trastornos del equilibrio hidromineral y ácido-base. Visión fisiopatológica. [Internet]. 1ª edición. La Habana. Editorial Ciencias Médicas, 2017. Disponible en: http://www.bvs.sld.cu/libros/trastornos_equlibrio_hidromineral_acido_base/indice_p.htm
-
4. Roca Goderich R. Temas de Medicina Interna. Colectivo de autores. 5ta edición. La Habana: Editorial Ciencias Médicas. 2017. Disponible en: http://bvs.sld.cu/libros_texto/roca_temas_medicina_interna_tomo1_quintaedicion/indice_p.html
-
5. Díaz Santos G, Ortiz Ruiz G. ¿Cómo interpretar los gases arteriales? Un enfoque integral: Revisión narrativa de la literatura. [Internet] NetMD.2019. Disponible en: https://revistamedicina.net/ojsanm/index.php/Medicina/article/view/1397
-
6. Jara Álvarez OP, Rea Quinllay JR. Estudio comparativo de la teoría de Stewart y la ecuación de Henderson Hasselbach, en la interpretación de las alteraciones ácido – base de pacientes en estado de choque en el servicio de emergencia del hospital Eugenio Espejo, período enero – junio 2016 [Especialista en Emergencias y Desastres]. Pontificia Universidad Católica del Ecuador. Facultad de Medicina 2017. Disponible en: http://repositorio.puce.edu.ec/bitstream/handle/22000/13304/STEWARD%20VS%20HENDERSON%20HASSELBACH%20EN%20CHOQUE.pdf?sequence=1&isAllowed=y
-
7. Marino PL. Interpretaciones Acidobásicas. En: Lazar T, Dernosky N. ed. El libro de la UCI. 4ta edición.España: Lippincott Williams & Wilkins. 2014.
-
8. Botey Puig A. Alteraciones del equilibrio acidobásico. En: Rozman C. Dir. Medicina Interna. [Internet]. 18va edición. España: Elsevier. 2016. Disponible en: https://www.clinicalkey.es/#!/content/book/3-s2.0-B9788490229965000880
-
9. Acosta Prieto D. editor. Pediatría. Diagnóstico y tratamiento.[ Internet]. 3era ed. La Habana. Editorial Ciencias Médicas, 2016. Disponible en: http://www.bvscuba.sld.cu/libro/pediatria-diagnostico-y-tratamiento-tercera-edicion/
-
10. Saínz Menéndez B. Alteraciones del equilibrio acido básico. Revista Cubana de Cirugía. [Internet]. 2006 [Consultado 29 de septiembre de 2019];45(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-74932006000100011&lng=es.
-
11. Hall John E. Guyton & Hall. Tratado de fisiología médica. 13era edición. Barcelona: Elsevier. 2016.
-
12. Fernández Reverón F. Alteraciones de los equilibrios hidromineral y ácido-base.[Internet]. La Habana. Editorial Ciencias Médicas. 2015. Disponible en: http://www.bvscuba.sld.cu/libro/alteraciones-de-los-equilibrios-hidromineral-y-acido-base/
-
13. Sánchez Díaz JS, Martínez Rodríguez EA, Méndez Rubio LP, Peniche Moguel KG, Huanca Pacaje JM, López Guzmán C, et al. Equilibrio ácido-base. Puesta al día. Teoría de Henderson-Hasselbach. Medicina Interna de México. [Internet]. 2016 [Consultado 29 de septiembre de 2019];32(6):646-60. Disponible en: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=71558
-
14. Palmer BF, Clegg DJ. Anion gap metabolic acidosis. Portuguese Journal of Nephrology & Hypertension. [Internet] 2017 [Consultado 29 de septiembre de 2019];31(2):73- 78. Disponible en: https://pdfs.semanticscholar.org/ebbf/f1f915a508a82d473def0ae8c3c6cac55ad1.pdf
-
15. Caughey AB. Maternal Blood Gas Physiology. En: Jeffrey P. editor in chief. Critical Care Obstetrics. 6a edición .Hoboken: John Wiley & Sons Ltd. 2019. Disponible en: https://onlinelibrary.wiley.com/doi/abs/10.1002/9781119129400.ch5
-
16. Killu K. ed. Fundamental Critical Care Support.[Internet] 6ta edición. Society of Critical Care Medicine. 2017. Disponible en: https://epdf.pub/queue/fundamental-criticalcare-support.html
-
17. Achinger SG, Ayus JC. Blood Gas Analysis and Acid– Base Disorders. En: Joseph Layon editor in chief. Civetta, Taylor & Kirby’s critical care. 5a edición. Philadelphia: Wolters Kluwer 2018
-
18. Agrifoglio Rotaeche A, Herrero de Lucas E, Sánchez Sánchez SM, Flores Cabeza E. Protocolo diagnóstico de la acidosis metabólica. Medicine. 2015;11(79):4768- 71.
-
19. Márquez González H, Cárdenas Fragoso J, Muñoz Ramírez M, Mota Nova A, Otero Vergara MÁ, Almeida Gutiérrez E, et al. Los gaps, una inteligente herramienta para interpretar el desequilibrio ácido base. Residente [Internet]. 2015 [Consultado 29 de septiembre de 2019];10(2):93-100. Disponible en: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=60501
-
20. Laverde Sabogala CE, Valencia Cárdenas AR, Vega Sandoval CA. Una causa inusual de acidosis metabólica severa: ayuno prequirúrgico. Revista Colombiana de Anestesiología. 2014;42(4):312–316.
-
21. Tipping R, Nicoll A. Mechanisms of hypoxaemia and the interpretation of arterial blood gases. Surgery. 2018;36(12):675-81.
-
22. Ramírez JA. Brecha aniónica plasmática. Archivos Argentinos de Pediatria. [Internet] 2005 [Consultado 29 de septiembre de 2019];103(1):51. Disponible en: https://www.sap.org.ar/docs/publicaciones/archivosarg/2005/A1.51-56.pdf
-
23. Hamilton PK, Morgan NA, Connolly GM, Maxwell AP. Understanding Acid-Base Disorders. Ulster Medical. Journal. [Internet] 2017 [Consultado 29 de septiembre de 2019];86(3):161-166. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5849971/
-
24. Hastings R, Bowker R. Acid-base physiology and interpreting blood gas results. Paediatrics and Child Health [Internet]. 2018 [consultado 29 de septiembre de 2019];28(7):301-7. Disponible en: https://www.paediatricsandchildhealthjournal.co.uk/article/S1751-7222(18)30072-6/abstract
-
25. Kelen GD, Nicolaou DD, Cline DM. Acid-Base Disorders En: Judith E. Tintinalli Ed. in Chief. Tintinalli’s Emergency Medicine. A Comprehensive Study Guide. 8a edición. McGraw-Hill Education. 2016 p 79-89
-
26. Rastegar M, Nagami GT. Non–Anion Gap Metabolic Acidosis: A Clinical Approach to Evaluation. American. Journal of Kidney Diseases. [Internet]. 2017 [citado 29 de septiembre de 2019];69(2):296-301. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0272638616305157
-
27. Kaufman DC, Kitching AJ, Kellum JA. Acid-Base Balance. En: Hall JB, Schmidt GA ed. Principles of Critical Care. 4th edición. McGraw-Hill Education 2015 p. 968- 974
-
28. Ramón Albarate M, Ortiz P de S, Alcazar Arroyo R, Corchete Prats E. Algoritmos en nefrología. Trastornos hidroelectrolíticos y del equilibrio acido-base. Edición Grupo Nacional Nefrología de la Sociedad Española de nefrología. Barcelona. 2011. Disponible en: http://static.elsevier.es/nefro/otras_pubs/algoritmos_sen_1.pdf
-
29. García Quintana JM, Santamaría Olmo R, Palenzuela Martín S; Delgado Lista J. Trastornos del equilibrio acido-base. En: Delgado Lista J. Ed. Guía de atención rápida en clínicas médicas. Barcelona: Elsevier 2014. p 328-332. Disponible en: https://www.clinicalkey.es/#!/content/book/3-s2.0-B9788490224144000625
-
30. Fores Novales B, Diez Fores P, Aguilera Celorrio LJ. Evaluación del equilibrio ácido-base. Aportaciones del método de Stewart. Revista Española de Anestesiología y Reanimación. [Internet]. 2016 [citado 29 de septiembre de 2019];63(4):212-9. Disponible en: http://www.sciencedirect.com/science/article/pii/S0034935615001103
-
31. Vaquerizo Alonso CI, Carreño Ponfil R. Acidosis y alcalosis metabólica. En: Montejo JC, García de Lorenzo A, Marco P, Ortiz C. autores. Manual de medicina intensiva 5ta edición. Barcelona: Elsevier. 2017 p 190-195. Disponible en: https://www.clinicalkey.es/#!/content/book/3-s2.0-B9788490229460000439
-
32. Calderón de la Barca Gázquez JM, Montero Pérez FJ, Calvo Rodríguez, Jiménez Murillo L. Alteraciones del equilibrio acidobásico. En: Jiménez Murillo L, Montero Pérez FJ ed. Medicina de urgencias y emergencias. Guía diagnóstica y protocolos de actuación. España: Elsevier. 2018 p 502-506. Disponible en: https://www.clinicalkey.es/#!/content/book/3-s2.0-B9788491132080000784
-
33. Reddi AS. Acid-Base Disorders. Clinical Evaluation and Management. Switzerland: Springer Nature. 2020.
-
34. Sánchez Díaz JS, Peniche Moguel KG, Martínez Rodríguez EA, Cortés Románc JS, Rivera Solís G, Díaz Gutiérreza SP, et al. Falsas creencias de los trastornos ácido-base. Acta Colombiana de Cuidado Intensivo. 2018;18(4):243-250.
-
35. Faria DK, Mendes ME, Sumita NM. The measurement of serum osmolality and its application to clinical practice and laboratory: literature review. Jornal Brasileiro de Patologia e Medicina Laboratorial.2017;53(1)38-45.
-
36. Dueñas Jurado JM, Muñoz Guillén NM. Acidosis Metabólica. En: de la Cal Ramírez MA cor. Manejo agudo de los trastornos electrolíticos y ácido base. 2da Edición. Barcelona: Editorial Digital Asus. 2015. p 56-59.
-
37. Lovesio Carlos. Acidosis metabólica. En: Mestre EO ed. Medicina Intensiva. 8va edición. Rosario: Corpus Libros Médicos y Científicos. 2008. p 1403-1416
-
38. Sánchez Díaz JS, Martínez Rodríguez EA, Peniche Moguel KP, Díaz Gutiérrez SP, Pin Gutiérrez E, Cortés Román JS, et al. Interpretación de gasometrías: solo tres pasos, solo tres fórmulas. Medicina Critica. 2018;32(3):156-159
-
39. Cruz Mosquera FE, Herrera Caballero AM, Tapia Angulo PE, Arango Arango AC. Diseño de una aplicación móvil para la interpretación de gases arterio-venosos. Archivos de Medicina (Manizales) [Internet]. 2018 [consultado 29 de septiembre de 2019];18(1):24-33. Disponible en: http://revistasum.umanizales.edu.co/ojs/index.php/archivosmedicina/article/view/2583
-
40. Nieto Ríos JF, Bello Márquez DC. Integración en la interpretación de los electrolitos y los gases sanguíneos. En: Memorias XXIII Simposio de Residentes de Medicina Interna UPB. Enfoques prácticos en medicina interna, Editorial UPB. 2017. Disponible en: https://www.researchgate.net/publication/322665638_INTEGRACION_EN_LA_INTERPRETACION_DE_LOS_ELECTROLITOS_Y_LOS_GASES_SANGUINEOS
-
41. Ferrerira JP. Acidosis Metabólica. Conceptos Actuales. Revista Pediátrica Elizalde. 2015;6(1-2):1-54.
-
42. D´Annunzio Á. Claves para el diagnóstico e interpretación del ácido base. En: Mestre EO ed. El laboratorio del paciente crítico. 1a edición. Rosario: Corpus Libros Médicos y Científicos. 2009. p 51-54.
-
43. Ayus, Tejedor, Caramelo. Agua, electrolitos y equilibrio acido-base. Aprendizaje mediante casos clínicos. Editorial Panamericana. 2012
-
44. Suárez Vargas M, Torres Guinea M, Roca Muñoz A. Alteraciones del equilibrio acido-base. En: Jiménez AJ cor. Manual de protocolos de actuación y urgencias. 4ta edición. España: Editorial grupo SANED. 2014.
-
45. Lasso Apráez JI. Interpretación de los gases arteriales en Bogotá (2.640 msnm) basada en el nomograma de Siggaard-Andersen. Una propuesta para facilitar y unificar la lectura. Revista Colombiana de Neumología. 2014;26(1):25-36.
-
46. Hinojosa Campero WE. Gasometría arterial y adaptación en la altura. Revista Médico-Científica “Luz y Vida” [Internet] 2011 [consultado 21 de mayo de 2020];2(1):39-45. Disponible en: http://www.redalyc.org/articulo.oa?id=325028222008
-
47. Tinoco Solórzano A, Román Santamaría A, Charri Victorio J. Gasometría arterial en diferentes niveles de altitud en residentes adultos sanos en el Perú. Horiz Med [Internet] 2017 [citado 21 de mayo de 2020]; 17(3):6-10. Disponible en: http://doi.org/10.24265/horizmed.2017.v17n3.02
Recibido: marzo 13 de 2020
Aceptado: mayo 14 de 2020
Correspondencia:
Ariel Sosa Remón
asosa@infomed.sld.cu





