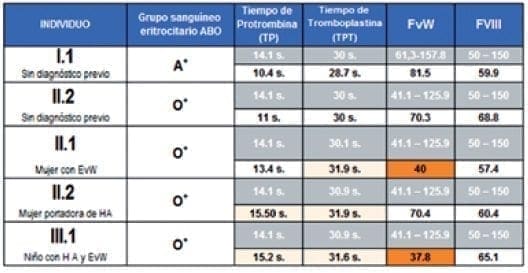
Se corroboraron los diagnósticos clínicos de los miembros de la familia de estudio en un solo Laboratorio de Referencia en Hemostasia.
De acuerdo con estos resultados y con el análisis hecho por el hematólogo de cada Entidad Promotora de Salud de los miembros de la familia, ninguno presenta un Factor VIII alterado, pero sí hay alteración en el FvW.
Los tiempos de Protrombina y Tromboplastina aunque no de forma relevante, se encuentran aumentados en algunos de ellos. (Tabla 1). (Lea también: Genética Molecular de la Hemofilia A, Materiales y Métodos)
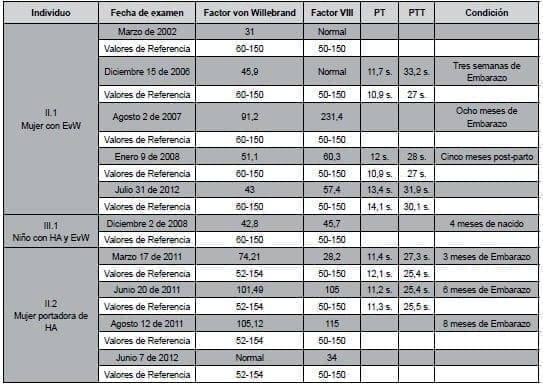
Tabla 1. Resultados de exámenes de un Laboratorio de Referencia en Hemostasia. Técnicas aplicadas: TP y TPT: Nefelometría centrífuga; FVIII: Coagulometría; FvW: Microelisa, Inmunoensayo por Turbidimetría. En naranja se muestran los resultados alterados. En rosado los valores de TP y TPT un poco aumentados.
Para confirmar el nuevo diagnóstico clínico, en donde no hay presencia de Hemofilia A se hizo el diagnóstico genético del gen del Factor VIII. Inicialmente se evaluó la presencia de las inversiones 1 y 22 en la familia.
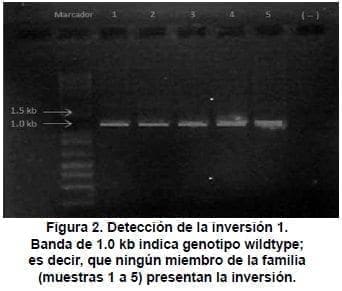
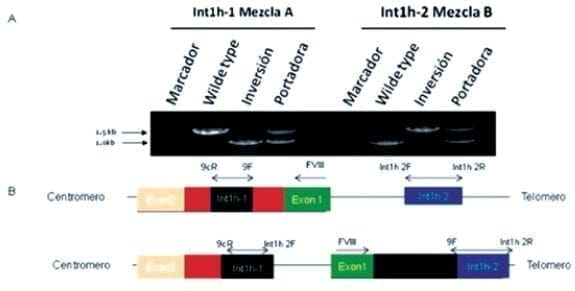
La inversión 1, que ocurre por secuencias homólogas, de aproximadamente 1Kb (Int1h) opuestamente orientadas y situadas hacia el extremo 5´ (upstream) en el intrón 1 y 200Kb del Factor VIII hacia el telómero Xq (26) (Anexo 4), no se presentó en ninguno de los miembros de la familia como se puede observar en la Figura 2 (banda de 1.0 Kb).
Por su parte, la inversión 22 resulta de un intercambio recíproco entre secuencias homólogas de 9,5 Kb (int22h), una ubicada dentro del intrón 22 del Factor VIII (int22h-1) y otras dos copias adicionales de int22h (int22h-2 e int22h-3), ubicadas en posición telomérica, aproximadamente, a 400Kb hacia el extremo 5´ (upstream) del gen del Factor VIII (26) (Anexo 6).
Para dicha inversión los cinco miembros de la familia obtuvieron bandas en los pozos 1 y 3 correspondientes a los primers P+Q y P+B, respectivamente, bandeo no concordante con el esperado para pacientes sanos, hemofílicos o portadoras (Figura 3).

El nuevo resultado obtenido para la inversión 22 ratificó la necesidad de realizar la secuenciación general del gen del Factor VIII. Dicha secuenciación se logró hacer en los cinco miembros de la familia y se obtuvieron los tamaños de banda esperados para cada exón (Anexo 5).
Los alineamientos realizados con el programa CLC Main workbench 7 demostraron la presencia de solo dos variaciones en algunos miembros de la familia, rs1800292 y rs1050705, ya reportadas en bases de datos como NCBI, Kaviar y HAMSTeRS.
La primera variación identificada como rs1800292 se detectó en el exón 14 de los individuos I.1 (Secuencia 1EX14D), II.1 (4EX14D) y II.2 (3EX14D). En estas secuencias se observó un polimorfismo, un cambio de una Adenina por una Citosina (Figura 4).
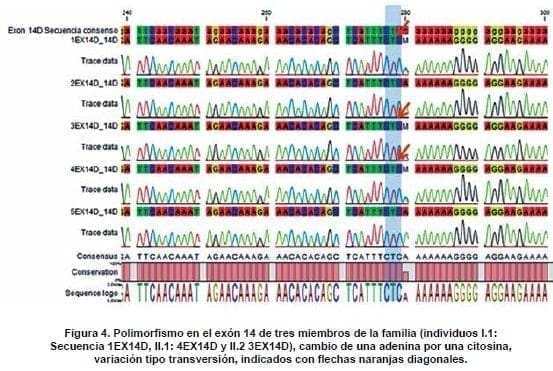
De acuerdo con los resultados arrojados por SIFT y PROVEAN, así como en el reporte de NCBI la variación no afecta la proteína, pues es de tipo sinónima y en consecuencia se mantiene el aminoácido serina (NP_000123.1:p.Ser1288=).
Lo anterior indica que pese a que los miembros de la familia I.1, II.1 y II.2 sean mujeres heterocigotas con un alelo A y el otro C, la proteína del Factor VIII sigue teniendo la misma secuencia. El efecto sobre la proteína también se analizó en SNPeffect 3.4 en donde se ratificó el efecto sinónimo de la variación.
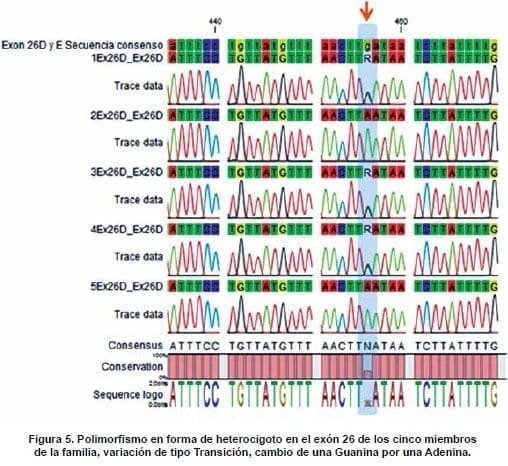
La segunda variación reportada en las bases de datos fue detectada en el exón 26. Esta variación denominada rs1050705, constituye una Variación R en donde cambia una Guanina por una Adenina. En los individuos I.2 (2Ex26D) y III.1 (5Ex26D) se observó la transición de una guanina por una adenina (sustitución de purina por purina).
En los demás miembros de la familia se observa un polimorfismo con la presencia de los dos alelos, A y G (Figura 5). De esta variación NCBI, SIFT, PROVEAN y SNPeffect 3.4 no cuentan con información respecto a una predicción del efecto sobre la proteína del FVIII, de ahí que en esta investigación se dé por primera vez un reporte del efecto sobre la misma. El codón con el alelo de referencia original es CUA y codifica para el aminoácido Leucina.
El codón con el alelo alterno o mutado es UUA, lo que constituye una variación de tipo sinónima y neutral, pues se codifica también para el aminoácido Leucina. Lo anterior demostraría que tampoco esta variación tiene un efecto dañino sobre la proteína del FVIII. Los demás exones no presentaron ninguna variación en sus secuencias.
Discusión
En condiciones normales, el complejo Factor tisular – Factor VIIa es el responsable inicial de convertir el Factor X en Factor Xa, el cual proporciona suficiente trombina para inducir la agregación local de las plaquetas y activación de los coFactores Factor V y Factor VIII.
Sin embargo, el Factor Xa es amortiguado por el inhibidor del Factor Tisular, lo que lo hace insuficiente para sostener la hemostasia. Solo la acción amplificadora del Factor IXa y Factor VIIIa sobre dicho Factor Xa permite que persista la misma (27).
En el caso particular de las personas con Hemofilia A ó Enfermedad de von Willebrand, dichos mecanismos de coagulación sanguínea se ven alterados.
Al evaluar los niveles de los Factores VIII y von Willebrand junto con otros valores de referencia en la familia de estudio, se pudo evidenciar un diagnóstico clínico que se mantiene en algunos pacientes, pero que en otros no está soportado con el segundo diagnóstico clínico hecho durante el presente estudio.
Así por ejemplo, la mujer diagnosticada como portadora de Hemofilia A (II.2) inicialmente presentaba el Factor VIII alterado, aunque su Factor von Willebrand y su TP y TPT eran normales.
Los niveles de Factor VIII entre 28.2 y 34 la clasificaban como portadora de una Hemofilia leve, congruente con las manifestaciones clínicas de hematomas y hemorragias mucosas espontáneas. Sin embargo, tras el nuevo diagnóstico clínico se observa un nivel normal de Factor VIII.
La mujer en mención presentó en los análisis previos niveles bajos del Factor VIII, que solamente se encontraron aumentados durante su embarazo. Para el caso de la mujer diagnosticada con Enfermedad de von Willebrand (II.1) se observó en las primeras y segundas pruebas clínicas el Factor VIII normal, pero continuaron alterados los niveles del Factor von Willebrand.
Al igual que en la mujer II.2, durante el embarazo los niveles del Factor VIII aumentaron considerablemente, pero, el Factor von Willebrand permaneció bajo, contrario a lo esperado.
Este fenómeno de aumento de los Factores durante la gestación es normal porque en esta etapa se producen diversos cambios en el sistema hemostático en general y en el fibrinolítico en particular, que tienen como finalidad prevenir una excesiva hemorragia en el parto.
Los Factores vitamino-K dependientes se incrementan durante la gestación, especialmente el Factor VII. También aumentan el Factor VIII, Factor von Willebrand y sobre todo el fibrinógeno (28).
El niño con el doble diagnóstico de Hemofilia A y enfermedad de von Willebrand (III.1), en sus primeras determinaciones de laboratorio presentó un nivel de Factor von Willebrand de 42,8 (valor de referencia de 60 – 150) y de Factor VIII de 45,7 (valor de referencia de 50 – 150).
En el nuevo diagnóstico solo se encontró alterado el Factor von Willebrand con un nivel de 37,8. Si el Factor VIII está directamente implicado en la vía intrínseca de la coagulación y ésta es medida en el laboratorio con los TPT parcial activado (2, 29), era de esperarse que estos valores aparecieran un poco prolongados en los individuos II.2 y III.2; sin embargo, el leve aumento de dicho tiempo no es relevante pues se aceptan hasta 4 segundos prolongados por encima del valor de referencia.
Cabe destacar que solo se consideran críticos valores de TP mayores de 20 segundos y de TPT mayores de 70 segundos (17), tiempos que no se dieron en la familia objeto de estudio. Los individuos I.1 y I.2 que previamente no habían sido analizados mostraron niveles normales de los dos factores, así como de TP y TPT.
El nuevo diagnóstico clínico basado en los resultados de laboratorio y en la apreciación de los hematólogos de las diferentes Entidades Promotoras de Salud de los individiduos, mostró en la familia de estudio un caso más de Enfermedad de von Willebrand, en donde se desvirtúa el doble diagnóstico preliminar.
Pero para descartar la presencia de Hemofilia A a nivel genético se buscó primero detectar las inversiones en los intrones 1 y 22. De acuerdo con los resultados la familia no presenta la Inversión 1, que ha sido reportada en el 5% de los pacientes con Hemofilia A severa (19).
Esto es congruente con las manifestaciones clínicas en la familia, pues ninguno de sus miembros presenta un fenotipo severo con hemorragias espontáneas en articulaciones y músculos.
Para el caso de la inversión 22, todos los individuos estudiados presentaron en las electroforesis banda en los carriles 1 y 3 que no permiten saber si se trata de personas hemofílicas, portadoras o sanas.
Según Poggi, la inversión 22 es un producto de una recombinación homóloga entre la región intrónica y las regiones cercanas al telómero, lo que produce la traslocación de los exones 1 al 22 a la región cercana al telómero en forma invertida (19).
Se cree que el gen distal, mas telomérico, sería más inestable y proclive a la recombinación homóloga o que en las regiones adyacentes existirían secuencias que facilitarían el mecanismo de recombinación. Esto genera ausencia completa de expresión del Factor VIII y un fenotipo severo, que no es el caso de la familia estudiada.
Es más, en los reportes existentes hasta el momento en la literatura no se evidencia ningún caso de inversión del intrón 22 en pacientes con fenotipo moderado o leve. Los pacientes con dicha inversión no pueden sintetizar un Factor VIII funcional dado que el gen está partido en dos y orientado en direcciones opuestas, por lo tanto es de esperar que todos los pacientes que presenten la inversión expresen un fenotipo grave (30).
Para identificar posibles variaciones en el resto del gen que tuvieran algún efecto en el fenotipo y confirmaran la presencia de Hemofilia A, se hizo secuenciación de los diferentes exones.
El tipo de mutación que se puede encontrar con esta técnica permite predecir la severidad de la enfermedad, en especial en los casos esporádicos o sin antecedentes familiares que corresponden a cerca de un tercio de los pacientes.
La secuenciación permite conocer también portadoras, una de las aplicaciones más importantes del análisis del gen del Factor VIII, a quienes se les podría brindar consejo genético por parte de personal especializado, o en quienes se podría conocer la presencia de alelos con mutaciones en el gen del Factor VIII, así tengan niveles normales de actividad del Factor VIII y no sean detectadas dichas variaciones (19).
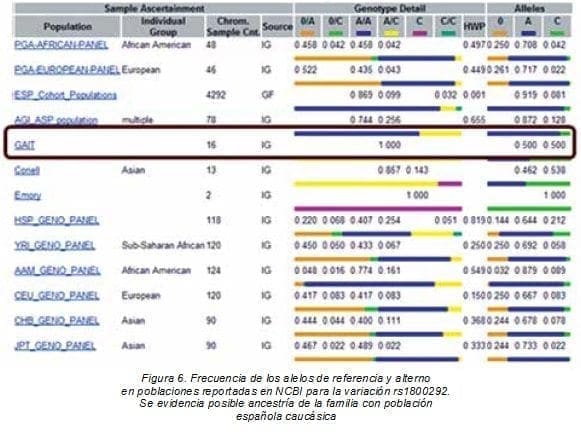
Los alineamientos realizados con CLC Main workbench 7 demostraron la presencia de sólo dos variaciones en algunos miembros de la familia, rs1800292 y rs1050705. Según los gráficos de población, el alelo ancestral adenina (A) de la variación rs1800292 podría provenir del noroccidente de Europa (0=0,261; A=0,717; C=0,022), y haber entrado con los eventos de colonización o migración a América.
El cambio del codón AGU por AGC pudo haber aparecido inicialmente en población Emory; es decir, afroamericanos o caucásico-americanos donde la fijación del alelo C es total, pese a ser una transversión, mutaciones menos probables que las transiciones (C= 1,0).
La población que por esencia ha sido heterocigota, presentando los dos alelos es la GAIT, correspondiente a españoles caucásicos, lo que demostraría la posible ancestría de la familia por linaje materno con dicha población (Figura 6).
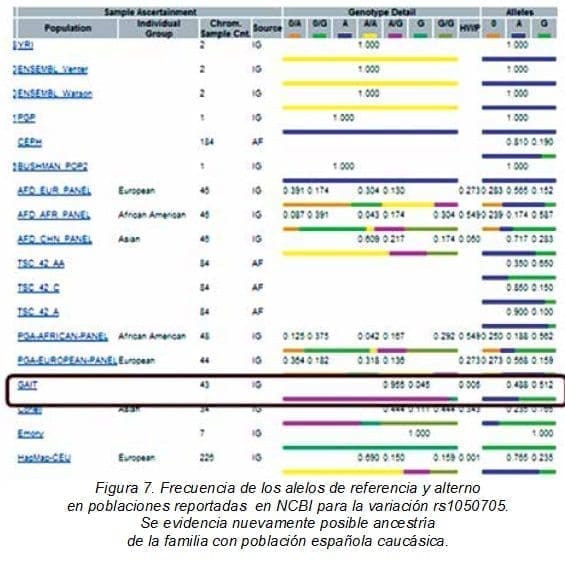
La variación rs1050705 en el exón 26, por su parte, es el resultado de un cambio de una Guanina por una Adenina (NG_011403.1:g.191799G>A). Extrapolando dicha información a los gráficos de población, se evidenció que sólo la población Emory; es decir, afroamericanos o caucásico–americanos poseen el alelo de referencia o ancentral G con una fijación igual 1,0.
En las demás poblaciones el alelo alterno o mutado se encuentra más frecuentemente, incluso sin evidencia del alelo ancestral, lo que implicaría que dicha mutación no es rara, pues desde tiempo atrás, se ha fijado en las diferentes poblaciones, como en el caso de los Yorubas en Ibadan, Nigeria (YRI), europeos (ENSEMBL Venter y ENSEMBL Watson) y caucásicos (PGP), entre otras (Figura 7).
Sólo la población GAIT, españoles caucásicos, presenta desde el inicio la condición heterocigota de A/G (0,488/0,512), tal como se observó en las mujeres de la familia (Figura 5, individuos I.1: Secuencia 1EX26D, II.1: 4EX26D y II.2 3EX26D), de ahí que la variación se vea en el alineamiento con el programa CLC Main workbench 7 como una variación R.
Lo anterior es el resultado de la doble carga cromosómica del X en las mujeres, contrario a la única carga en los hombres que no permite observar heterocigotos, sino de una vez sustituciones cuando hay una variación.
Esto se observó en los dos hombres de la familia objeto de estudio, en quienes es claro el cambio de Guanina por Adenina (Figura 5, individuos I.2: Secuencia 2EX26D y III.1: 5EX26D). Los datos de esta segunda variación evidencian nuevamente una posible ancestría de la familia con población española caucásica la cual sería interesante comprobar con análisis de marcadores informativos de ancestría.
De acuerdo con esta evidencia, podría suponerse que tanto el alelo de referencia como el mutado se encuentran fijados desde hace muchas generaciones en alguna parte de la población colombiana; por tanto, no se puede asegurar que la mutación tenga linaje materno o paterno en la familia objeto de estudio ni que haya mutaciones espontáneas en las células germinales de los parentales.
Los resultados del diagnóstico genético demostraron que la familia estudiada no presenta variaciones que afecten la proteína del Factor VIII; por tanto, se desvirtúa el doble diagnóstico clínico y la presencia de Hemofilia en ella desde un punto de vista netamente génetico.
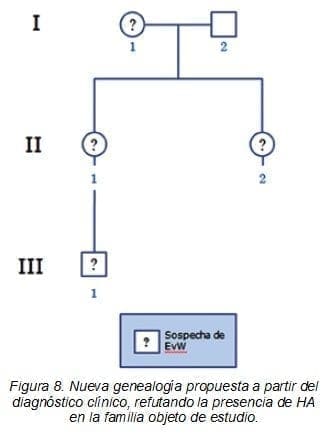
La nueva genealogía de la familia propuesta a partir de este estudio (Figura 8), contempla solamente la Enfermedad de von Willebrand. Pese a que los nuevos resultados de laboratorio respecto a los niveles del Factor von Willebrand sólo mostraron alteración en los individuos II.1 y III.1 (madre e hijo), es muy probable que las mujeres I.1 y II.2 tengan también la enfermedad y por eso se proponen en el nuevo diagnóstico como personas con sospecha, teniendo en cuenta la sintomatología que han presentado a lo largo de su vida.
Adicionalmente, es importante tener en cuenta que un factor ambiental que puede afectar los niveles del Factor von Willebrand y del Factor VIII es el estrés. Así, los niveles plasmáticos de dichos factores aumentan entre dos y cinco veces durante el estrés fisiológico o el ejercicio.
Algunos autores consideran que las hormonas tiroideas, epinefrina, estrógeno y progesterona son todas sustancias que incrementan los niveles del Factor von Willebrand. También varían durante el ciclo menstrual, la toma de anticonceptivos orales y el embarazo, como se mencionó anteriormente (6).
Dichos factores ambientales deben contemplarse como factores importantes en la detección de la Enfermedad de von Willebrand en toda la familia.
Como el problema de investigación planteaba la presencia de las dos enfermedades, se pensó en estudiar una de ellas con el propósito de comprobarla o descartarla a nivel molecular. La Enfermedad de von Willebrand no se analizó a nivel genético debido a que el gen del Factor von Willebrand es altamente polimórfico lo que complica su análisis genético (31) y muy extenso, con un tamaño de 178Kb y 52 exones (32).
En la actualidad se carece de la suficiente información para lograr secuenciarlo, de ahí que se abordaran las dos enfermedades clínicamente, pero sólo la Hemofilia A a nivel genético.
Es importante resaltar que de acuerdo con los resultados de laboratorio iniciales que tenía la familia y tras varios años de contar con el doble diagnóstico, hay un claro problema de diagnóstico clínico de las dos coagulopatías estudiadas y de calidad en las prácticas médicas, pues no todos los laboratorios tienen en cuenta los mismos valores de referencia y aplican las mismas pruebas para identificar la presencia o no de cierta enfermedad. Incluso ciertas pruebas no están cobijadas en el régimen de salud y por tanto los médicos tienen que basar su diagnóstico en las permitidas.
Con base en lo anterior, es probable que en estudios de laboratorio anteriores, los individuos II.2 y III.1 hayan sido diagnosticados con niveles de Factor VIII disminuidos cuando el factor que realmente estaba alterado era el Factor von Willebrand.
De hecho, el gran problema que se presenta en esta familia es que los individuos no tienen los estudios completos que de verdad se requieren para descartar desde un punto de vista clínico las dos coagulopatías, como por ejemplo, el coFactor de Ristocetina, agregación plaquetaria, microscopía electrónica plaquetaria, Factor XIII, retracción del coágulo y el tiempo de trombina (17).
Se sabe de antemano que el Factor VIII se asocia con el Factor von Willebrand para que lo estabilice al unirse al dominio B y al N- terminal del dominio A3 del Factor VIII. El Factor von Willebrand evita la unión de una superficie fosfolipídica al Factor VIII, superficie que la proteína C activada necesita para poder degradarlo (33).
El Factor von Willebrand se encuentra tan estrechamente relacionado al Factor VIII que cuando se purifica éste último del plasma, se copurifica también el Factor von Willebrand y constituye casi el 95% del total de la proteína contenida.
De hecho, el Factor VIII es un rastro en el plasma con una concentración de sólo 0.2 mg/L (34). Esto concordaría con la posibilidad de que la familia clínicamente hablando, posea Enfermedad de von Willebrand tipo 1 ó 2N, en la cual el Factor von Willebrand no se une al Factor VIII.
Al no unirse, éste último no es estable y se degrada en el plasma por la proteína C activada. Al hacer el análisis del factor se asume que el Factor VIII no es funcional y se da el diagnóstico equivocado de Hemofilia A (35), situación que probablemente ocurrió con los individuos II.2 y III.
Se asume que la familia objeto de estudio podría tener Enfermedad de von Willebrand tipo 1 o 2N porque en los dos tipos se consideran disminuciones de los niveles del Factor von Willebrand y Factor VIII; sin embargo, la tipo I que se hereda como un rasgo dominante, se diagnostica cuando son deficiencias cuantitativas parciales de los factores.
La 2N o Normandía, un rasgo poco frecuente recesivo, es una deficiencia cualitativa que afecta la función de la proteína del Factor von Willebrand, situación muy cercana a la de algunos miembros de la familia (17). Se descarta la Enfermedad de von Willebrand tipo 3 en la familia pues ésta consiste en la ausencia virtual de la proteína del FvW y tiende a generar un fenotipo severo (6).
Saber específicamente si la familia presenta una Enfermedad de von Willebrand de tipo 1 o 2N depende de una serie de análisis de laboratorio más exhaustivos, que incluyan medidas cualitativas y cuantitativas del Factor von Willebrand y del Factor VIII.
Entre algunas pruebas especializadas para confirmar la Enfermedad de von Willebrand como las mencionadas anteriormente, estarían las pruebas de agregación plaquetaria con diferentes agentes agregantes como Ristocetina y colágeno.
La prueba de actividad del CoFactor de Ristocetina en plasma puede determinarse a través de la aglutinación de una suspensión estandarizada de plaquetas en presencia del Factor von Willebrand utilizando el antibiótico ristocetina.
La Enfermedad de von Willebrand está asociada a una reducción de la actividad del coFactor de la ristocetina y de forma generalizada se acepta que dicha prueba es el ensayo in vitro más útil para diagnosticar la Enfermedad de von Willebrand (36).
Los análisis biológicos y clínicos deberán ir acompañados de un diagnóstico genético que permita comprobar mutaciones en el gen del Factor von Willebrand, lo que abriría la puerta a investigaciones futuras.
Conflicto de Interés
Las autoras manifestamos que no existe ningún conflicto de interés en la realización de este estudio.
Financiación
Cofinanciado por el Comité de Investigaciones y Posgrados de la Facultad de Ciencias de la Universidad de Los Andes.
Agradecimientos
la familia objeto de estudio. A la Dra. Mónica Duarte, hematóloga de la Fundación Santa Fé de Bogotá, por sus aportes en el campo de la Hematología.
Referencias
1. Graw J, Brackmann H, Oldenburg J, Schneppenheim R, Spannagl M, Schwaab R. Haemophilia A: from mutation analysis to new therapies. Nat Rev Genet. 2005; Jun;6(6):488-501.
2. Kasper C. Trastornos hereditarios de los Factores de coagulación plasmáticos y su manejo. Federación Mundial de la Hemofilia. (FMH). Tratamiento de la Hemofilia. 2008; Quinta Edición. No. 4. Abril.
3. Rick M, Walsh C, Key N. Congenital bleeding disorders. Hematology. ASH Education Book. 2003; January 1 vol. 2003 no. 1 559-574. doi: 10.1182
4. Lillicrap D. Ciencia básica, diagnóstico y tratamiento médico de la EvW. Federación Mundial de la Hemofilia. (FMH). 2008; Abril. No 35. Ontario, Canadá.
5. WFH. Report on the ANNUAL GLOBAL SURVEY. World Federation of Hemophilia. 2014.
6. Robertson J, Lillicrap D, James P. Enfermedad de Von Willebrand. Pediatr Clin N Am. 2008; 55; 377–392.
7. Martínez – Murillo C. Mecanismos de activación de la coagulación. Rev Med Inst Mex Seguro Soc. 2006; 44 (Supl 2): 51-58
8. Devlin T. Bioquímica. Editorial Reverté. Cuarta Edición. Barcelona, España. 2006.
9. Colhemofílicos. Pasado, presente y futuro de la Hemofilia. Liga Colombiana de Hemofílicos y otras deficiencias sanguíneas. 2014.
10. Jiménez Moles E, Ortiza Callejón M, Béjar Pretel F. Enfermedad de von Willebrand y su diagnóstico en el laboratorio. Tomado de libroslaboratorio.wordpress. com. 2012.
11. Spronk H, Govers-Riemslag J, Cate H. The blood coagulation system as a molecular machine. Bioessays. 2003; 25: 1220-1228. DOI: 10.1002/bies.10360
12. Mannucci P. Hemophilia and related bleeding disorders: A story of dismay and success. Hematology. 2002; 1: 1-9. doi: 10.1182
13. Leiria L, Roisenberg I, Salzano F, Bandinelli E. Introns 1 and 22 inversions and Factor VIII inhibitors in patients with severe haemophilia A in southern Brazil. Haemophilia. 2009; Jan; 15(1):309-13.
14. Rodríguez – Martorell F, Mingoor M, Palomo A, Nuñez R, Pérez – Garrido R, Villar A et al., Recomendaciones sobre Portadoras en Hemofilia. Real Fundación Victoria Eugenia y Federación Española de Hemofilia. 2009.
15. Gringeri A, Ewenstein B, Reininger A. The burden of bleeding in haemophilia: is one bleed too many? Haemophilia 2014; 20: 459-63
16. Rhynders P, Sayers C, Presley R, Thierry J. Providing Young Women with Credible Health Information about Bleeding Disorders. Am J Prev Med. 2014 Nov;47(5):674-80. doi: 10.1016/j.amepre.2014.07.040. Epub 2014 Sep 19.
17. Kitchen S, McCraw A, Echenagucia, M. Diagnóstico de la hemofilia y otros trastornos de la coagulación: Manual de laboratorio. Federación Mundial de Hemofilia. 2010; Segunda edición. Québec, CANADÁ
18. Gaaib J, Nassief A, Al-Assi A. Simple salting – out method for genomic DNA extraction from whole Blood. Tikrit J Pure Sci. 2011; 16 (2). ISSN: 1813 – 1662.
19. Poggi H, Honorato J, Romeo E, Zuñiga P, Quiroga T, Lagos M. Análisis de las inversiones del intrón 1 y 22 y secuenciación del gen F8 para el diagnóstico genético-molecular de hemofilia A en Chile. Rev Med Chile. 2011; 139: 189-196
20. Liu Q, Nozari G, Sommer S. Single-tube polymerase chain reaction for rapid diagnosis of the inversion hotspot of mutation in hemophilia A. Blood. 1998; Aug 15; 92(4):1458-9.
21. Garcés-Gutiérrez, M. Estudio molecular de la inversión de los intrones 1 y 22 del FACTOR VIII de la coagulación en un grupo de pacientes pediátricos Colombianos con diagnóstico de HA. Tesis de Maestría, Universidad Nacional de Colombia. 2012
22. Poláková H, Zmetáková I, Kádasi L. Long distance PCR in detection of inversion mutations of F8C gene in hemophilia A patients. Gen Physiol Biophys. 2003; Jun; 22(2):243-53.
23. Bagnall R, Waseem N, Green P, Giannelli F. Recurrent inversion breaking intron 1 of the Factor III gene is a frequent cause of severe hemophilia A. Blood. 2002; Jan 1; 99(1):168-74.
24. Bermeo S, Silva-Tamar C, Fonseca J, Restrepo C. Hemofilia: diagnóstico molecular y alternativas de tratamiento. Colomb. Med. 2007; v.38 n.3 Cali Jul. /Sep.
25. Choi Y, Sims G, Murphy S, Miller J, Chan A. Predicting the Functional Effect of Amino Acid Substitutions and Indels. PLoS ONE. 2012; 7(10): e46688.
26. Radic, C. Genética molecular de hemofilia: caracterización de mutaciones en hemofilia B, expresión de hemofilia en mujeres y desarrollo de nuevos métodos de análisis de inversiones. Tesis Doctoral. Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Argentina. 2010.
27. García-Chávez J, Carrillo-Esper R, Majluf-Cruz A. Fisiología del sistema de coagulación. Gac Méd Méx. 2007; Vol. 143 Supl 1.
28. Kadir R, James A. Salud reproductiva en mujeres con trastornos de la coagulación. World Federation of Hemophilia. Tratamiento de la hemofilia. 2009; octubre de 2009 no 48. Montréal, Québec, Canadá.
29. Giangrande P. Hemofilia adquirida. World Federation of Hemophilia. Tratamiento de la hemofilia. 2005; Diciembre No. 38. Montréal, Québec, Canadá.
30. Tizzano E. Las bases moleculares de la hemofilia A. En: Méndez Felpeto J. La genética molecular en el diagnóstico de las patologías humanas: estrategias y tecnologías. A Coruña: Universidad, p. 39-48. ISBN: 84-88301-48-0. 1996.
31. Keeney S, Bowen D, Cumming A, Enayat S, Goodeve A, Hill M. The Molecular Analysis of von Willebrand Disease: a Guideline from the UK Haemophilia Centre Doctors’ Organisation Haemophilia Genetics Laboratory Network. UK Haemophilia Centre Doctors’ Organisation (UKHCDO). 2008.
32. Goodeve A. Genotypic classification of von Willebrand disease. Haematologica reports. 2005; 1(4):16-19.
33. Fay P, Coumans J, Walker F. Von Willebrand Factor mediates protection of Factor VIII from activated protein C- catalyzed inactivation. J Biol Chem. 1991; 266, 2172-2177
34. Fulcher C, Zimmermann T. Characterization of the human Factor VIII procoagulant protein with a heterologous precipitating antibody. Proc Natl Acad Sci. 1982; 79, 1648-1652.
35. Mazurier C, Dieval J, Jorieux S, Delobel J, Goudemand M. A new von Willebrand Factor (vWF) defect in a patient with Factor VIII (FVIII) deficiency but with normal levels and multimeric patterns of both plasma and platelet vWF: Characterization of abnormal vWF/ FACTOR VIII interaction. Blood. 1990; 75, 20-26.
36. Clinical and Laboratory Standards Institute (CLSI). Collection, Transport, and Processing of Blood Specimens for Testing Plasma-Based Coagulation Assays and Molecular Hemostasis Assays; Approved Guideline – Fifth Edition. CLSI document. 2008; H21-A5 Vol. (28), No. (5).
Recibido: Octubre 10,2014
Aceptado: Diciembre 2, 2014
Correspondencia:
Diana Polanía Villanueva
dc.polania@uniandes.edu.co
Helena Groot
hgroot@uniandes.edu.co
Anexo 1
Estructura del FACTOR VIII y el FvW y su acción en la cascada de coagulación. Parte de ella tomada de https://www.quimbiotec.com/Factor8.php y https://www.nhlbi.nih.gov/guidelines/vwd/2_scientificoverview.htm

Anexo 2
Datos clínicos resumidos y detallados previos al estudio de la familia. En naranja se muestran los resultados alterados. Las fechas con asterisco indican condición especial de embarazo.

Anexo 3
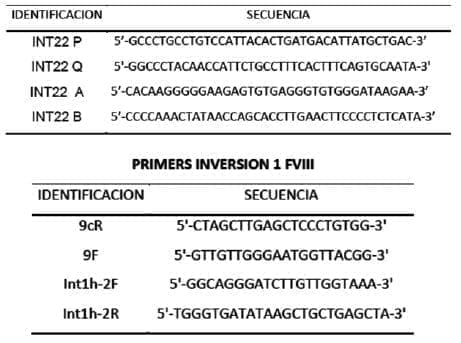
Detalle de la secuencia de los primers usados en la detección de las inversiones 1 y 22 del gen del FACTOR VIII de la coagulación.
Anexo 4
Esquematización grafica de la técnica LD PCR para la detección de la INV 1. A. Patrón de bandas en el gel de agarosa, según la mezcla de primers en cada caso. B. Representación gráfica de la técnica LD PCR en donde se muestra la ubicación del juego de primers en la detección y amplificación de las regiones int1h-1 e int1h-2. (21).
Anexo 5
Juego de primers para la secuenciación de los exones del gen del FVIII. Tomada de https://hadb.org.uk/WebPages/Database/Methods/keeneyprimers.doc
Anexo 6
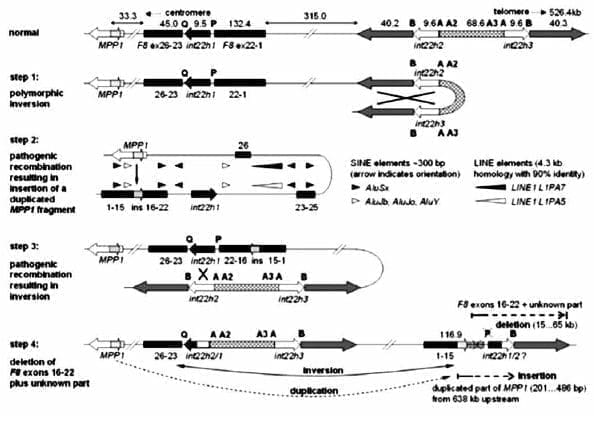
Inversión 22. Esta imagen fue tomada de Mühle C, Zenker M, Chuzhanova N, Schneider H. Hum Mutat. 2007 Oct;28(10):1045. En la figura los valores indican en tamaño de las regiones en kb, las letras P, Q, A, A2, A3 y B muestra los sitios de unión usados para la LD-PCR para la detección de la inversión relacionada con int22h.
Las cajas negras representan los exones 1-22 y 23-26 del FVIII, las cajas grises indican las regiones que flanquean las copias extragénicas int22h2 e int22h3 que facilita la recombinación homóloga intergénica que da por resultado el primer evento. Los triángulos representan las secuencias Alu y L1 y su orientación.
El proceso continua con la formación y estabilización del loop mediado por elementos de tipo Alu y L1, lo que permite la inserción de un fragmento externo al FACTOR VIII en este caso en el intrón 15, siendo este el segundo paso.
El tercer paso lo constituye la recurrente recombinación entre las regiones int22h1 e int22h2 y el cuarto paso presumiblemente estaría compuesto por las deleción de exones del FVIII, contribuyendo a la complejidad del patrón resultante (21)