Sus Aplicaciones Futuras
*Académico Álvaro Dueñas L.; Doctor Rodrigo Cifuentes B.;
Licenciado William David Criollo; Licenciada Ana Julia Miranda ded
Bernal; *De los departamentos de Microbiología y Programa IN-VITRO (A.
Dueñas, MD, MPH, TM, W. D. Criollo, Bact. y A. De Bernal, Trab. Soc.) y
Ginecología y Obstetricia (R. Cifuentes, MD, PhD), Facultad de Salud,
Universidad del Valle y Hospital Universitario del Valle, Cali, Colombia.
Resumen
La importancia de los cultivos celulares humanos continúa expandiéndose, en especial en el campo de la bioingeniería de tejidos. Con el fin de establecer mejores criterios de selección en la obtención de tejido renal postmortem, se estudiaron 111 neonatos de < 3 días de edad, fallecidos en la sala de Cuidados Intensivos del Recién Nacido (CIRENA) y 22 mortinatos de la sala de partos del Hospital Universitario del Valle (HUV) en Cali, Colombia, entre enero 1 y diciembre 31 de 1995.
Se consideraron los antecedentes maternos y fetales, en busca de variables que determinen una mejor viabilidad celular renal postmortem (VCRP). Además, se hizo un estudio del estado microbiológico de los neonatos postmortem y de los mortinatos mediante el examen de sangre y células para conocer la incidencia en estos de infecciones bacterianas y virales.
De los 133 casos estudiados, 115 (86%) fueron de bajo peso al nacer (BPN), vgr. 500 a 2,500 gramos y los 18 (14%) restantes fueron de peso adecuado al nacer (PAN) >2,500 gramos.
De 13 clases de diagnóstico registrados como antecedentes maternos, los seis más frecuentes fueron: ruptura prematura de membranas (RPM) – 20%, PRE-eclampsia/eclampsia (PE) – 13%, corioamnionitis (CA) – 11%, infección urinaria (IU) – 11%, placenta previa (PP) – 9% y vaginitis (V) – 8%. De los ocho diagnósticos registrados en los neonatos, los dos más frecuentes fueron el síndrome de dificultad respiratoria (SDR) y la enfermedad de membrana hialina (ME) -73%.
Se pudo observar que la VCRP total fue de 65%, siendo mayor en los casos con BPN (69%) que en los de PAN (39%). Independientemente de los antecedentes maternos se observó una VCRP de 70% y 77% en los casos con diagnóstico de SDR y EMH, respectivamente.
Por otra parte, se obtuvo la mayor VCRP en los casos con diagnóstico materno de PP (83%). Aunque por el bajo número de casos expuestos en el presente estudio estas diferencias no demostraron significancia estadística, estos resultados son consistentes con los antes publicados.
Se obtuvieron 6 casos (4.5%) con cultivos bacteriológicos positivos (Klebsiella pneumoniae-2, Bacillus subtilis-2, Pseudomona aeuroginosa-1, Staphylococcus aureus-1) compatibles con el diagnóstico de sepsis neonatorum. Pruebas de tamizaje inicial con “rapid plasma reagin” (RPR) detectaron 10 (7.5%) muestras positivas que plantean la posible presencia de anticuerpos asociados con sífilis en esta población al momento del parto.
Estos resultados ameritan investigar mas a fondo la prevalencia y estadios reales de sífilis en esta población de RPR positivos con pruebas más especificas como VDRL y FTA-ABS. No se detectó seroreactividad para el virus de inmunodeficiencia humana (VIH) ni de hepatitis B.
Este estudio, al igual que otros anteriores, sugiere una mayor VCRP en aquellos casos con diagnósticos que pudieran asociarse con una menor madurez fetal, como BPN, EMH/SDR, PP, y PE. Se podría esperar entonces que, a menor madurez fetal, mayor posibilidad de encontrar tejidos que den una mejor viabilidad celular.
Estudios continúan en curso para que nos ayuden a establecer pautas para mejorar la selección de casos que nos permitan obtener cultivos celulares con mayor viabilidad. (Lea también: Museo de Historia de la Medicina Academia Nacional de Medicina de Colombia)
Introducción
La tecnología de los cultivos celulares in Vitro se inició a principios del siglo con los trabajos de Harrison y Carrel 1, 2, pero su aplicación en la investigación módica sólo fue posible años más tarde.
La dificultad de obtener y mantener cultivos de células bacteriológicamente estériles fue la limitante en el desarrollo de esta tecnología.
El descubrimiento de los antibióticos cerca de la mitad del siglo y su incorporación en los medios para cultivos celulares obviaron dicha dificultad, y más recientemente, el desarrollo de la criobiología hizo posible mantener en congelación en nitrógeno líquido, a muy bajas temperaturas, células vivas por períodos ilimitados de tiempo.
Estos son un ejemplo de cómo un descubrimiento científico abre las perspectivas de otros. En efecto la tecnología del cultivo de células in vitro se ha convertido en un medio extraordinario en la investigación científica módica y su aplicación en los problemas de la salud humana y animal ofrece enormes posibilidades3.
La mayor aplicación de los cultivos celulares in vitro ha estado tradicionalmente relacionada con las investigaciones de los virus en el terreno básico, epidemiológico, clínico y en el desarrollo de vacunas contra enfermedades virales humanas y animales y ha reemplazado en grado altamente significativo el uso de animales de laboratorio para éstos y otros fines.
En un trabajo recientemente publicado por nosotros, se presentó un resumen sobre la aplicación actual de la tecnología de cultivos celulares in vitro y las experiencias locales de la misma en estudios sobre virus 4 .
Hasta ahora la metodología clásica para cultivar células in vitro ha sido, o bien la siembra de éstas con medios nutritivos en superficies planas de botellas
de vidrio o de plástico en las cuales se adosan y multiplican hasta formar una lámina uniforme bidimensional de células -2D-, o en suspensiones de células libres en el medio nutritivo, siempre bajo la influencia normal de la gravedad.
En los últimos años se ha diversificado la aplicación de cultivos celulares in vitro extendiéndose a otras disciplinas de la investigación científica módica. Una de las proyecciones más importantes es el desarrollo de los cultivos celulares tridimensionales 3D- y de órgano idees in vitro, mediante la ingeniería de tejidos, y quizá en un futuro de los órganos bioartificiales. Estos avances científicos se han derivado de la experimentación con cultivos celulares en condiciones de microgravedad, en vuelos espaciales o simulados.
En el presente decenio se han desarrollado equipos que nos permiten avanzar en estos conocimientos. El bio-reactor HARV (High-Aspect Ratio Vessel) diseñado por la NASA y disponible comercialmente (Synthacon Inc., Houston, Texas) es un ejemplo de estos avances5.
Esencialmente células vivas aisladas de tejidos son suspendidas en un medio nutritivo dentro del reactor, (el cual está provisto de un mecanismo para intercambio de gases y nutrientes) y mantenidas a pequeñas velocidades de rotación para obtener un vector neto de cero gravedad. En estas condiciones las células se orientan tridimensionalmente respecto de las demás simulando las relaciones de continuidad que tenían en el tejido de origen.
Un avance adicional de estos descubrimientos es la incorporación en el bio-reactor de soportes para las células a partir de polímeros como el ácido poliglicólico fibroso. Este soporte favorece el adosamiento tridimensional de las células y se degrada en la medida en que el elemento tisular se incrementa6, 7.
El objetivo a largo plazo de los trabajos en este campo está orientado al uso potencial de la microgravedad como un recurso para la formación in vitro de estructuras tisulares fisiológicamente importantes.
Mediante la aplicación de estos sistemas se han obtenido, a partir de células aisladas de órganos de animales, estructuras tisulares in vitro que semejan de alguna manera los tejidos de estos órganos. Corazón, cartílago, músculo esquelético son un ejemplo de estos logros8, 9.
De este último se ha conseguido, mediante la incorporación de sistemas de perfusión continua en los bio-reactores, obtener organoides potencialmente utilizables para reemplazo de órganos o en terapia genética10. Independientemente de los sistemas descritos, se han hecho estudios con explantos de riñón embrionario humano y de animales in vitro para establecer el papel de algunos factores de crecimiento en el desarrollo de este órgano en el embrión11, 12.
El nuevo campo de la ingeniería de tejidos ofrece por lo tanto muchas oportunidades para la aplicación actual en la clínica y de investigación hacia la solución del problema de transplante de órganos.
Los investigadores han intentado el uso de la ingeniería de tejidos para virtualmente todo tipo de éstos, entre otros, células de sistema nervioso en la enfermedad de Parkinson, regeneración de nervio periférico, células epiteliales de córnea precultivadas sobre matrices de hidrogeles de alcohol polivinílico, reemplazo de hígado con hepatocitos, y modificaciones a las técnicas actuales en el transplante de dermis y epidermis para las quemaduras.
Igualmente se han cultivado células tubulares de riñón en copolímeros de vinilo o en membranas porosas de nitrato de celulosa como un paso inicial hacia la creación de un riñón bioartificial13. Este paso no ha sido explorado todavía in vivo.
El número creciente de pacientes que necesitan transplante de órganos y la disponibilidad relativamente menor de donantes ha despertado la preocupación de los científicos para desarrollar alternativas a este limitado recurso. En Estados Unidos se logran apenas cerca de 3,000 donantes de hígado anualmente al tiempo que mueren 30,000 por falla hepática sin probabilidades de transplante. El déficit de riñones para transplante en ese mismo país es de 600,000 por año 13.
En América Latina la prevalencia anual de insuficiencia renal terminal (IRT) es aproximadamente 175 por 1,000,000 de personas. En Colombia la prevalencia anual de IRT es de 5,000 casos de los cuales solamente 300 (6%) tienen oportunidad de transplante.
La experiencia de Cali en transplante renal se inicia en el Hospital Universitario del Valle (HUV) en 1986 y en la clínica Fundación Valle del Lilí (FVLL) en 1995. Hasta la fecha de publicación de este trabajo, se han efectuado 380 transplantes de riñón en Cali en un período de 12 años (x=32/año).
En la FVLL, cerca de 70 pacientes se registran por año como candidatos a transplante de hígado y, por carencia de donantes, solamente a unos 10 (14%) se les puede efectuar el procedimiento. En 1993, de 300 pacientes en lista de espera para transplante renal en el HUV, solo 26 (9%) obtuvieron donante para efectuar el procedimiento14a-c.
La ingeniería de tejidos mediante la cual se han desarrollado cultivos celulares -3D- y organoides, ofrece grandes posibilidades a la investigación biomédica hacia el desarrollo de órganos bio-artificiales in Vitro los cuales serían la mejor alternativa a los transplantes.
Los precursores de los cultivos celulares -3D- y organoides son los cultivos celulares primarios tradicionales -2D- unilaminares, igualmente las suspensiones de células extraídas primariamente de los tejidos. Estos deben por lo tanto ofrecer condiciones óptimas de viabilidad y esterilidad microbiana para que los supuestos órganos bio-artificiales obtenidos de ellos puedan garantizar una alta seguridad al ser introducidos en pacientes para reemplazarles un órgano insuficiente.
La mayor experiencia en nuestros laboratorios ha sido el cultivo primario -2D- de células tubulares de riñón, obtenidas de tejido neonatal postmortem. Inicialmente nuestro interés en estos cultivos fue el disponer de un medio para estudios de virus dada la alta susceptibilidad de estas células in vitro a estos agentes15, 16.
Sin embargo, la importancia de este tipo de cultivos celulares se extiende a otros campos de la investigación biomédica, que van desde la obtención de cultivos celulares -3D- y organoides para avanzar en la investigación de los factores relacionados con la Šrgano génesis in vitro, hasta la creación de un riñón bioartificial13.
En un estudio previo en nuestro laboratorio, pudimos establecer que aproximadamente el 60% de las células extraídas de tejido renal neonatal postmortem son viables. También, que el número de casos con esta viabilidad es considerablemente superior en mortinatos de menos de 2,500 g. que en los de más de 2,500 g. Una situación similar se observó en la eclampsia -incluyendo pre-eclampsia en este término-4, 17,18.
En el presente estudio llevado a cabo en el HUV y el laboratorio de IN VITRO, Departamento de Microbiología de la Universidad del Valle en Cali, Colombia se pretende:
Confirmar y comparar las observaciones de antecedentes perinatales y viabilidad celular del estudio anterior con un período posterior.
Investigar las variables perinatales que puedan influir en la VCRP en busca de mejorar la selección de los mortinatos y neonatos postmortem para incrementar las probabilidades de obtener células viables para el almacenamiento en bancos de células.
Examinar el estado microbiológico de los cultivos celulares obtenidos.
Discutir la posibilidad de adelantar estudios con células viables renales postmortem, en el campo de los cultivos celulares -3D- y organoides.
Material y Métodos
Datos clínicos. Se incluyeron en el estudio neonatos de < 3 días de edad que murieron en la sala de Cuidado Intensivo del Recién Nacido (CIRENA) y mortinatos de la sala de partos del Hospital Universitario del Valle (HUV) durante un período de un año comprendido entre Enero 1 y Diciembre 31 de 1995. Se recolectó la información clínica perinatal (materna y neonatal) correspondiente previa autorización informada.
Cuando se presentó más de un diagnóstico en la historia clínica de la madre y/o del neonato postmortem, se tomó el primero dado para cada uno.
obtención y proceso de muestras post-mortem. Se obtuvieron muestras de sangre y de tejido renal del neonato dentro de las primeras 3 horas post mortem y de los mortinatos dentro de las primeras 3 horas post partum, mediante técnica aséptica en la morgue del HUV, previa autorización informada.
No se utilizaron casos que presentaron mala apariencia macroscópica del tejido. La sangre se obtuvo mediante punción cardiaca usando jeringa de plástico estéril desechable con aguja calibre 21.
La obtención del tejido renal se efectuó siguiendo la misma técnica descrita anteriormente, lo mismo que para la extracción enzimática de las células renales en el laboratorio mediante el uso de colagenasa 4 . Esta técnica no se modificó, con el fin de eliminar variables que pudieran desvirtuar la confiabilidad en la comparación de la viabilidad celular en los dos estudios llevados a cabo en períodos distintos de tiempo.
Al contar las células extraídas por el método de exclusión de azul tripan se definió “caso con células viables o viabilidad celular renal postmortem (VCRP)” aquel donde la viabilidad celular o número de células viables identificadas al microscopio fue > 50%.
Las suspensiones de células con viabilidad adecuada fueron envasadas en concentraciones estándar en ampolletas de vidrio selladas al calor, congeladas a temperatura gradualmente descendiente y almacenadas en termo de nitrógeno líquido (-190°C), por tiempo indefinido, para llevar a cabo estudios ulteriores y establecer la disminución en viabilidad con el proceso inicial de congelación.
Una pequeña porción de la suspensión de células antes de la congelación fue sembrada a una concentración de 60,000 células por cm 2 en una botella de poliestireno en medio Mínimo Esencial con sales de Hank (HMEM) suplementado con suero fetal bovino (SFB) 10% y L-glutamina 1%, con el fin de observar el crecimiento de la población de células y el tiempo de confluencia de la lámina celular.
Muestras de células de 40 de los 86 casos viables (46%) fueron enviadas a un laboratorio de referencia (BioWhittaker, Inc. Walkersville, Maryland) para análisis de comparación con nuestros resultados de viabilidad y crecimiento celular y para identificación de cariotipo.
Estudios microbiológicos. Una pequeña porción de la sangre obtenida por punción cardiaca se usó inmediatamente para hemocultivo y estudio de hemoparásitos en gota gruesa. La porción restante de la sangre se centrifugó a 2,000 rpm y el suero obtenido se guardó almacenando en crioviales a -20°C para estudios serológicos posteriores, habiendo utilizado previamente una pequeña porción para “screening” de sífilis.
El hemocultivo lo mismo que el cultivo para bacterias de las suspensiones de células y del fluido intra tisular (resultante de la sección del tejido post-mortem previa a la extracción enzimática de las células) se hicieron por inoculación en 3 medios de cultivo diferentes siguiendo la técnica descrita anteriormente 4: Tioglicolato de sodio, tripticasa soya e infusión cerebro corazón (BHI).
Se incubaron por 15 días a 37°C. Luego se hicieron repiques de estos medios en agar sangre de cordero y en agar chocolate con isovitalex. Se consideraron negativas las muestras que a las 48 horas de incubación en el cultivo no mostraban crecimiento bacteriano.
Se definió como caso con sepsis aquel con cultivo positivo para > 1 bacteria(s) significativamente patógena(s) en más de una de las muestras analizadas. Las pruebas serológicas incluyeron además de “rapid plasma reagin” (RPR) para sífilis, pruebas de “Enzyme Linked Immunosorbent Assay” (ELISA) para virus de la inmunodeficiencia humana HIV -ABBOTT HIVAB TM HIV-1 EIA, No. 3A11. 66-8805/R5, ABBOTT HIVAG-1 66-6637/R6-, virus linfotrópico humano HTLV- 1 -ABBOTT HTLV.I 2.0 EIA No. 9A20. 66-2334/R2-, y Hepatitis B -ABBOTT AUSZYME ¨ MONOCLONAL 66- 6634/R8-.
Para detección de arbovirus se hizo co-cultivo de células renales con células BHK-21, línea celular proveniente de riñón de “hámster”, las cuales son altamente susceptibles a la infección por virus transmitidos por artrópodos19.
Análisis estadístico. Para realizar el análisis estadístico se definió proporción de viabilidad como el cociente de dividir el número de casos viables entre el total de necropsias realizadas. Como medida de fuerza de asociación se utilizó la razón de proporciones (RP) con intervalos de confianza (IC) de 95%, descrito en el paquete estadístico EPI INFO versión 6.03 (Statcal).
Como prueba de significancia estadística se aplicó el Chi 2 de Manthel Haenszel. En los casos con menos de cinco observaciones, se ajustó el valor de x 2 con la prueba exacta de Fisher.
Resultados
Entre enero 1 y diciembre 31 de 1995 se registraron 1,458 admisiones de neonatos de < 3 días de edad a la sala de CIRENA del HUV; de estos, 208 (14.3%) murieron. En el mismo período se registraron 8,568 partos (la mayoría de alto riesgo) en el servicio de obstetricia de la misma institución; 395 (4.6%) de estos fueron mortinatos.
Ciento once (53%) de los 208 neonatos que murieron en la sala de CIRENA y 22 (5.6%) de los 395 mortinatos de la sala de partos, para un total de 133 casos, fueron estudiados en el laboratorio de IN VITRO para VCRP y estatus microbiológico. De los 133 casos, 115 (86%) fueron de bajo peso al nacer (BPN), i.e. 500 a 2,500 g. y los 18 (14%) restantes fueron de peso adecuado al nacer (PAN), i.e. mayor de 2,500 g.
La mayoría de los casos tenían más de un diagnóstico registrado. De los 13 diagnósticos registrados como primarios, los seis más frecuentes fueron ruptura prematura de membranas (RPM) – 20%, preeclampsia / eclampsia (PE) – 13%, corioamnionitis (CA) – 11%, infección urinaria (IU) – 11%, placenta previa (PP) – 9% y vaginitis (V) – 8% (Tabla 1).
TABLA 1. Viabilidad Celular Renal Postmortem (VCRP) vs Antecedente Perinatal Materno y Peso al Nacer en Neonatos < 3 días de Edad y Mortinatos. Hospital Universitario del Valle, Cali, Colombia, Enero 1 – Diciembre 31, 1995
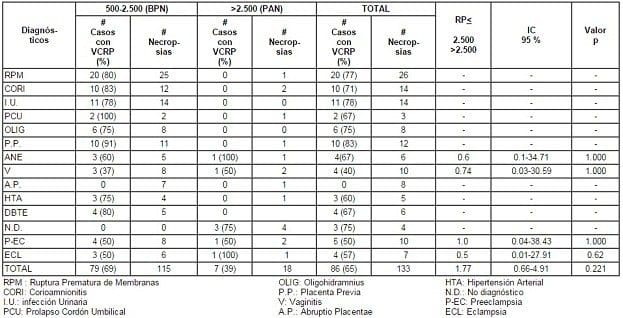
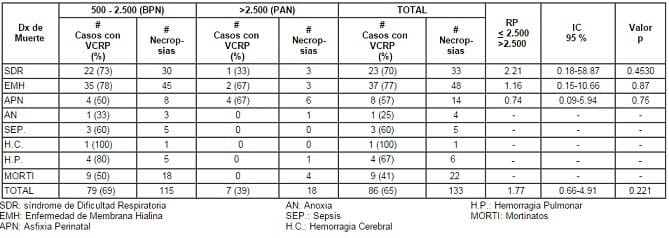
El diagnóstico primario de muerte neonatal registrado con mayor frecuencia fue el síndrome de dificultad respiratoria (SDR) y la enfermedad de membrana hialina (EMH) – 73%. La asfixia perinatal (AP) ocupó el tercer lugar con 14 casos (13%). Veintidós (17%) de los 133 casos estudiados fueron mortinatos (Tabla 2)
La VCRP total en los 133 casos estudiados fue de 65%, siendo esta mucho mayor en casos con BPN (69%) que en aquellos con PAN (39%). El mayor porcentaje de casos con células viables se observó en aquellos con diagnóstico materno de PP (83%), mientras que no se obtuvo ninguno en los casos con diagnóstico de abruptio placentae (AP).
Una menor proporción de casos con células viables se observó en aquellos con diagnóstico materno de PE (50-57%) y V (40%). Al analizar la VCRP según los diagnósticos de muerte de los neonatos, el mayor número de casos con células viables se presentó en aquellos con SDR y EMH (70% y 77%) y el menor en los casos con diagnóstico de anoxia (25%).
De los 22 mortinatos estudiados 18 (86%) fueron de BPN; de estos, 9 (50%) presentaron células viables. Ninguno de los 4 mortinatos con PAN tuvo viabilidad celular. Aunque hay consistencias con el estudio previo, este trabajo no pudo demostrar significancia estadística en las diferencias encontradas (Tablas 1 y 2 ).
TABLA 2. Viabilidad Celular Renal Postmortem (VCRP) vs Peso al Nacer y diagnóstico de Muerte en Neonatos < 3 días de Edad y Mortinatos. Hospital Universitario del Valle, Cali, Colombia. Enero 1 – Diciembre 31, 1995
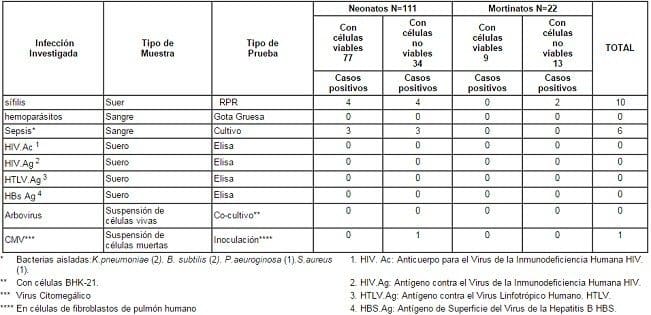
 En los estudios microbiológicos, se obtuvieron 6 casos (4.5%) con cultivos bacteriológicos positivos (Klebsiella pneumoniae-2, Bacillus subtilis 2, Pseudomona aeuroginosa-1, Staphylococcus aureus-1) compatibles con el diagnóstico de sepsis neonatorum. La mitad de estos casos no presentaron viabilidad celular.
En los estudios microbiológicos, se obtuvieron 6 casos (4.5%) con cultivos bacteriológicos positivos (Klebsiella pneumoniae-2, Bacillus subtilis 2, Pseudomona aeuroginosa-1, Staphylococcus aureus-1) compatibles con el diagnóstico de sepsis neonatorum. La mitad de estos casos no presentaron viabilidad celular.
Pruebas de tamizaje inicial (“screening”) con Çrapid plasma reaginÈ (RPR) detectaron 10 (7.5%) muestras positivas que plantean la posible presencia de anticuerpos (probablemente de origen materno) relacionados a sífilis en esta población al momento del parto. Seis (60%) de estos casos no tuvieron viabilidad celular; de estos, 2 eran mortinatos.
Se aisló un solo caso (0.8%) de citomegalovirus de un neonato postmortem. Este caso no tuvo viabilidad en el cultivo de células renales. No se detectó sero-reactividad para el virus de inmunodeficiencia humana (VIH) ni de hepatitis B. Tampoco se diagnosticaron hemoparásitos (Tabla 3).
TABLA 3. Estudios microbiológicos Post mortem de 111 Neonatos de < 3 días de edad y 22 Mortinatos. Hospital Universitario del Valle, Cali, Colombia. Enero 1 – Diciembre 31, 1995
El proceso de congelación en nitrógeno líquido (-190°C) y/o descongelación determinó unadisminución de un 20% en la viabilidad celular. Con muy pocas excepciones, toda siembra de suspensiones de células con ³ 50% de viabilidad produjo una confluencia total de la lámina celular entre 4 y 7 días después de la siembra. Las figuras 1, 2 y 3 muestran el proceso de crecimiento de las células tubulares de riñón neonatal que formaron confluencia total en 5 a 6 días.
Microfotografías a 10x del proceso de formación de una lámina -2D- de células obtenidas de una muestra de tejido de riñón neonatal postmortem.

Figura 1. 24 horas de la siembra, la flecha indica el crecimiento en una zona pequeña (1%) de la superficie.

Figura 2. 48 horas. Confluencia 75%.

Figura 3. 72 horas. Confluencia 100%.
Treinta y ocho (95%) de los 40 casos enviados al laboratorio de referencia mostraron concordancia de viabilidad y crecimiento celular, esto último determinado por un tiempo de confluencia celular total de 3 a 7 días. Ninguna de las muestras representativas de células de los 40 casos enviados para determinación de cariotipo mostró ningún tipo de trisomía20.
Discusión
La utilización de cultivos celulares tiene cada vez mayor importancia en tipos muy diversos de las investigaciones biomédicas, incluyendo aquellas relacionadas con la creación de órganos bio-artificiales para trasplante.
El presente estudio es consistente con trabajos previos, y estos inician una base que nos ayuda a determinar pautas para mejorar la selección de casos en la obtención y almacenamiento de células viables de alta calidad a partir de tejido renal neonatal postmortem. Estos podrían extenderse a otros como el tejido hepático, páncreas, óseo y muscular. El incremento en la viabilidad traería también reducciones en los altos costos de procesamiento.
Encontramos que la VCRP total (65%) fue similar al trabajo anterior (60%), siendo ésta mucho mayor en los que presentaron BPN (69%) que en aquellos con PAN (39%). La misma tendencia se observó con mortinatos de BPN en comparación con los de PAN. En dicho estudio estas diferencias fueron estadísticamente significantes (pió.00018 y p=0.0000053 respectivamente)4 .
Observamos las mayores probabilidades de obtener células viables en los casos con diagnóstico de SDR, EMH y mortinatos de BPN (la mayoría entre 500-1500 g. de peso al nacer) o los nacidos de madres con antecedentes perinatal de PP, IU, o RPM. Sin embargo en este trabajo no se logró demostrar significancia estadística debido muy posiblemente al bajo número de casos.
En el estudio anterior se observó una diferencia estadísticamente significante (p=0.0013) en la VCRP de los casos con eclampsia, incluyendo pre-eclampsia en este término17,18, entre BPN y PAN. Sin embargo en este estudio, la VCRP en los mismos casos se mostró relativamente baja y no se pudo establecer diferencia estadísticamente significante.
Los resultados de casos RPR positivos ameritan investigar más a fondo la prevalencia y estadios reales de sífilis en la población perinatal del HUV con pruebas más especificas como VDRL y FTA-ABS. Aunque no se detectó sero-reactividad para el virus de inmunodeficiencia humana (VIH) ni de hepatitis B, muy posiblemente por el bajo número de casos, sería prudente continuar con estas pruebas de detección de enfermedades de transmisión sexual en esta población, no solamente por su importancia en el aspecto clínico, sino epidemiológico.
Debe resaltarse además la importancia de las pruebas de laboratorio en los cultivos celulares para determinar la viabilidad de las células obtenidas por los procedimientos descritos y la vigorosidad de su crecimiento in vitro, lo mismo que las pruebas de esterilidad microbiológica y el estudio de cariotipo, en busca de una calidad cada vez mejor.
Aunque en algunos casos las células con bacterias pueden ser viables cuando la contaminación se controla in vitro con antibióticos, estas se deben excluir especialmente cuando se requieran para uso terapéutico.
La buena viabilidad y apariencia, ausencia de granulaciones y/o irregularidades en forma y tamaño, normalidad en el cariotipo, esterilidad microbiana, ausencia de virus, y confluencia adecuada de la lámina celular, deben ser condiciones ideales requeridas para la utilización de células de origen humano en aplicaciones terapéuticas.
La discordancia de un 5% en la viabilidad y crecimiento celular entre nuestros resultados y los obtenidos en el laboratorio de referencia está siendo evaluada actualmente en ambos laboratorios.
Este estudio, al igual que anteriores, sugiere una mayor VCRP en aquellos casos con diagnósticos que pudieran asociarse con una menor madurez fetal, como BPN, EMH/SDR, PP, y PE. Se podría anticipar que a menor madurez fetal, mayor posibilidad de encontrar tejidos que den una mejor viabilidad celular.
La inmadurez del tejido puede determinar la presencia en éste de una proporción importante de células precursoras, por ejemplo, de túbulos renales. Esto podría ser de gran importancia en las perspectivas de la creación de organoides o estructuras fisiológicamente importantes, como en el caso de la bioingeniería de tejidos que busca el riñón bio-artificial. Estudios continúan en curso desarrollando este campo.
Agradecimientos
Al Doctor Héctor Montes, Jefe de la Sala de Cuidado Intensivo de Recién Nacidos y su grupo de médicos pediatras; al personal de enfermería, trabajo social y administrativo y de manera especial a las directivas de la Fundación CIRENA, les expresamos nuestros agradecimientos por la generosa colaboración que nos han brindado para la realización de nuestros estudios. Así mismo reconocemos el interés del departamento de Gineco-obstetricia representado por la Doctora Carmenza Romero de Escobar, ex jefe de Obstetricia y a todo su personal médico y paramédico.
Bibliografía
1. Harrison RG. Observations on the living developing nerve fiber. Proc Soc Exp Biol Med. 1907; 4: 140-43.
2. Carrel A. On the permanent life of tissue outside the organism. J Exp Med. 1912; 15: 516-28.
3. Hsu TC. Cells in culture in biology, medicine and public health. In the future of animals, cells, models, and systems, in research development, education and testing. Proceedings of a Symposium. Institute of Laboratory Animal Resources, Division of Biological Sciences Assembly of Life Sciences. Washington, National Academy of Sciences, 1977, p.p. 180-84.
4. Dueñas A., Criollo WD, Bernal de Miranda A.J, Piamba J.E. Enfermedad perinatal y viabilidad celular renal postmortem in vitro en el Hospital Universitario del Valle. Cali. Col Méd 1996; 3,4; 110 -16.
5. Akins RE, Schored NA., Gonda SR., Hartzell CR. Neonatal rat heart cells cultured in simulated microgravity. In Vitro Cell Dev Biol – Animal. 1997; 33: 337-343.
6. Freed LE, Vunjak – Novakovic G, Biron R.J et. Al. Biodegradable scaffolds for tissue engineering. Bio /Technology 1994; 12: 689-693.
7. Freed LE, Vunjak – Novakovic G, Langer R. Cultivation of cell-polymer cartilage implants in bioreactors. J Cell Biochem. 1993; 51: 257-264.
8. Freed LE, Vunjak – Novakovic G. Microgravity tissue engineering. In Vitro Cell Dev Biol – Animal. 1997; 33: 381-85.
9. Molinar G, Schroedl NA., Gonda SR., Hartzell CR.. Skeletal Muscle satellite cells cultured in simulated microgravity. In Vitro Cell Dev Biol – Animal. 1997; 33: 386-391.
10. Chromiac JA., Shansky J, Perrone C, Vandemburgh HH. Bioreactor perfusion system for the long-term maintenance of tissue engineered skeletal muscle organoids. In Vitro Cel Dev Biol – Animal. 1998; 34: 694-703.
11. Matsell DG, Bennet T. Evaluation of metanephric maturation in a human fetal kidney explant model. In Vitro Cell Dev Biol Ð Animal. 1998, 34: 138-148.
12. Sweeney Jr WE, Avner ED. The role of hepatocyte growth factor (HGF) at progressive stages of metanephric development. In Vitro Cell Dev Biol – Animal. 1998; 34: 189-194.
13. Langer R., Vacanti JP. Tissue engineering. Science, 1993; 260: 920-926.
14a. Cuero C, Ríos MC, Otero LM, Londoño E, Escobar E, Morales J, Mercado A. Cuatro años de transplante renal en el Hospital Universitario del Valle, Cali, Colombia. Col Méd. 1991; 22(1): 2 – 7.
14b. Corporación de Transplantes de Órganos y Tejidos de Cali. Registros, 1999.
14c. Caicedo L.A. investigación en curso. Comunicación personal. Unidad de Transplantes, Fundación Valle del Lili, Cali, Colombia, 1999.
15. Enders JF, Weller TH, Robbins FC. Cultivation of the Lansing strain of poliomyeliis virus in cultures of various human embryonic tissues. Science 1949; 109:85-7.
16. Ramos-Alvarez M, Mayer O, Bustamante L, Martin S. Cultivation of postmortem human kidney tissue and its suceptibility to enteroviruses. Bol Med Hosp Infant Mex (Engl ed) 1960; 1: 165 – 69.
17. Cifuentes R.. Comentarios al artinculo de la referencia No.4. 1997, Archivo departamento de Ginecología y Obstetricia, H.U.V.
18. Dueñas A. Respuesta a comentarios en referencia No.17, 1997. Archivo IN-VITRO, Departamento de Microbiología, U.V.
19. Karabatsos N, Buckley SM. Suceptibility of the baby-hamster kidney cell line (BHK-21) to infection with arboviruses. Am J Trop Med Hyg. 1967; 16: 99-105.
20. BioWhiittaker, Walkersville, Maryland, 1998.
