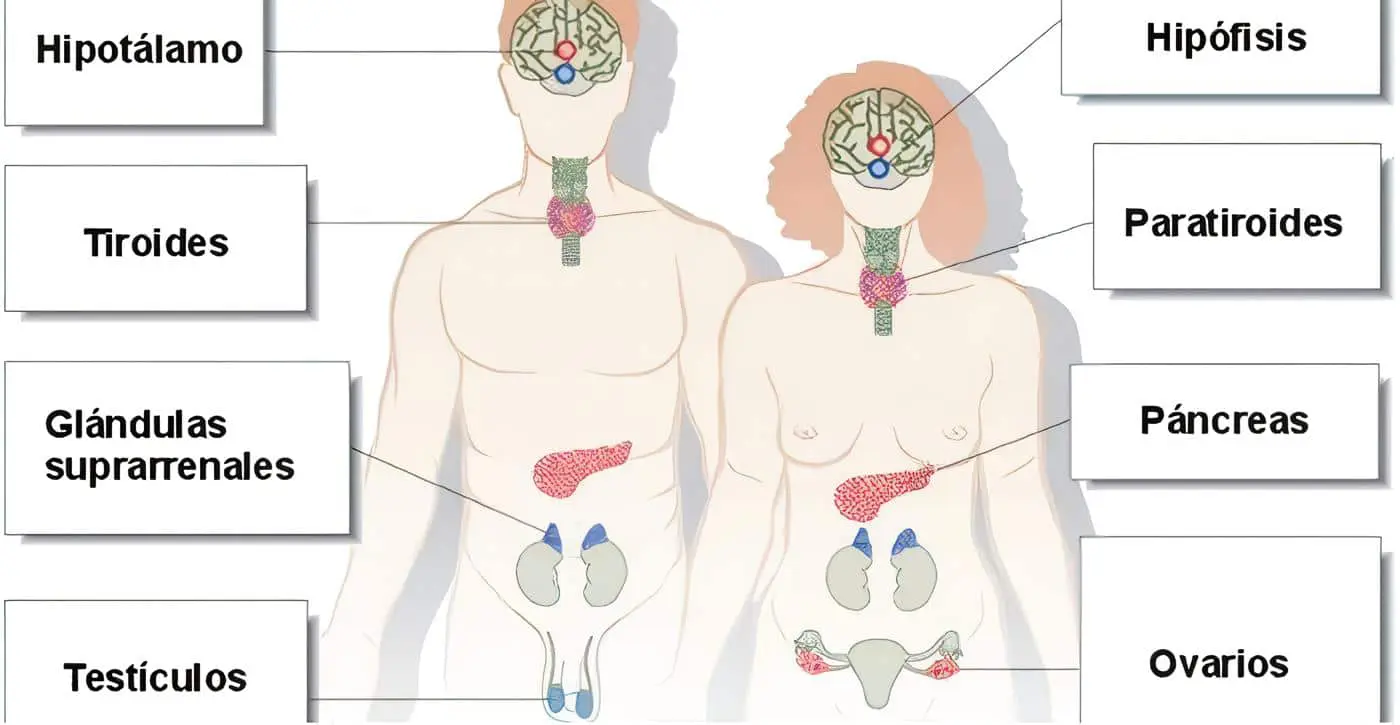
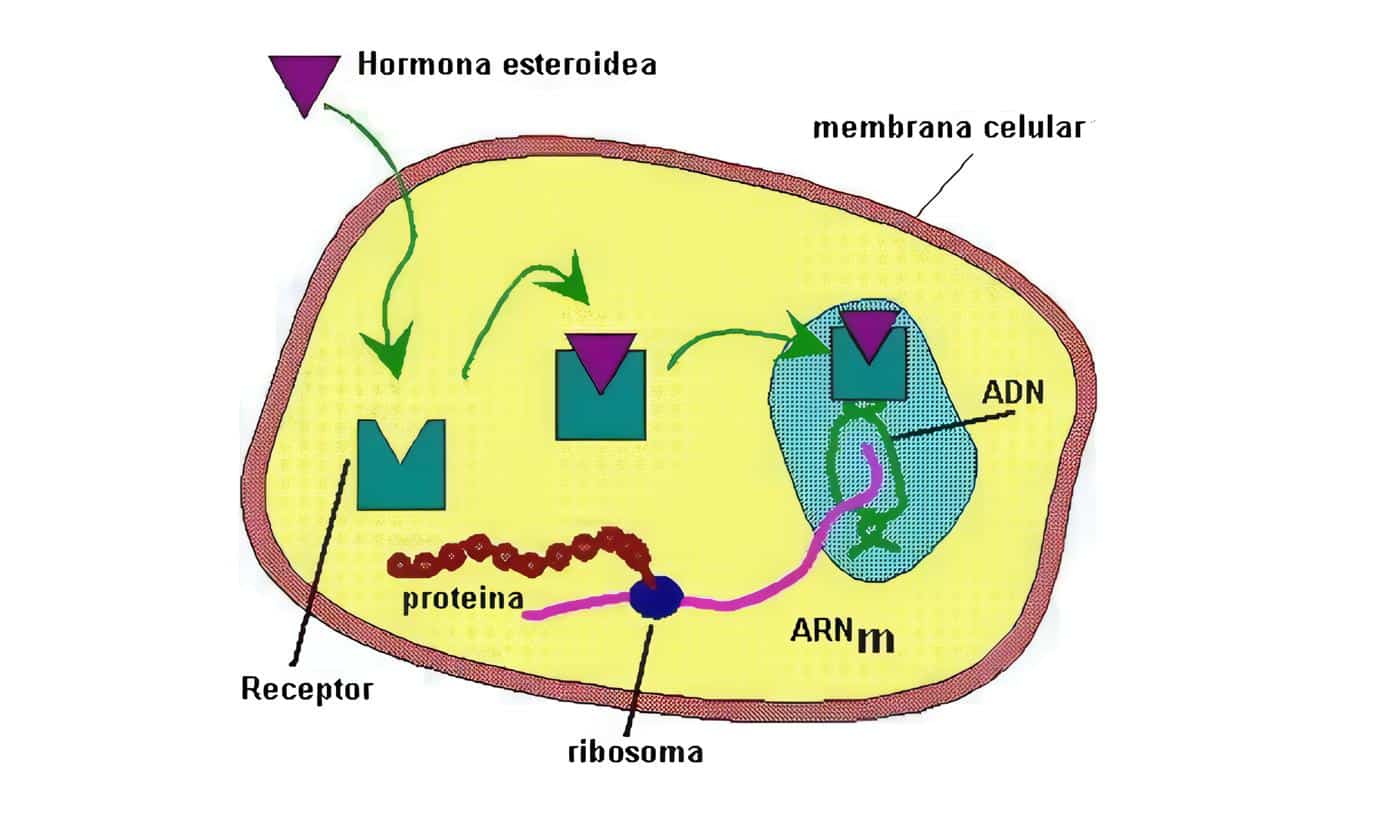
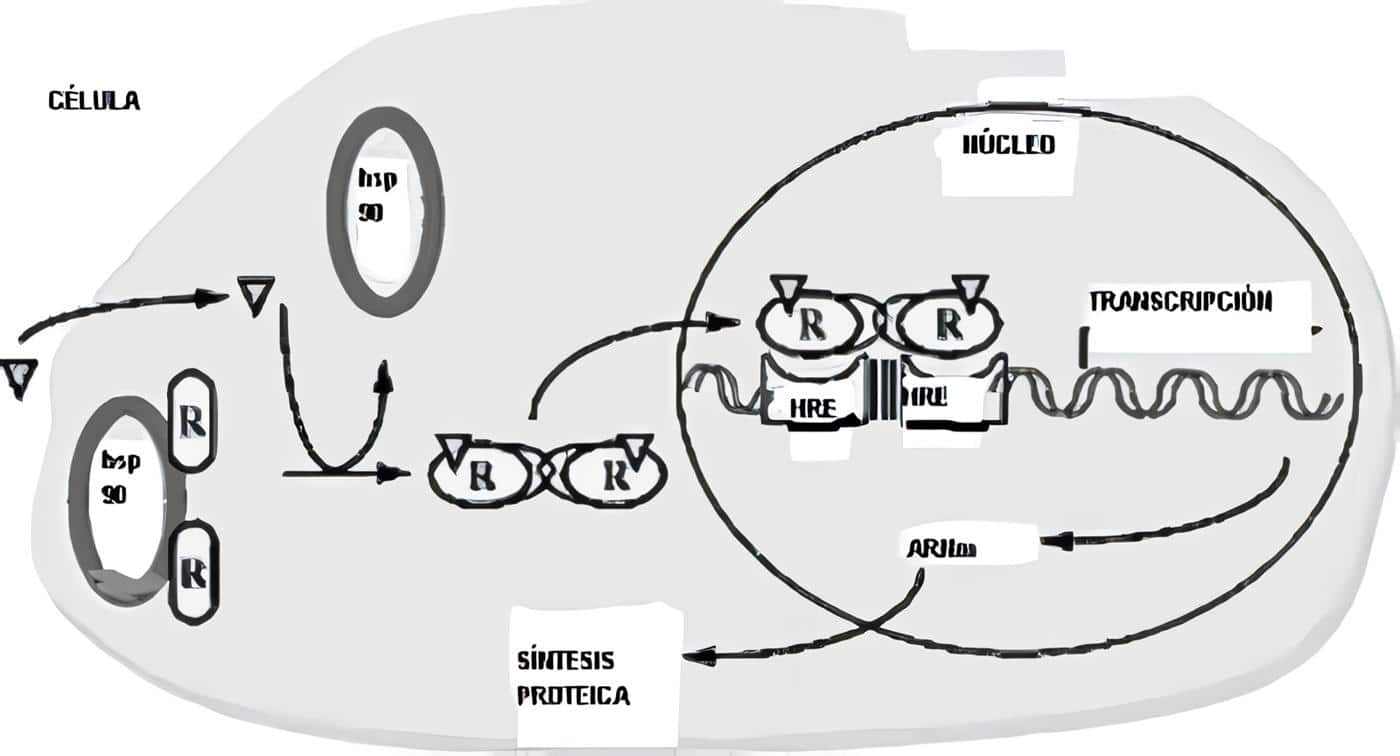
Con frecuencia el hipotálamo y la hipófisis se estudian juntos, merced a su estrecha relación.
En aras del equilibrio entre los capítulos de este libro, hemos resuelto discutir el tema de la pituitaria anterior por aparte, limitándonos acá a las neurohormonas como tal.
Cada hormona adeno-hipofisiaria tiene su correspondiente hormona hipofisiotropa liberadora y/o inhibidora en el hipotálamo; cada una de las hormonas hipofisiotropas está codificada por su correspondiente gen, pero este se expresa en más de un tejido, y el comportamiento de la hormona producida en tejidos extrahipotalámicos puede ser diferente. Aunque esto se refiere a tejidos sanos, explica en parte la situación de la producción hormonal paraneoplásica
Tanto las hormonas tróficas como otras de estructura proteica tienen presentaciones comerciales (obtenidas por medio de tecnología de DNA recombinante), pues tienen utilidad terapéutica o diagnóstica. Los ejes clásicos hipotálamo-hipófisis-glándula periférica son los de las suprarrenales, la tiroides y las gonadas.
La corticorrelina o CRH regula la producción de ACTH, que a su vez controla la producción de glucocorticoides y andrógenos de la corteza suprarrenal, pero tiene poca influencia sobre los mineralocorticoides; la tirorrelina o TRH estimula la producción de TSH, la que a su vez lo hace sobre la T4 y la T3. Una sola hormona trófica –la gonadorrelina, GnRH o LH-RH, regula las dos gonadotrofinas –FSH y LH- en ambos sexos.
La hormona del crecimiento se libera por acción de la somatorrelina o GHRH – y luego a través del IGF-1 (antes denominada muy lógicamente “somatomedina”) actúa en los tejidos blanco; su liberación es frenada por la somatostatina o GHR-IH, mientras que la dopamina o PIH, inhibe la liberación de prolactina; estas hormonas son somatomamotropas, al igual que la somatomamotrofina coriónica (que nuevamente fue llamado inicialmente con lógica, el “lactógeno placentario”).
La MSH -estrechamente ligada al ACTH-
La MSH -estrechamente ligada al ACTH- (está incluida en sus primeros 13 aminoácidos), hace parte de esta manera con esta y con una lipotropina y una endorfina, en la molécula de la pro-opio-melanocortina (POMC) o prohormona precursora de todos estos péptidos, tiene una menor importancia en el hombre que en animales inferiores, particularmente en aquellos capaces de mimetizarse o cambiar de colores, como el camaleón; en situaciones clínicas donde el ACTH está elevada (Enfermedad de Addison, Síndrome de Nelson), se observa pigmentación.
Otras neurohormonas de carácter independiente, generadas en el hipotálamo pero depositadas en la pituitaria posterior, son la vasopresina u HAD y la ocitocina, llamada también “hormona eyecto-làctea”. Finalmente, la melatonina se genera en la epífisis. Las hormonas hipofisiotropas se producen en neuronas parvocelulares cuyo núcleo se localiza en el tuber cinereum del hipotálamo, en sitios como el núcleo arqueado y el paraventricular medial.
Los axones de estas neuronas terminan en la eminencia media del hipotálamo, donde se liberan los péptidos hipofisiotropos que son llevados a la pituitaria anterior por medio del sistema porta hipofisiario.
Por otro lado las hormonas de la pituitaria posterior son producidas en neuronas magnocelulares que comienzan en el núcleo paraventricular lateral y supraóptico, y viajan a través de los axones para depositarse en la neuro-hipófisis, que –más que un órgano- es una extensión del hipotálamo.
Córtico-relina
La hormona liberadora del ACTH es conocida por la sigla CRH (de “corticotropin-releasing hormone”) y su secreción está regulada por un un mecanismo de retroalimentación negativo determinado por los niveles de cortisol plasmático libre, pero también por transeúntes neurales de asa abierta, de naturaleza circadiana, situaciones de estrés (mediante mecanismos adrenérgicos), etc.
A través del tronco (vías ascendentes) se producen estímulos adrenérgicos sobre el núcleo paraventricular (donde se produce la CRH) durante el estrés, lo que requiere producción de cortisol, (y otras hormonas contra-reguladoras de la insulina). La CRH induce la producción de pro-opio-melanocortina (POMC), prohormona de molécula grande, que da lugar al ACTH y a la betalipotrofina (que a su vez se divide en gamma-lipotrofina y el opioide beta-endorfina).
De allí la acción inhibidora de CRH por opiodes tipo morfina, inhibición que también es dada por la angiotensina, el neuropéptido Y, la interleucina-1 (interrelación del sistema inmune, estrés y liberación de CRH). La arginina-vasopresina tiene acción tipo CRH pues es liberadora de ACTH en condiciones experimentales. La córticorrelina tiene 41 aminoácidos codificados por un gen del brazo largo del cromosoma 8.
Tiro-relina
La TRH (“Thyrotropin- releasing hormone), libera la TSH. La concentración plasmática de hormona tiroidea libre inhibe más la TSH que la TRH en la retroalimentación negativa.
Es un tripéptido (ácido piroglutàmico, histina y prolinamida) cuya administración endovenosa de TRH incrementa los niveles plasmáticos tanto de TSH como de prolactina, situación que también opera en situaciones clínicas de aumento de la tirotrofina, como en el hipotiroidismo primario, en el que no sólo hay hiperprolactinemia en un porcentaje importante de casos, sino incluso galactorrea.
Como la TRH hipotalàmica no se afecta por la concentración plasmática de glucosa, y la producida en el páncreas sí, esto indica que probablemente la función de esta hormona en el otro tejido es diferente. La somatostatina por otro lado inhibe la secreción de la TSH.
Gonado-relina
La GnRH (Gonadotropin- releasing hormone) libera las gonadotrofinas FSH y LH, producidas en la pituitaria anterior. Los somas de sus neuronas se encuentran diseminados en el hipotálamo, principalmente en el núcleo arcuado pero también en el área preóptica y en el núcleo paraventricular posterior; sus axones terminan en la eminencia media y bajan por el tracto túbero-infundibular.
Se trata de un decapéptido cuya molécula precursora –la pre-pro-GnRH- que es una proteína de 92 aminoácidos, 56 de los cuales constituyen el péptido asociado (con la GnRH), que tiene una acción inhibidora de prolactina mientras que el decapéptido liberador de FSH y LH lo es también de la prolactina.
Otros 23 aminoácidos iniciales sirven de señal, dentro de los cuales 3 (Gli-Lis-Arg) son necesarios para el procesamiento de la molécula. Esta es de vida corta (alrededor de tres minutos) y es muy baja su concentración en la circulación general; se modula su liberación por estímulos nor-adrenérgicos y se inhibe por retroalimentación de las gonadotrofinas, dopamina y péptidos opioides tipo endorfinas y encefalinas.
La gonadorrelina
La gonadorrelina tiene receptores de membrana en los gonadotrofos, que se internalizan una vez forman un complejo hormona-receptor y después de degradarse dicho complejo, regresan a la superficie celular por un mecanismo de regulación hacia arriba, lo que permite que la GnRH -que en su fase inicial sólo libera gonadotrofinas previamente almacenadas- pueda continuar liberándolas con cantidades menores, lo que permite la liberación en pico de la LH.
Durante la primera mitad del ciclo menstrual, la gonadorrelina se libera en pulsos que duran unos pocos minutos y se hacen cada hora y media; en la segunda mitad del ciclo estos pulsos se dan cada tres a cuatro horas.
Por este mecanismo, la gonadorrelina administrada por medio de una bomba de infusión se ha utilizado en tratamientos de fertilidad para inducir la ovulación, mientras que sus análogos de larga acción por el contrario bloquean las gonadotrofinas, siendo de utilidad en el manejo de entidades como el cáncer de próstata, la pubertad precoz y la endometriosis.
Merced a las conexiones del núcleo arcuado con el sistema límbico, las funciones ovulatoria y menstrual se encuentran afectadas por mùltiples factores psíquicos.
Somato-relina
Es la GH-RH (Growth hormone-releasing hormone), producida en el núcleo periventricular del hipotálamo, con axones que finalizan en la eminencia media del tuber cinereum. Actúa en la hipófisis a través del segundo mensajero AMPc, pero en los mayores de 40 años, la respuesta es casi nula.
Recientemente se ha descubierto un ligando que estimula la secreción de hormona del crecimiento a través de un receptor huérfano, no del receptor usual de la GHRH hipotalámica. Esta molécular se produce en el estómago y se ha denominado Ghrelina; su hallazgo muestra nuevos caminos en los mecanismos de secreción de hormona del crecimiento.
Somatostatina
Es un polipéptido de 14 aminoácidos, sintetizado por Guillemin. El origen de las neuronas productoras está entre los núcleos peri y paraventricular, y su acción es inhibitoria potente sobre la producción de hormona del crecimiento y algo sobre la TSH.
Además se segrega en otros tejidos (aparato digestivo, páncreas –donde inhibe insulina y glucagón-, gastrina, pepsina y el jugo gástrico en general, por lo que el preparado sintético (u ocreótido) se indica en diferentes patologías, como el gastrinoma.
Dopamina
Es una monoamina que actúa como neurotransmisor, como catecolamínico precursor de la nor-epinefrina y como hormona inhibidora de la secreción de prolactina (PIH) y también de GnRH.
El concepto de los ligandos a los receptores huérfanos ha dado lugar al descubrimiento de nuevos neuro-péptidos como la nociceptina, la orfanina FQ, la orexina y el péptido liberador de la prolactina.
Este último interactúa con un receptor huérfano localizado en la adeno-hipófisis y –además de liberar prolactina- es mediador de la respuesta de estrés, a través de la liberación de CRH y por consiguiente de ACTH.
(Lea También: Funciones no Hormonales del Hipotálamo)
Vasopresina
Neuronas magno celulares de los núcleos supraóptico y paraventricular segregan tanto vasopresina como ocitocina, las que por estímulos colinérgicos se sintetizan al tiempo con las neurofisinas I y II –sus proteínas transportadoras- y viajan en forma quántica (empaquetadas en pequeñas vesículas) para depositarse en la hipófisis posterior que tiene el 20% del volumen pituitario o unos 120 mg.
La vasopresina –también llamada hormona antidiurética- se libera en esas neuronas osmorreceptoras, que tienen umbral mucho más bajo (osmolalidad por encima de 280) que las neuronas osmorreceptoras del centro de la sed. Estas células nerviosas son primordialmente sensibles a estímulos osmóticos como la deshidratación o el aumento en la concentración de solutos, lo que eleva la osmolalidad plasmática (que fluctúa en un estrecho margen entre 280 y 296 mmol/Kg )
La vasopresina es un nona péptido de 1084 daltons, que posee un anillo formado por cinco aminoácidos cerrados por puentes disulfídicos de dos cisteínas (que tienen el papel antidiurético), y una cola de tres aminoácidos que en unos casos es arginina o AVP (en la mayoría de los mamíferos) y otros lisina.
La diuresis es máxima cuando la concentración de AVP es de < 1 pmol/L y mínima, con 5 pmol/L, cuando se empiezan a estimular los osmorreceptores de la sed.
 Figura. 1 Acuaporinas, canales de membrana del túbulo contorneado distal donde actúa la hormona antidiurética.
Figura. 1 Acuaporinas, canales de membrana del túbulo contorneado distal donde actúa la hormona antidiurética.
Los estímulos no osmóticos (que actúan como factores menores en la liberación de la AVP) son la hipovolemia y la hipotensión; si se reduce el volumen plasmático en 10% se aumenta la liberación de AVP en una respuesta curvilínea, estando localizados en la aurícula izquierda y las grandes venas los barorreceptores de la hipotensión; si la disminución de la tensión arterial es del 40%, los niveles de AVP alcanzan los 100 pmol/L.
También aumentan la secreción situaciones como la emesis, la hipoglicemia, la angiotensina II, el dolor intenso, el estrés o las emociones.
La acetilcolina, la nicotina, los barbitúricos, la morfina, mediante un mecanismo colinérgico- hacen (al igual que otros mediadores de la liberación de la AVP) que la hormona antidiurética deje el soma neuronal y viaje por los axones, donde bien se deposita unida a proteínas en el lóbulo posterior o se libera a la circulación para actuar en los órganos blanco; el tiempo entre producción y liberación toma como hora y media y la esta ultima requiere entrada de calcio, liberándose al tiempo con la neurofisina.
La vasopresina ejerce su acción antidiurética en el tùbulo contorneado distal y canales colectores renales, por mediación del AMPc; la reabsorción de agua se estimula por medio de la inserción de canales de agua (llamados acuaporinas), lo que logra el transporte de agua libre hacia la sangre, que lleva a una disminución de la osmolaridad plasmática y a un aumento de la concentración de la orina.
Su acción vasopresora (que es mínima en adultos saludables) la logra por el sistema fosfatidil-inositol/calcio, y puede además estimular la liberación de ACTH.
Regulación renal del metabolismo hidroelectrolítico
El 60% del peso corporal está constituido por agua y este contenido se mantiene estable a pesar de la variabilidad en la ingesta de líquidos o en su pérdida. El filtrado glomerular es isotónico con respecto al plasma; su volumen es de 180 litros en 24 horas, En el túbulo contorneado proximal se reabsorbe el 85% del sodio por acción de la correspondiente bomba –es decir, es un proceso activo- y el agua se arrastra pues la membrana del nefrón proximal es permeable al agua.
Cuando el contenido baja por el asa de Henle a la medula renal –que es hipertónica- la difusión de líquidos lo vuelve hipertónico pero cuando asciende y sale de la medula, por el mecanismo de contracorriente el sodio vuelve a salir (esta vez no acompañado de agua), manteniendo hipertónica la medula renal.
En el túbulo contorneado distal se logra la reabsorción del otro 15% del sodio, por acción de la aldosterona, que intercambia sodio por potasio (e hidrógeno). Allí y en el canal colector la membrana se hace permeable al agua por acción de la vasopresina (formación de microporos) y el agua sale, arrastrada por el sodio. Al final la orina es isotónica, y su volumen diario está alrededor del litro y medio.

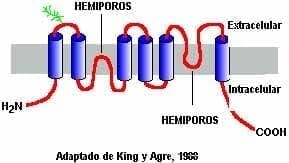 Figura. 1 Acuaporinas, canales de membrana del túbulo contorneado distal donde actúa la hormona antidiurética.
Figura. 1 Acuaporinas, canales de membrana del túbulo contorneado distal donde actúa la hormona antidiurética.