Informe Final
Informe Final
Informe Final Estudio de Bioexención por Proporcionalidad de Dosis
Metformina 850 mg
Metformina
Genfar S.A.
REALIZADO POR QUASFAR M&F S.A.
Objetivo
Objetivo General
Someter a pruebas de liberación-disolución al producto farmacéutico terminado para evaluar la posibilidad de acceder a una bioexención por proporcionalidad de dosis.
Objetivo Específico
Efectuar ensayos de perfil de liberación-disolución comparativos en los medios descritos en “Diseño y condiciones del estudio”, para el producto de referencia y el producto test al que se busca demostrar equivalencia terapeútica.
Protocolo Perfiles de Disolución
a. Los perfiles de disolución comparativo del producto test vs producto referencia se realizaron, siguiendo el análisis del modelo independiente de acuerdo a la guía aceptada por el INVIMA, Guía para la Industria de la FDA 1997 “Pruebas de disolución de formas de dosificación oral sólidas de liberación inmediata” y a las condiciones especificadas por el cliente.
 b. Los perfiles de disolución comparativo del producto test vs producto referencia se realizaron, siguiendo lo indicado en las validaciones de la metodologías analíticas para la identificación y cuantificación del principio activo en cada medio de disolución evaluado.
b. Los perfiles de disolución comparativo del producto test vs producto referencia se realizaron, siguiendo lo indicado en las validaciones de la metodologías analíticas para la identificación y cuantificación del principio activo en cada medio de disolución evaluado.
Los protocolos para las validaciones de las metodologías analíticas fueron:
Protocolos de validación B-004-18, B-005-18 y B-006-18*
*Estas validaciones forman parte integral del informe del Estudio “Perfiles de disolución comparativos Metformina 500 mg vs Glucophage® 500 mg”.
Perfil de disolución Medio HCI 0.1 N pH 1,2
 Disolución Buffer Acetato pH 4,5
Disolución Buffer Acetato pH 4,5
 Perfil de disolución Buffer Fosfato pH 6,8
Perfil de disolución Buffer Fosfato pH 6,8
 Conclusión
Conclusión
Los resultados obtenidos en los perfiles de disolución comparativos (Ver Anexo 1) para el producto test y el producto de referencia se presentan en la siguiente tabla:
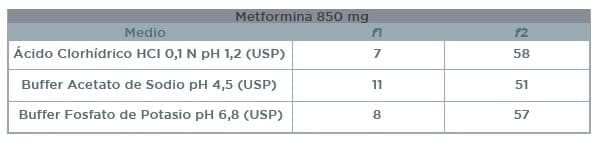
7.1 Los resultados obtenidos en los perfiles de disolución comparativos para el producto test y el producto de referencia, NO presentan diferencias en los medios evaluados. Los factores de diferenciación (f1) y factores de similitud (f2) CUMPLEN con los requisitos establecidos por la FDA.
7.2 Conforme a lo anterior el producto TEST cumple con los parámetros establecidos por FDA y OMS, y puede optar a la solicitud de Bioexención.
* En estudio por INVIMA

 Informe Final
Informe Final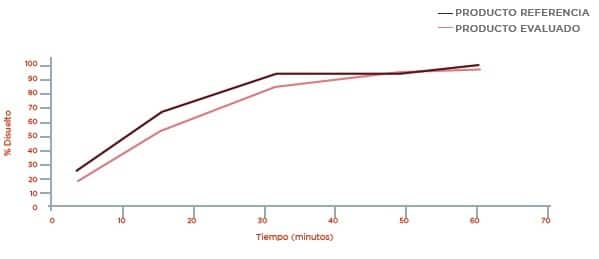 Disolución Buffer Acetato pH 4,5
Disolución Buffer Acetato pH 4,5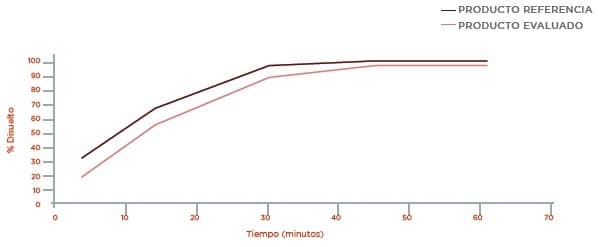 Perfil de disolución Buffer Fosfato pH 6,8
Perfil de disolución Buffer Fosfato pH 6,8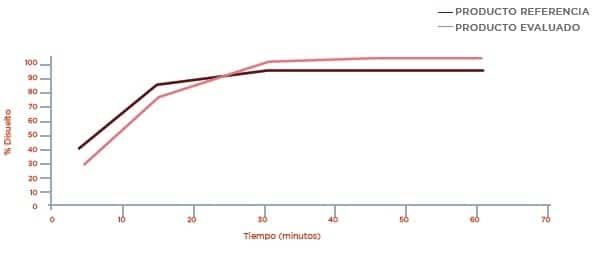 Conclusión
Conclusión