Ramírez O., Jiménez C.
Respectivamente: MV Universidad Nacional.
MV, Profesor Asistente Universidad Nacional.
Introducción
La aplicación de los procedimientos de fertilización in vitro (FIV) en la reproducción bovina se han incrementado en los últimos años y en un futuro pueden llegar a ser utilizados en programas de gran escala de producción comercia de embriones in vitro. Dentro de éste concepto, la recolección de oocitos es un paso necesario para poder llegar a establecer estos programas de FIV.
Embriones de valor comercial o de alto valor genético pueden ser obtenidos de animales recién sacrificados o de animales genéticamente valiosos. Para poder llegar a obtener los embriones in vitro, se hace necesario recuperar los oocitos y finalizar 3 procesos biológicos: maduración y fertilización de los oocitos y los cigotos resultantes desarrollarlos hasta el estado de blastocisto en donde pueden ser congelados o transferidos a receptoras sincronizadas.
En este artículo se presentarán las técnicas que han sido descritas para la recolección de oocitos bovinos en animales vivos y sacrificados y su posterior utilización para los procedimientos in vitro.
1. Metodos de Recoleccion de Oocitos
Los ovarios contienen un elevado número de folículos que se encuentran en diferentes estados de desarrollo (primordiales, en crecimiento, atrésicos) de los cuales, solamente una pequeña proporción va a ser utilizada durante la vida reproductiva del animal. La recolección de oocitos permite recuperar y aprovechar folículos no ovulatorios, que bajo condiciones fisiológicas se tornarían en folículos atrésicos, con el fin de aprovechar el máximo potencial genético de una donadora por procedimientos in vitro (8).
La recolección de oocitos para el desarrollo de tecnologías in vitro se puede realizar en dos formas:
• Recolección en animales post-mortem: Se pueden recoger por aspiración de folículos visibles o mediante el método de corte de la superficie e interior del ovario.
• Recolección en animales vivos: En animales vivos la recolección de oocitos se puede realizar por aspiración trasvaginal guiada por ultrasonido y por laparoscopia / laparotomia.
1.1 Recolección de ovarios en animales post-mortem.
La obtención de ovarios provenientes de vacas sacrificadas en el matadero suministra una fuente abundante de oocitos obtenidos a bajo costo provenientes de animales en diferentes estados del ciclo estral, que pueden ser madurados, fertilizados y cultivados in vitro hasta estados avanzados del desarrollo embrionario.
La recolección de oocitos permite recuperar y aprovechar folículos no ovulatorios, que bajo condiciones fisiológicas se tornarían en folículos atrésicos, con el fin de aprovechar al máximo el potencial genético de una donadora por procedimientos in vitro (8).
Se deben evaluar los factores externos que están involucrados en la manipulación de los oocitos antes de realizar el cultivo, ya que estos pueden afectar la expresión de la competencia del desarrollo. La competencia de desarrollo se puede definir como la habilidad que tiene el oocito fertilizado de formar embriones hasta estados avanzados (blastocisto) (3).
Dentro de los factores externos que están relacionados con la manipulación de los ovarios, se encuentran la temperatura de almacenamiento de los ovarios y el tiempo de recolección de los oocitos después del sacrificio.
La temperatura a la cual se deben transportar los ovarios desde el matadero hasta el laboratorio, oscila entre 35 y 37oC. Se ha visto que temperaturas inferiores a los 30oC durante el almacenamiento de los ovarios producen pérdida de los productos de transcripción y hay lesión de las organelas a nivel citoplasmático, las cuales van a ser mediadores importantes de desarrollo embrionario temprano (17).
El tiempo de recolección de los oocitos de los ovarios igualmente influyen en la competencia de desarrollo. Gordon y Lu (1990) reportan que los oocitos pueden permanecer en solución salina a temperatura de 30º – 37º C durante 8 horas sin llegar a afectar su calidad para los procesos de maduración y fertilización in vitro.
Los oocitos provenientes de ovarios recogidos en el matadero se pueden obtener por dos métodos: método de corte de ovarios y el método de aspiración con jeringa de folículos superficiales mayores de 2 mm de diámetro.
1.1.1 Método de corte:
Los ovarios se transportan al laboratorio en solución salina suplementada con antibióticos, a temperatura entre 35-37º C. En el laboratorio, se hace remoción del tejido adyacente, del cuerpo lúteo y de sangre con lavados de solución salina y alcohol.
El método de corte consiste en colocar cada uno de los ovarios en cajas de petri que contienen el medio de cultivo y se corta la superficie y el interior de los ovarios a lo largo y a través de éste con cuchillas separadas por 2 mm (Figura 1).
 Figura 1
Figura 1
1.1.2. Método de aspiración
Se someten a este procedimiento, folículos superficiales visibles de 2 – 5 mm de diámetro con jeringas de 5-10 cc y aguja calibre 18 G (Figura 2).
 Figura 2
Figura 2
Varios investigadores han comparado el método de corte y aspiración de folículos para evaluar el número de oocitos recuperados por ovario y la calidad de estos (Tabla 1).
La recolección de oocitos proviene de animales vivos (animales jóvenes, vacas productoras de leche, vacas de carne) permiten incrementar el número de embriones potenciales y de terneros producidos por donadora/año obtenidos por procedimientos in vitro.
Tabla 1
Recuperación de oocitos por el método de corte vs. aspiración
|
CORTE / ASPIRACIÓN |
|||
|
Carolan y col. |
Hamano y |
Lonergan y col. |
|
| No. Oocitos recuperados | 44.2/13.9 | 63.3/22.1 | 18.7/14.6 |
| Oocitos Tipo A (%)* | 38.7/30.9 | 84.6/41.3 | 29/16 |
| No. Blastocistos/ovario | 3.3/0.96 | 3.6/1 | |
Los resultados indican que con el método de corte de folículos se obtiene una mayor proporción de oocitos y de excelente calidad (Tipo A) para estudios in vitro comparado con el método de aspiración. La disminución en las tasas de recuperación y producción de embriones en el caso de aspiración folicular puede estar asociado a efectos nocivos sobre las capas de las células del cumulus ejercidas por la fuerza de aspiración.
Por otra parte, el mayor número de oocitos obtenidos por el método de corte puede estar explicado por la recuperación de oocitos provenientes de folículos menores de 2 mm de diámetro que están en el interior del folículo; sin embargo, Arlotto y col., (1996) sostienen que estos oocitos tienen poco potencial para sufrir maduración meiótica y desarrollo embrionario comparado con los oocitos recuperados de los folículos presentes en la superficie del ovario ya que los oocitos de folículos internos pueden no haber adquirido aún la competencia para la maduración y desarrollo (Tabla 2).
Tabla 2
Comparación de tasas de fertilización y desarrollo embrionario de oocitos
de folículos periféricos e internos (1)
|
Localización |
Fertilización |
Desarrollo |
|||
| n | Total % | n | % Clivados | % Mórula + Blastocisto |
|
| Internos | 34 | 62 | 153 | 34a | 3a |
| Periféricos | 36 | 78 | 192 | 69b | 25b |
1.2 Animales vivos
La recolección de oocitos proveniente de animales vivos (animales jóvenes, vacas productoras de leche, vacas de carne) permiten incrementar el número de embriones potenciales y de terneros producidos por donadora/año obtenidos por procedimientos in vitro; además, permite la disminución del intervalo generacional y establecer esquemas que permitan incrementar la eficiencia de producción de carne por inducción de preñeces gemelares.
Dentro de las técnicas que se han reportado para la recolección de oocitos bovinos se encuentran: laparotomía-laparoscopia y aspiración transvaginal guiada por ultrasonido.
1.2.1. Laparotomía / Laparoscopia
El desarrollo de la laparoscopia ha permitido avances en el diagnóstico y manejo de la fertilidad para incrementar la producción animal. Se ha utilizado para desarrollar la industria de transferencia en aquellas especies o grupos de edades en donde no es fácil realizar la manipulación del tracto reproductivo por vía rectal durante la recuperación de oocitos y/o transferencia de embriones.
Dentro de las ventajas que ofrece la laparoscopia se encuentra el bajo costo del equipo, la obtención de una imagen clara y un mejor control de problemas de recuperación post quirúrgico del ovario (6, 19).
Dentro de las desventajas que ofrece esta técnica se encuentran la no visualización de la cohorte de folículos que están en crecimiento debajo de la superficie ovárica, el desconocimiento de los efectos a largo plazo de recolecciones repetidas que pueden llegar a formar cicatrices y adhesiones en el sitio de operación y básicamente, el hecho de ser una técnica altamente invasiva por lo cual no es aceptada desde el punto de vista de bienestar del individuo.
1.2.2. Aspiración transvaginal guiada por ultrasonido
El ultrasonido ha sido utilizado como una herramienta en biotecnología para la aspiración de oocitos en bovinos por vía transvaginal.
Este procedimiento se puede realizar durante todos los estados del ciclo estral, durante el primer trimestre de gestación y aún en animales prepúberes. Este procedimiento se puede realizar una o dos veces a la semana durante períodos de 3 a 6 meses.
El primer método para discriminar entre oocitos competentes e incompetentes para el desarrollo embrionario es la morfología del citoplasma y de las células del cumulus. La calidad de las envolturas celulares que rodean el oocito y la apariencia del citoplasma son los mejores indicadores del potencial que éste posee para la maduración y fertillización in vitro (12).
Para preparar los animales para la aspiración transvaginal, las vacas son sedadas. El recto es relajado con Detomidina (0.016 mg/Kg IV) y se realiza anestesia epidural para prevenir las contracciones abdominales y así facilitar la manipulación de los ovarios. Se vacía el recto y se limpia la región perineal. Para la técnica se utiliza un transductor de 5 ó 7.5 MHz que posee una aguja en la parte superior con punta ecogénica conectado a una bomba peristáltica de vacío que es introducido por vía vaginal. Se hace manipulación rectal de los ovarios y se colocan contra el transductor, se visualizan los folículos (mayores de 2 mm) y una vez localizados, la aguja atraviesa la pared vaginal y se recoge el aspirado folicular en tubos que contengan el medio de cultivo. En cada pasaje de la aguja se punciona solamente un folículo (Figura 3) (5).
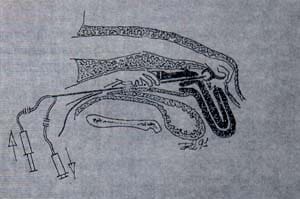
Figura 3 Diagrama de aspiración transvaginal guiada por ultrasonido
Las ventajas de ésta técnica de recolección son su fácil utilización a nivel de campo, el menor riesgo para el paciente y su menor invasividad comparada con la laparoscopia.
Dentro de las desventajas que ofrece ésta técnica se encuentra el relativo elevado costo del equipo y la necesidad de personal capacitado para la punción.
1.2.2.1 Frecuencia de aspiración
La aspiración de folículos se puede realizar una vez por semana iniciando el día 3 ó 4 del ciclo estral que corresponde a la emergencia de la primera onda de crecimiento folicular. Sin embargo, se ha encontrado que el número de folículos aspirados y complejos cumulus-oocito (COC) recuperados es mayor cuando se realizan las aspiraciones 2 veces a la semana con intervalo de 3 ó 4 días (Tabla 3).
Tabla No. 3
Recuperación de oocitos por aspiración transvaginal
1 vs. 2 veces por semana (20)
| Frecuencia de punción | 1 vez/semana | 2 veces/semana |
| No. Folic Aspirados/semana | 25.3a | 46b |
| No. COC Recogidos/semana | 10.8a | 18.8b |
Se ha visto que con 2 aspiraciones a la semana, se produce un mayor número de embriones y de mejor calidad que con 1 aspiración a la semana, quizás porque los oocitos recolectados son sincrónicos en crecimiento y no provienen de un ambiente atrésico que podría existir con una aspiración a la semana por la presencia de un folículo dominante (7, 20).
Diferentes Tipos de Oocitos
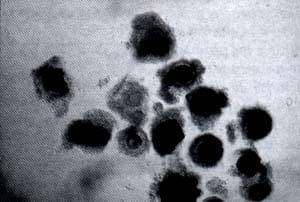
Para obtener COC de buena calidad durante la aspiración transvaginal se debe tener en cuenta la relación entre el diámetro de la aguja y la presión de aspiración. En bovinos, los folículos han sido aspirados con agujas de 18-22 G, jeringas de 5-20 ml y presión de vacío de 75-100 mm HG. Las mayores tasas de recuperación se obtienen con agujas más gruesas (18G) independiente del vacío de aspiración. Se ha visto que la presión de vacío ejercida durante la aspiración afecta no solo la tasa de recuperación de recuperación de oocitos, sino también la calidad de estos. Incrementos en la presión de vacío aumenta el número de oocitos recuperados, pero a la vez se disminuye el número de oocitos viables, posiblemente por la pérdida de las células del cumulus que rodean al oocito (4).
1.2.2.2 Efectos de la aspiración transvaginal a nivel ovárico
La mayoría de investigadores no han encontrado ningún tipo de adhesiones o anormalidades en el tracto genital y ovarios. Solamente han reportado un leve endurecimiento de los ovarios debido a incrementos en el número de fibras de colágeno en la túnica albugínea. Sin embargo, las altas tasas de preñez obtenidas con estos animales después del tratamiento indican que el daño es leve, sugiriendo que no se produce ningún daño irreparable a nivel ovárico con la aspiración transvaginal (15, 18).
1.2.2.3 Efectos de la aspiración transvaginal sobre el ciclo estral
Cuando los animales son sometidos a una aspiración por semana el celo se presenta normalmente cada 19-22 días, hay formación de cuerpo lúteo 3 a 5 días después del celo, aunque pueden haber compromisos de los niveles de progesterona plasmática.
Cuando se realizan 2 aspiraciones por semana con intervalo de 3 a 4 días, se inhibe el desarrollo de un folículo dominante y se detiene la ciclicidad debido a la ausencia de ovulación, que puede presentarse como consecuencia de la permanente manipulación del ovario y a la pérdida de fluido folicular durante la aspiración. Sin embargo, si el intervalo de aspiración es mayor de 5 días el animal puede ovular y desarrollar cuerpo lúteo (11, 16, 18).
1.3 Recolección de oocitos en animales prepúberes
La presencia de ondas foliculares en terneras y la habilidad para estimular el desarrollo folicular ofrece la posibilidad de utilizar animales jóvenes como fuente de oocitos; sin embargo, las principales limitaciones para desarrollar la técnica de aspiración transvaginal en animales prepúberes con la carencia de un diseño adecuado de transductor para el ultrasonido y la inhabilidad de inmovilizar manualmente los ovarios por vía rectal; por lo tanto, la técnica más utilizada para recuperar oocitos en este grupo de animales ha sido la laparoscopia/laparotomía.
2. Clasificación de los Oocitos
Una etapa crítica en el procedimiento de FIV consiste en la evaluación morfológica de los oocitos para determinar su potencial fertilizante.
Comercialmente, la aspiración de oocitos para la producción in vitro de embriones le puede permitir a los productores generar un elevado número de embriones de sus mejores vacas aún cuando sus animales sean viejos o presenten patologías del tracto reproductivo que influyan sobre su fertilidad.
2.1 Morfología
El primer método para discriminar entre oocitos competentes e incompetentes para el desarrollo embrionario es la morfología del citoplasma y de las células del cumulus. La calidad de las envolturas celulares que rodean el oocito y la apariencia del citoplasma son los mejores indicadores del potencial que éste posee para la maduración y fertilización in vitro (12).
Las células del cumulus son subpoblaciones de células de la granulosa las cuales proveen de nutrientes al oocito durante el crecimiento, participan en la formación de la zona pelúcida y sintetizan la matriz compuesta de ácido hialurónico y proteínas que juegan un papel importante en el transporte del oocito a través del oviducto y permiten atrapar al espermatozoide para la fertilización (1).
Cada laboratorio establece un tipo de clasificación para los oocitos recuperados que se van a someter a procedimientos in vitro. Los oocitos pueden ser clasificados de acuerdo al número de capas de células del cumulus y la apariencia del citoplasma según se observa en la tabla 4. De estas categorías en general se considera que solamente los oocitos tipo A y B poseen un elevado potencial para desarrollarse a embriones por FIV.
Comercialmente, la aspiración de oocitos para la producción in vitro de embriones le puede permitir a los productores generar un elevado número de embriones de sus mejores vacas aún cuando sus animales sean viejos o presenten patologías del tracto reproductivo que influyan sobre su fertilidad.
Finalmente, la técnica de recolección de oocitos combinada con la producción in vitro de embriones puede llegar a convertirse en una alternativa potencial a los procedimientos convencionales de superovulación y producción de embriones in vivo en el momento en que por éste método se produzcan una mayor cantidad de embriones transferibles en períodos más cortos de tiempo sin la utilización de hormonas y sin efectos nocivos sobre la salud y fertilidad animal.
Comercialmente, la aspiración de oocitos para la producción in vitro de embriones de sus mejores vacas aún cuando sus animales sean viejos o presenten patologías del tracto reproductivo que influyan sobre su fertilidad.

Igualmente, esta técnica ofrece la posibilidad de ser utilizada en animales jóvenes con el fin de disminuir el intervalo generacional y por último, permite la recuperación de oocitos de animales recién sacrificados de alto valor genético con el fin de producir una última descendencia.
Desde el punto de vista científico, estas técnicas constituyen la base para el desarrollo de nuevas tecnologías como la clonación y sexaje de embriones y la producción de animales transgénicos.
BIBLIOGRAFIA
1. Arlotto T., Schwartz J.L., First N.L., Leibfried M.L. aspects of follicle and oocyte stage that affect in vitro maturation and development of bovine oocytes. Theriogenology 45:943-956. 1996.
2. Armstrong D.T, Holm P., Irvine B., Petersen B. A, Stubbings R. B., Mc Lean D., Stevens G., Seamark, R.F. preganancies and live birth from in vitro fertilization of calf oocytes collected by laparoscopic follicular aspiration. Theriogenology 38: 667-678. 1992.
3. Blondin P., Coenen, K., Guibault, L. A, Sirard, M.A. In vitro production of bovine embryos: developmental competence is acquired before maturation. Theriogenology 47: 1061-1075.1997.
4. Bols P. E., Van Soom A., Ysebeart M.T., Van Den Heede J.M., Kruip A. Effects of aspiaration vacuum and neddle diameteron cumulus oocyte complex morphology and developmental capacity of bovine oocytes. Theriogenology 45:1001-1014.1996.
5. Carolan C., Monoghan P., Gallagher M., Gordon I. Effect of recovery method of bovine oocytes per ovary and their developmental competence after maturation, fertilization and culture in vitro. Theriogenology 41:1061-1068. 1994.
6. Fayrer-Hosken R.A., Caudle A.B. the laparoscope in follicular oocyte collection and gamete intrafalopian transfer fertilization (GIFT). Theriogenology 36: 709-724. 1991.
7. Gibbons J.R., Beal W.E., Krisher R.L., Faber E.G., Pearson R.E, Gwwaskauskas F.C. effect of once versus twice weekly transvaginal follicular aspiartion on bovine oocyte recovery and embryo development. Theriogenology 42:405-419. 1994.
8.gordon I, Lu H. production of embryos in vitro and its impact on livestock production. Theriogenology 33:77-87. 1990.
9. Hamano S., Kuwayama M. invitro fertilization and development of bovine oocytes recovered fron the ovaries of the individual donors: a comparison between the cutting and aspiration method. Theriogenology 39:703-712. 1993.
10. Kruip A.M., Pieterse M.C., Van Beneden H., Vos, I.A. wurth Y.A, Taverne M.A. A new metod for bovine embryo production: a potentia alternative to superovulation. Veterinary Record 128:208-210. 1991.
11. Kruip A.M., Boni R., Wurth Y.A., Pieterse M.C. potential use of ovum pick-up for embryo production and breeding in cattle. Theriogenology 42:675-684. 1994.
12. Leibfried M.L.,Critser E.S. Parrish J.L, Fist N.L. in vitro maturation and fertilization of bovine oocytes. Theriogenology 31: 6174. 1989.
13. Lonergan P., Vergos E., Kinis A., Sharif H., Gordon I. The effect of recovery method on the type of bovine oocyte obtained for IVM. Theriogenology 35:231 (Abstract). 1991.
14. Pieterse M.C, Kappen K.A., Kruip A.M., Taverne M.A. Aspiration of bovine oocytes during transvaginal ultrasound scanning of the ovaries. Theriogenology 30: 751-762. 1988.
15. Pieterse M.C., Kruip A.M., Wurth Y.A., Van Beneden H., Taverne M.A. Transvaginal ultrasound guided follicular aspiartion of bovine oocyte. Theriogenology 35: 19-24. 1991a.
16. Pieterse M.C., Vos P.L., Kruip A.M., Willemse A.H., Taverne M.A. characteristics of bovine estrous cycles during repeated transvaginal ultrasound-guided puncturing of follicles for ovum pick-up. Theriogenology 35:401-413. 1991b.
17. Sekine J., Sakurada T, Oura, R. Optimum temperature of ovarian transportation for in vitro fertilization of bovine oocytes. Vetrerinary record 131:372.1992.
18. Stubbing R.B, Walton J.L. effect of ultrasonicaly-guided follicle aspiration on estrous cycle and follicular dynamics in Holstein cows. Theriogenology 43:705-712. 1995.
29. Tervit H.R. Laparoscopy/laparotomy oocyte recovery and juvenil breeding. Animal reproduction Science 42:227-235. 1996.
20. Van Der Schans A., Van Der Westterlaken L.A. Eyestone W.H. Boer M.A. ultrasound-guided transvaginal collection of oocytes in the cow. Theriogenology 35:288 (Abstract). 1991. Vitro.







hola,muy bueno,quiero aprender a transferir embriones congelados si puedes enviarme material de apoyo te lo sabre agradece, tengo experiencia en IA.