Introducción
El panorama del espacio pleural para cirugía de tórax en el paciente oncológico esta constituido por patología tumoral, infección del espacio pleural, quilotórax y derrame pericárdico maligno. Dentro de la enfermedad neoplásica el 95 % corresponde a metástasis y solo un 5 % a enfermedad primaria pleural, usualmente Mesotelioma.
Otros tumores son muy raros9,10,11. Se abordará el derrame asociado a cáncer1-9,13-16,19 que es lo más frecuente y se mencionará algo sobre derrames paraneumonicos, empiema27, derrames refractarios, quilotórax31 y derrame pericárdico maligno. Esta última es una condición asociada con frecuencia en estos pacientes que requiere intervención28,29,30. (Lea también: Stents en la vía aérea: presente y futuro)
Mario Andres López Ordóñez
Cirujano de tórax. Instituto Nacional de Cancerología
Etiología del derrame pleural neoplásico
Los derrames pleurales se presentan en insuficiencia cardiaca, desnutrición e hipoalbuminemia, neumonías, pancreatitis, tromboembolismo pulmonar y como una extensión o progresión del cáncer. Se mencionan porque algunas de estas causas coexisten en el paciente oncológico y deben descartarse con una adecuada historia clínica.
Causan derrame los tumores de pulmón, seno, estomago, ovario y linfomas en orden decreciente. En teoría cualquier carcinoma puede ocasionar metástasis a la pleura. El pulmón es el que lo hace con más frecuencia. Le siguen el cáncer de Seno, ovario, estomago y el linfoma.
Si se tiene en cuenta el sexo en mujeres es más frecuente el derrame secundario a cáncer de seno1-5,9,13-16,19. Todos en conjunto producen el 80 % de los derrames neoplásicos. En el Instituto predomina el cáncer de seno con un 32 %, pulmón 24 %, cervix 12 % y otros 2 %.
Datos similares a la literatura pero que reflejan más el gran volumen de consulta por estos tumores. Usualmente tenemos un promedio de 1 a 4 consultas semanales con derrame pleural en pacientes con cáncer. Es una patología frecuente pero desafortunadamente significa una expectativa corta de vida.
Fisiopatología
El derrame pleural en un paciente con cáncer puede ser:
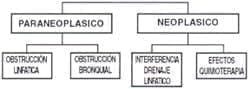
Paraneoplásico
Es decir relacionado pero no producido por el tumor caso en el cual es causado por:
- Obstrucción linfática.
- Obstrucción bronquial con neumonía o atelectasia y atrapamiento del pulmón.
Neoplásico
Por progresión de la enfermedad, donde generalmente el tumor es un caso avanzado y el derrame se produce por:
- Interferencia del drenaje linfático entre la pleura parietal y los ganglios mediasti-nales.
No es proporcional la extensión del compromiso metastásico con el derrame pleural. Por ejemplo un sarcoma que compromete la pleura no presenta gran derrame debido a que generalmente no produce metástasis linfáticas1,2,3,4,5.
Cuadro clínico del derrame pleural neoplásico
Los síntomas son disnea con el ejercicio, tos frecuente y a veces dolor torácico. La reserva funcional del paciente y el volumen del derrame se relacionan en forma proporcional con el grado de disnea. Esta se produce por la disminución de la distensibilidad, desplazamiento mediastinal, disminución del volumen pulmonar y la integración de los reflejos producidos por estos cambios.
La tos se relaciona con neumonitis obstructiva, una lesión endobronquial o la infiltración parenquimatosa por tumor. Como el derrame es la progresión de una enfermedad terminal casi siempre encontramos un paciente caquéctico y en mal estado general1,2,3,4.
Exámenes paraclínicos
Se hace el diagnóstico con la ayuda de los síntomas y la evidencia al examen físico de derrame pleural. Este se confirma en una radiografía simple de tórax y/o una ecografía torácica. Posteriormente se practica una toracentesis y se analiza el líquido obtenido con una citología, citoquímico, Gram, cultivo y antibiograma.

Manejo del derrame pleural neoplásico
Si el derrame es muy pequeño se recomienda realizar una ecografía con marcación o drenaje bajo visión ecográfica. Se sospecha un derrame maligno cuando hay un exudado hemorrágico en pacientes mayores de 60 años.
Este exudado se califica con los criterios de Light6,7,8,13,16,19. Se confirma cuando se observan en la citología células malignas. Sin embargo en solo el 50 % de los pacientes se obtiene una citología que confirme el diagnóstico.
Un 10 % requiere con un segundo aspirado. La biopsia pleural con aguja no ayuda mucho por ser un procedimiento ciego y es mejor la videotoracoscopia con biopsia con sensibilidad mayor de 80% en el diagnóstico. A veces se requiere toracotomía. Esto quiere decir que 10 a 40 % quedaría en duda1,2,3,4,5,9,13-16,19.
Si se logra en primera instancia confirmar linfoma, cáncer de seno o de ovario; el derrame puede desaparecer con quimioterapia. Asimismo, si el paciente con estos tumores ya recibió quimioterapia y recurre se debe realizar una nueva toracentesis.
Si se obtiene un exudado hemorrágico, se recomienda pensar en drenaje y pleurodesis, siempre y cuando tenga disnea severa y un volumen de derrame abundante. Nosotros evaluamos en este punto el estado funcional del paciente ya que en algunos casos el estado general es malo y realizar un drenaje con tubo puede llevar a la muerte.
Esto se puede predecir con una escala funcional que pronostica sobrevida. Autores como Sahn5 miden el pH del líquido. La sobrevida es corta si el pH es menor de 7.304 o el (IK) Índice de Karnofsky es menor de 60 %19.
Escala de Karnofsky
|
100 % |
Normal. Sin enfermedad aparente. |
| 90 % | Capaz de llevar vida normal. Quejas menores. |
| 80 % | Actividad normal con esfuerzos. Algunos signos y Síntomas de enfermedad. |
| 70 % | Se cuida solo pero no puede llevar actividad normal o trabajar. |
| 60% | Requiere asistencia ocasional pero puede hacer la mayoría de sus labores personales. |
| 50% | Requiere asistencia considerable y frecuente cuidado médico. |
| 40% | Incapacitado. Requiere cuidado especial y asistencia todo el tiempo. |
| 30% | Severa incapacidad. Hospitalización indicada. Aunque no es inminente la muerte. |
| 20% | Muy enfermo Hospitalización y soporte necesario. |
| 10% | Moribundo. |
| 0% | Muerto. |
Entonces con un drenaje recurrente se recomienda:
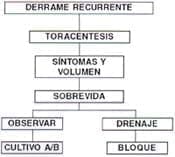
La recurrencia indica etiología tumoral. Se repite sin embargo todo el análisis. Si se decide drenaje torácico quedan tres opciones: Tubo, sonda, toracoscopia13-23,26. Se deben tener como alternativas secuenciales y no excluyentes.
El manejo ambulatorio proporciona comodidad, menos dolor, ahorro de camas hospitalarias, con iguales resultados de efectividad y mejor aceptación por los pacientes, médicos e instituciones. Tiene por supuesto contraindicaciones y requiere mayor atención de malfuncionamiento y/o complicaciones 13-23,26.
Paciente con drenaje ambulatorio
Pleurodesis
Esta se realiza cuando el drenaje es menor de 100-150 cc en 24 horas pero es condición absoluta la expansión pulmonar confirmada con radiografía. Se recomienda evaluar cada caso en forma individual. Se puede retirar el tubo sin pleurodesis si la citología es negativa y el derrame no es un exudado.
Sin embargo es probable que un paciente con cáncer de seno, que ya recibió tratamiento con quimioterapia que vuelve a presentar derrame pleural este sea maligno y no hacer pleurodesis teniendo un tubo, es postergar la solución del problema . Así se trate de un exudado de hemorrágico con citología negativa. Esto se puede presentar hasta un 60% de las veces.
Recurrencia del derrame
Entonces vuelve a consultar un tiempo después con recurrencia del derrame, porque no se le realizó pleurodesis y tiene que someterse a un segundo procedimiento de toracentesis y/o tubo de tórax.
Por esto al ponerse en el lugar del paciente e individualizando cada caso de común acuerdo se podría proponer pleurodesis por tubo cuando se presenta un caso con este panorama o realizar una toracoscopia y pleurodesis operatoria.
Si la citología es positiva para un derrame maligno se practica pleurodesis con talco13-22,23,26, utilizando de 2 a 5 gr disueltos en 200 cc de SSN. Se indica al paciente que debe realizar cambios de posición cada 20 o 30 minutos durante 4 a 6 horas con el drenaje cerrado y luego se abre.
Idealmente debe someterse a succión continua. Se retira al día siguiente o cuando el drenaje de 24 horas sea menor de 150 cc y el pulmón se encuentre expandido. Posteriormente se da de alta y se controla ambulatoriamente.
Todo el procedimiento se ha revaluado y actualmente se propone oclusión durante una hora, sin cambios de posición luego de demostrar que con tetraciclina radiomarcada que la distribución es uniforme y completa21.
El mejor material para pleurodesis es el talco que está compitiendo actualmente con el nitrato de plata13,-23,26. Nuestra experiencia con este último es limitada pero en forma anecdótica podemos mencionar que cuando se empleo la reacción inflamatoria y el dolor fueron más severos.
Estos elementos son superiores a los demás y más baratos. Tampoco son nuevos23,24,25. La pleurodesis no está exenta de complicaciones y tampoco la recomendamos cuando hay sobreinfección del espacio pleural, ya que es frecuente que produzca fiebre transitoria, también empiema.
La evaluación radiológica posterior al procedimiento debe ser cuidadosa ya que se presentan alteraciones que pueden generar alguna preocupación si no se tiene experiencia11.
Empiema en el paciente con cáncer
El alto riesgo de infección en estos pacientes hace que siempre se tenga en cuenta como diagnóstico diferencial el empiema. No se realiza toracentesis siempre que hay derrame.
Si lo hay se evalúa cada caso individualmente27 y se decide el manejo en conjunto con oncólogos, internistas, neumólogos y cirujanos. Se hace balance de riesgo beneficio, para no realizar procedimientos que puedan desencadenar una sepsis.
Es importante seguir cuidadosamente al paciente para no hacer un diagnostico tardío que sigue siendo un gran reto. La evaluación permanente puede evitar un mal desenlace. Es importante seguir la recuperación del sistema inmune antes de realizar cualquier procedimiento.
El Nadir de quimioterapia se presenta después de 1 semana y se recupera usualmente 4 semanas después. Se debe confirmar un recuento leucocitario normal antes de reiniciar los medicamentos y de realizar punciones o drenajes. Si se confirma infección o el riesgo es alto se contraindica pleurodesis por ser el empiema complicación de este último13-,23,26.
Derrame refractario
En algunos casos el derrame recurre a pesar de la pleurodesis, en estos casos se puede repetir la pleurodesis, utilizando nitrato de Plata24,25. El siguiente paso es la decorticación o el uso de un Shunt pleuro-peritoneal como el de Denver, que generalmente se deben reservar para pacientes en muy buen estado o con mejor pronóstico.
La experiencia del servicio es limitada pero se ha utilizado con éxito el shunt de Denver en pacientes con linfoma tratados, que han quedado con el drenaje linfático obstruido después de quimioterapia y radioterapia mediastinal. Su costo es elevado y esto puede limitar su uso frecuente35,36,37.
Quilotórax
La causa más frecuente es linfoma . Los demás casos son postoperatorios de cirugía esofágica generalmente. El diagnóstico se sospecha cuando el drenaje es de color blanquecino o rosado. Se confirma obteniendo una muestra cuya medición de triglicéridos sea mayor de 110 mg/dL o por inmunoelectroforesis que demuestre quilomicrones.
Se puede usar medicina Nuclear. Si se trata de un linfoma la quimioterapia puede ser suficiente. El tratamiento médico se usa en forma escalonada empezando con dieta baja en grasas, luego Nutrición parenteral, somatostatina, pleurodesis y si no hay mejoría se evalúa la utilidad de ligadura quirúrgica, toracoscopia y a veces decorticación31,32,33,34.

Catéter Pericardico
Derrame pericárdico
Un gran número de pacientes presenta derrame pleural neoplásico y pericárdico en forma simultánea o individual. Su diagnóstico se sospecha por ingurgitación yugular, disnea, ruidos cardiacos velados y pulso paradójico. Se confirma por ecocardiograma. Asimismo, se debe descartar previamente, Síndrome de vena cava superior que es similar clínicamente además de frecuente en estos pacientes.
Se trataba usualmente con drenaje quirúrgico bajo anestesia local o general utilizando una sonda de Foley. Actualmente lo estamos tratando con drenaje por punción con catéteres de punción venosa, bajo visión ecográfica. Los resultados han sido buenos con costos más bajos28,29,30.
Bibliografía
1. Sahn S. A. Malignant pleural effusions SEMIN RESPIR MED.1987;9:43-53.
2. Sahn S. A. Pleural Diseases related to metastasic malignancies EUR RESPIR J 1997;10:1907-1913.
3. Sahn S. A. Malignancy Metastasic to the Pleura. CLINICS IN CHEST MEDICINE 1998. 19;2:351-361.
4. Sahn S. Good JT. Pleural fluid PH in malignant effusions: Diagnostic, prognostic, and therapeutic implications. Ann Intern Med 1988;108:345-49.
5. Meyer PC. Metastasic carcinoma of the pleura. Thorax 1966;1:437-443.
6. Light Rw, Mcgregor Mi Luchsinge P, Ball W. Pleural effusions: The diagnostic separation of transudates and exudates. ANN OF INTERN. MEDICINE 1972; 77:507-513.
7. Marel M. Stastny B. Melinova L. Svandova E. Light R. Diagnosis of Pleural Effusions. Experience with Clninical Studies, 1986 to 1990. CHEST 1995;107:1598-1603.
8. Vives M. Porcel J. Vicente De Vera M. Ribelles E. Rubio M. A study of Light´s Criteria and Posible Modifications for Distinguishing Exudative From Transudative Pleural Effusions. CHEST 1996; 109:1503-07.
9. Mcloud T. CT and Mr in pleural disease. Clinics In Chest Medicine 1998;19;261-276.
10. Kuhlman J. Complex Disease of the pleural Space: The 10 Questions Most Frequently Asked of the Radiologist- Nex aproaches to Their Answers wth CT and MR Imaging RADIOGRAPHICS 1997;17:1043-1050.
11. Kuhlman J. Singha N. Complex Disease of the pleural Space: Radiographic and CT Evaluation. RadioGraphhics 1997;17:63-79.
12. Murray J. Patz E. Erasmus J. Gikeson R. CT Appearance of the Pleural Space after Talc Pleurodesis. AJR 1997;169:89-91.
13. Antunes G. Management of malignant pleural effusions THORAX. 2000.55:12;981-83.
14. Patz E F. Malignant Pleural Effusions. Recent Advances and Ambulatory Sclerotherapy. CHEST S. 1998;113:74S-77S.
15. Belani Ch. Pajeau T. Bennet CH. Treating Malignant Pleural Effusions Cost Consciously. CHEST 1998;113:78S-85S.
16. Ansary T. Idel S. Management of Undiagnosed Persistent Pleural Effusions. CLINICS IN CHEST MEDICINE 1998;19:407-17.
17. Parulekar W. Use of small-bore vs large-bore chest tubes for treatment of malignant pleural effusions. Chest 2001.120:1;19-26.
18. Saffran L. Ost D. Mein A. Schiff M. Outpatient pleurodesis of Malignant Pleural Effusions Using a Small-bore pigtail Catheter. CHEST 2000.118;2.
19. López Ma. Buitrago R. Beltran R. Manejo ambulatorio del derrame pleural maligno. Pendiente de publicar en la Rev Colom Neumol.
20. Pien G. Use of an implantable pleural catéter for trapped lung síndrome in patients with malignant pleural efusión. Chest 2001;119:119;1641-47.
21. Lorch Dg. Gordon L Woote S. The effect of patient positioning on the distribution of tetracycline in the pleural space during pleurodesis . Chest 1988;93:527-29.
22. Ribas J. Vargas F. Campos E. Cardoso P. Thoracoscopy talc poudrage: A 15 year experience. Chest 2001;119:801-806.
23. Ross R. Talc pleurodesis: A new technique. The American Surgeon. 2001;67:467-9.
24. Gallivan G. Pleurodesis and silver nitrate. Chest 2001;119: 1624.
25. Vargas Fs. Texeira Lr. Vaz M. Silver Nitrate is superior to talc slurry in producing pleurodesis in rabbits. Chest 2000;118:808-813.
26. TATE CH. Talc- Rationale and Use in Malignan Pleural Effusions. Cancer Control: Jmcc 1997;4:172-178.
27. Colice G. Curtis A. Deslauriesr J. Heffne J Light R. Littenberg B. Sahn S. Weinstein R. Yusen R. Medical and Surgical Treatment of Parapneumonic Effusions. CHEST 2000;18:1158-1171.
28. Girardi L. Ginsberg R. Burt M. Pericardiocentesis and Intrapericardial Sclerosis: Effective Therapy for Malignant Pericardial Effusions. Ann Thorac Surg 1997;64:1422-8.
29. Maher E. Shepherd F. Todd T. Pericardial Sclerosis as the prymary management of malignant pericardial effusion and cardiac tamponade. J Thorac Cardiovasc Surg 1996;112:637-43.
30. Lashevsky I. Ben Yosef R. Rinkevich D. Reisner S. Markiewicz W. Intrapericardial Minocycline Sclerosis for Malignant Pericardial Effusion. CHEST 1996;109:1452-54.
31. Bessone Ln. Ferguson T. Burford T. Chylothorax. ANN THORAC SURG 1971;12:527-37.
32. Pui M. Yue T. Lymphoscintigraphy in chyluria, chyloperitoneum and chylothorax. THE HOURNAL OF NUCLEAR MEDICINE. 1998;39;7:1292-7.
33. Mares D. Mathur P. Medical thoracoscopic talc pleurodesis for chylothorax due to lymphoma: A case series. CHEST 1998;114;3:731-5.
34. Demos N. Kozel J. Scerbo J. Somastotatin in the treatment of chylothorax. CHEST 2001;119:964-66.
35. Milson J. Kron I. Rheuban K. Chylothorax: an assessment of current surgical management. J Thorac Cardiovasc Surg 1985;89:221-30.
36. Weese J. Schouten J. Internal drainage of intractable malignant pleural effusions. WIS MED J. 1984;83:21-25.
37. Miller J. Chylothorax and anatomy of the thoracic duct. En Shields T. General Thoracic Surgery: Lea & Febiger Philadelphia. 1989.