Presentación de un caso y revisión de la literatura
Resumen
Se presenta el caso de una lactante de 6 meses con cuadros respiratorios a repetición, a quien se le documentó una fibrosis quistica pese a no cumplir con os criterios tradicionales para el diagnostico, como tes de iontoforesis negativo.
Se discuten las posibles causas de esta situación así como las alternativas diagnosticas en estas circunstancias y se insiste en la necesidad de no descartar esta patología sobre todo cuando el cuadro es muy sospechoso, aunque la prueba de iontoforensis sea negativa.
Fibrosis quística del páncreas con test de iontoforensis negativo. Presentación de un caso y revisión de la literatura. 1999 Rev Colomb Neumol 2000;12: 37-40. (Lea también: Tumores de la pared torácica: tumor de Askin. Presentación de un caso)
Lina Jaramillo B, MD*
* Profesora Asistente Universidad Nacional de Colombia. Departamento de Patologia,
Hospital Pediátrico de la Misericordia.
Summary
A case study is presented about a 6-month-old infant with repetitive respiratory symptoms. It is documented as cystic fibrosis, even though traditional diagnostic criteria are not met, such as a negative iontophoresis.
The possible causes of this case are discussed, as well as diagnostic alternatives in these circumstances. Even though the iotophoresis test is negative the need to not eliminate this disease especially when the symptoms are very suspicious,is insisted greatly.
Pancreatic cystic fibrosis with a negative iontophoresis test. Presentation of a case study and a literary revision. 1999Rev Colomb Neumol 2000;12;37-40
Resumen de historia clínica
Lactante femenino de 6 meses de edad, con cuadro respiratorio de 3 meses de evolución que ha requerido hospitalización en 3 ocasiones. Un primer episodio con tos cianosante, emetizante requirió tratamiento antibiótico hospitalario por 9 días.
En el segundo episodio permaneció hospitalizado durante 7 días con diagnósticos de desnutrición neumonía basal derecha, atelectasia y bronquiolitis sobreinfectada. Seis días después de este ingreso vuelve a presentar dificultad respiratoria, inician manejo hospitalario con ampicilina, broncodilatadores y oxigeno, y ante la pobre respuesta es remitida a hospital de tercer nivel.
Revisión por sistemas
Sudoración profusa salada y cuadros diarreicos asociados a los eventos respiratorios.
Antecedentes de importancia
Fruto de la primera gestación, padres consanguíneos (primos hermanos), sostiene la cabeza, no se da vueltas, no emite sonidos.
Examen de ingreso
4500 gr, afebril. Mal estado general, con signos de desnutrición crónica edematosa y síndrome de dificultad respiratoria leve, murmullo vesicular disminuido y estertores alveolares en hemitórax izquierdo.
Evolución
Ingresa con diagnostico de neupatiá crónica secundaria a fibrosis quistica, tuberculosis, hipertensión pulmonar y desnutrición de tipo Kwashiorkor. Se inicia manejo con oxacilina, cefotaxime.
Se encuentra leucocitosis, neutrofilia, aumento de la VSG y acidosis respiratoria compensada. Rx de tórax: infiltrados bronconeumonicos bilaterales; ecografía renal normal. Hemocicultivos negativos, cultivo de secreciónes pulmonares con estafilococo aureus, cultivo y BK de jugo gástrico negativos.
Test de electrolitos en sudor 21 mEq/l. Parciales de orina con liucocituria sin bacterias, urocultivos negativos. Dos semanas después de su ingreso empeora el cuadro clínico y la TAC pulmonar múltiples tractos fibrosos bilaterales y bronquiectasias del lóbulos medio.
Se inicia ceftriaxona (10) días, oxacilina (17 días) y ante la poca mejoría se cambia oxacilina por vancomicina; e imipenen por 15 días. En su evolución hace un cuadro de alcalosis metabólica persistente que plantea un diagnostico de S. De Bartter.
Al mes y medio del ingreso está en buenas condiciones y permanece asi durante 12 días cuando súbitamente inicia cuadro de dificultad respiratoria severa, cianosis y bradicardia que requiere ventilación asistida.
Los rx de tórax muestran atelectasia masiva izquierda, hace pico febril de 38. °3 y 22 horas después presenta para cardiorrespiratorio que no responde a maniobras. Fallece 56 días después de su ingreso con diagnósticos finales d neumopatia crónica, hipertensión pulmonar y desnutrición crónica mixta.
La autopsia muestra cambios de fibrosis quistica (FQ) del páncreas y compromiso pulmonar crónico con bronquiectasias. Como causa de muerte observamos que las vías aéreas de mediano y pequeño calibre están en su mayoría obstruidas por tapones de moco y detritus, había además un compromiso bronconeumónico discreto.
Discusión
La FQ es la enfermedad autonómica recesiva letal, más frecuente de la raza blanca, donde una de cada 20 personas tienen una mutación genética y uno de cada 2.500 niños están afectados por la enfermedad. Las infecciones pulmonares recurrentes y la insuficiencia pulmonar progresiva son las manifestaciones clínicas más frecuentes y la causa de mortalidad en aproximadamente el 90% de estos pacientes.
En nuestra niña existían desde el interrogatorio inicial indicios clínicos para sospechar un diagnostico de FQ con síntomas respiratorios de tos persistente, neumonía, bronquiolitis recurrente y bronquiectasias; retardo del desarrollo, episodios diarreicos y síntomas generales, como sudoración salada e hipoproteinemia.
Aún más, en el transcurso de su hospitalización se le documentó alcalosis metabólica que incluso planteo un diagnostico de síndrome de Bartter. A pesar de haberse sugerido el diagnostico de FQ al ingreso de la paciente, fue rápidamente descartado cuando se obtuvo el resultado negativo del test de sudor.
La autopsia confirma sin lugar a dudas un FQ con cambios patognomónicos en el páncreas, donde hay severa fibrosis, dilatación quistíca de acinos y ductos y grandes tapones de moco espeso sin inflamación asociada (figura No 1).
Otros hallazgos importantes
Otros hallazgos importantes son, el taponamiento de las vías aéreas por moco y detritus (figura No.2) y la presencia a los 6 meses de edad de bronquiectasias en el lóbulo medio derecho. Además de estos cambios mayores hay otras alteraciones destrictas frecuentemente en la Fibrosis Quistica, aunque no especificas y son ellas: esteatosis hepática, mucocele de la vesícula biliar y ectasia tubular renal.
Es importante entonces discutir el porqué puede aparecer un test de sudor negativo en un paciente con una enfermedad de Fibrosis Quistíca tan florida. Partimos de la base de está aceptado que un porcentaje menor de pacientes (1-2%), pueden tener la enfermedad con una iontoforesis normal.
En la década de los ochenta se encuentra ya casos de pacientes con FQ típica pero con valores normales de electrolitos con sudor. Dichos casos informan que los pacientes con FQ no asociada a insuficiencia pancreática tienen concentraciones de sodio y cloro menores que aquellos que si tienen insuficiencia del páncreas y sugieren que en estos pacientes las glándulas sudoríparas pueden funcionar distinto.
Proponen que representaría un grupo especial de pacientes con FQ que difieren de los otros genotipicamente, bien en un locus o con respecto a algún gen modificador.
Identificación del gen
En la década de los 90 se empieza a hablar de los resultados obtenidos en los últimos 10 años de estudio, con la identificación del defecto bioquímico de la FQ y del gen responsable con su producto, el gen regulador de la conductancia transmembrana de la FQ (gen CFTR.
En 1990 Highsmith y cols nuevamente hablan de pacientes con FQ y concentraciones normales de cloro en sudor, asociándolos a una mutación puntual en el Intron 19 del gen CFTR.
Es así como cada vez más estamos encontrando informes de pacientes que teniendo la enfermedad clínicamente, se presentan con test de electrolitos en sudor en valores límites o normales. En la actualidad ya se están haciendo genotipificación a la mayoría de los pacientes en estudio para FQ.
Mutaciones de gen asociadas a fibrosis quística
Hay al menos 500 mutaciones del gen CFTR asociadas con FQ y se conoce que aproximadamente al 1% de los enfermos no se les encuentra anomalía genética y que aproximadamente el 18% solo tienen un gen anormal. Incluso existiendo dos genes anormales, el paciente puede tener una segunda mutación neutralizante en cualquier parte.
Es así como pacientes homocigotos para D F508 tienen concentraciones normales de electrolitos, si tienen una segunda mutación presente del tipo R553Q.
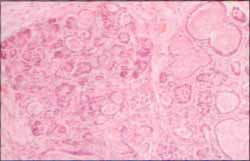
Figura No. 1 Aspecto del páncreas con extensa fibrosis y dilatación quística de acinos y conductos, ocupados por moco espeso.(10x)
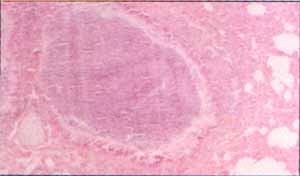
Figura No.2 Bronquilo dilatado, con pérdida del cartílago y tapón de moco y detritus que ocupa por completo su luz.(10x)
Problemas para el diagnóstico
Otro problema que existe para el diagnóstico, que es de mayor importancia para nuestro medio y posiblemente relevante para nuestro caso, es la realización del test de sudor. La genotipificación apena está siendo introducida en el país y es así como en la mayoría de las instituciones el diagnóstico se basa solamente en el cuadro clínico respaldado por un test de sudor positivo.
Estudios en la fundación Nacional para la FQ en Estados Unidos han determinado que el test cuantitativo de iontoforesis con pilocarpina tiene excelentes resultados y aun que discuten otros métodos como el electrodo cutáneo (tes de orion)y el aparato de conductivida (test de Medtherm) , concluyen que siendo tan importante el diagnosticode FQ, nose debe basar en un hallazgo de laboratorio y sugiere que cuando exista un fuerte sospecha de FQ, él medico debe referir su paciente a un medico consultor especialista y el estudio iontoforetico a un laboratorio con alta experiencia en este tipo de exámenes.
Múltiples factores influyen en la exactitud del test y son ellos: una muestra inadecuada o insuficiente, errores técnicos de evaporación o contaminación y errores en la calibración de los instrumentos, la dilución o en el reporte de los resultados.
Pueden además existir errores por la mala interpretación de un resultado obtenido, dado por el desconocimiento del método utilizado por el laboratorio, o por no repetir el examen cuando el resultado es poco conclusivo, cuando él diagnostico de FQ no tiene el curso clínico esperado, o como en este caso, por no repetir el examen cuando el resultado negativo no es consistente en el cuadro clínico.
Falsos negativos y falsos positivos
Los falsos negativos y los falsos positivos se han calculado en cifras de 15 y 12% respectivamente.Dentro de las cuales de un falso positivo hay una serie de enfermedades que aumentan la concentración de electorcitos tales como anorexia nerviosa, dermatitis atopica, colestasis familiar, enfermedades metabólicas como glucogénesis tipo l, fucosidosis o mucopolisacaridosis, insuficiencia adrenal o hipotiroidismo no tratado, entre otras.
El falso negativo se debe más frecuente a errores metodológicos o técnicos, a edema y a cantidad inadecuada del sudor recolectado. En este paciente hay dos factores que pueden haber influido en el falso negativo, el edema (establa en anasarca) y la recolección de la muestra que se procesa fuera de a institución, haciendo más probable la evaporación.
Es también importante antes de aceptar un test como negativo, corroborar que se haya obtenido un volumen adecuado. La concentración de electrolitos en sudor está relacionada con la rata de sudoración; Cuando disminuye la sudoración disminuye la concentración de electroncitos y puede obtenerse un falso negativo.
La muestra mínima aceptable, cuando se toma de un solo sitio en una gasa de 6×6 cm o en un papel de filtro usado para estimulación y recolección, es de 75mg, recogida en 30 minutos.
Si no se recoge la cantidad suficiente, es importante no intentar prolongar el tiempo de recolección pues aumenta la probabilidad de evaporación de la muestra, y en la practica, no aumenta significativamente la cantidad de sudor recolectado.
Paciente con FQ que no cumple con los criterios diagnósticos
Este caso ilustra muy bien el paciente que teniendo una FQ no cumple los criterios diagnósticos establecidos. Concentraciones de elactrocitos en sudor persistentemente elevados, características clínicas de enfermedad pulmonar crónica y/o insuficiencia pancreática (algunos autores proponen además incluir en pacientes de sexo masculino la azoospermia obstructiva y una historia familiar de la enfermedad.
Se presenta para recordar que aunque no se encuentren presentes los criterios tradicionales, el diagnóstico de FQ no puede ser definitivamente excluido en pacientes altamente sospechosos de tener la enfermedad.
En ellos el diagnostico debe confirmarse usando todos los métodos posibles para iniciar tempranamente el tratamiento y una conserjería genética. Igualmente en todos los otros pacientes el diagnostico debe ser excluido con la mayor certeza posible, recordando que es frecuentemente difícil y ocasionalmente hacerlo.
Bibliografía
Mariano CR, Gorelick FS, Scientific advances in cystic fibrosis. Gastroenterology 1992;103:681-93. Oppen heimer E. H Esterly JR
Pathology of Cystic Fibrosis. Revieww of the Literature and Comparison with 146 Autopsied Cases. Perspectives in Pediatric Pathology. Year Book, 1975;2:241-75.
Stern RC. Et al: Intermediate range sweat chloride concentration and Pseudomonas bronchitis: a cystic fibrosis variant with preservation of exocrine pancreatic function JAMA 1978;239:2676-80
Davis PB, Hubbard VS, Sant´agnese PA. Low Sweet Electrolytes in a patient with Cystic Fibrosis. A J Med. 1980;69:6436-46.
Highsmith WE,et al. A novel mutation in the cystic Fibrosis gene in patients with pulmonary disease but normal sweat chloride concetrations. N Engl J Med. 1994;331:974-80.
Strong TV et al, Cystic fibrosis gene mutation in two sisters with mild disease and normal sweat electrlyte levels. N Engl J Med. 1991;325:1630-4.
Augarten A et al, Mild cystic fibrosis and normal or borderline sweat test in patients with the 31849+10kb C-T mutation, Lancet 1993;342:25-6.
Zielenski J, Tsui LC. Cystic Fibrosis. Genotypic and Phenotypic variations. Annu Rev Genet 1995; 29:777-807.
Stern RC. et al: The Diagnosis of Cystic Fibrosis: N Engl: J Med: 1997; 336:487-91.
Denning CR. Et al. Cooperative study Comparing three Methods of performing sweet tests to Diagnose Cystic Fibrosis. Pediatrics 1980;66:752-7.
LeGrys VA, Sweet testing for the diagnosis of Cystic fibrosis: Practical considerations. J. Pediatric 1996;129:892-7.
Stern Rx, Boat TR, Doershuk. Obstructive azoospermia as diagnostic criterion for the cystic fibrosisi syndrome. Lancet 1982:1:1401-4.