Resumen
El SDRA del adulto es una entidad caracterizada por un compromiso difuso de las superficies epiteliales y endoteliales del pulmón, mediado por gran cantidad de citoquinas, que puede finalizar en falla respiratoria como consecuencia de un proceso de fibroproliferación originando partir de los miofibroblastos activados del intersticio, los cuales pueden alcanzar la luz alveolar gracias a la solución de continuidad en la membrana basal, produciendo una matriz que se colorea para fibronectina y colágeno lll.
La progresión hacia el estado de fibroproliferación se caracteriza funcionalmente por un fracaso por parte de la peep para mejorar la oxigenación, por una distensibilidad disminuida y por un aumento en la resistencia vascular; clínicamente el cuadro puede simular una neumonía nosocomial.
Un aumento en el recuerdo de neutrófilos del lavado bronquioloalveolar caracteriza el curso temprano del SDRA, recuento que de permanecer elevado en la primera o segunda semana que sigue al evento, se asocia con pobre pronóstico.
En el tratamiento, estudios preliminares sugieren que los esteroides podrían intervenir en el proceso de fibroproliferación, guardando relación con el pronostico. (Lea también: Características psicosexuales de las personas adultas con tuberculosis pulmonar)
Palabras clave: SDRA, fibroproliferación, esteroides.
Fase fibroproliferativa en S.D.R.A. Rev Colomb Neumol 2000;12:28-32
Guillermo Ortiz, MD *
*Coordinador Unidad de Cuidados Intensivos.
Hospital Santa Clara. E-mail Guillermo@hotmail.com
Summary
The SDRA in the adult is an entyti characterized by a diffused predicament of the epithelial and endothelial surfaces of the lung, mediated by a large amount of cytokines,which can result in respiratory failure.
This results as a consequence of a process of fibroproliferation originated from the activated miofibroblasts of the interstice , that which can reach the alveolar space thanks to the continuity solution in the basal membrane, producing a matrix that colors for fibronectin and collagen lll.
The progression toward a stste of fibroproliferation is characterized functionally by failure of the peep to improve the oxygenation, by a low distensibiity and by an augment in vascular resistance; clinically it could resemble nosocomial pneumonia.
An increase in the neutrophil count from the bronchial alveolar lavage characterizes the early onset of SDRA, a count which should stay elevated in the first or second week following the event, it is associated with a poor prognosis. In regards to the treatment, preliminary studies suggest that steroids can intervene in the process of fibroproliferation, staying in accordance with the prognosis.
Key words;SDRA,fibroproliferation, steroids.
Fibroproliferative phase in SDRA. Rev Colomb Neumol 2000;12:28-32
Introducción a la fase fibroproliferativa en SDRA
El S.D.R.A o síndrome de dificultad respiratoria del adulto es una entidad clínica y fisiopatológica caracterizada por un compromiso agudo y difuso de las superficies epiteliales y endoteliales del pulmón que llevan a los pacientes a falla respiratoria.
El termino S.D.R.A tardío se refiere a la fase clínica en que el pulmón intenta reparar el daño inicial o persistente en la superficie endotelial y epitelial del pulmón. La correspondiente fasehistoogicá es denominada, “fase fibroproliferativa “ la cual puede conducir al pulmón a una fibrosis intensa.
El lapso de tiempo escogido de manera arbitraria que divide el S.D.R.A temprano del tardío ha sido de 72 horas la mortalidad de los pacientes durante la fase tardía del S.D.R.A se relaciona de manera directa o indirecta con la fibroproliferación, dado que la mayor parte de las alternativas terapéuticas en el tratamiento de la fase aguda del S.D.R.A no ha sido exitosas, el interés se ha desplazado actualmente hacia modalidades terapéuticas que puedan inhibir la progresión de la fibrosis.
Fisiopatologia
La presencia de una cantidad de mediadores inflamatorios en la circulación sistemática y en el microambiente alveolar dan lugar a que se genere una compleja cascada de eventos que finalizaran con la injuria pulmonar aguda.
Las citoquinas son mediadores proteicos solubles secretados por células (efector) especificas que tienen como función primaria la habilidad de modificar el comportamiento de las células vecinas. En S,D,R,A., la mayor parte de las citomas son producidas por células normalmente presentes en el pulmón (macrófagos alveolares, neumocitos, células endoteliales, etc).
El papel de las citoquinas en las enfermedades pulmonares es cada día mas conocido. Citoquinas inflamatorias, como son el caso de factor de necrosis tumoral y las interleuquinas Ll 1,6 Y 8 se han encontrado en grandes concentraciones en las fases tempranas y tardías del S.D.R.A.
Excesiva fibroproligeración en el SDRA
Se han formulado hipótesis entorno a que la excesiva fibroproliferación en el S.D.R.A es el resultado de la injuria persistente. Datos recientes sugieren que el pronóstico de los pacientes con S.D.R.A tardío esta cercanamente relacionado con un aumento persistente de las citiquinas inflamatorias en el pulmón y en la circulación sistémica.
Esta inflamación persistente establece una respuesta inflamatoria crónica inespecífica que se caracteriza por la infiltración de células mononucleares, proliferación de fibroblastos y fibrosis. Los efectos de las citoquinas inflamatorias varían con el tiempo.
En las fases tempranas de S.D.R.A, su acción es ejercida sobre un parénquima pulmonar normal, llevando a un aumento de la permeabilidad endotelial y epitelial; los efectos de estas mismas citoquinas sobre una arquitectura anormal llevan a la fibropoliferación.
El elemento clave en la evolución hacia la fibroproliferación es la integridad de la membrana basal endotelial y epitelial. La presencia de una membrana basal intacta es esencial para la adecuada reparación de un pulmón lesionado.
La habilidad para reparar la membrana basal es una resultante de la severidad del daño inicial y/o la injuria persistente, los cuales perpetúan el proceso reparativo y lo tornan inefectivo. En los pacientes con S.D.R.A que han fallecido, se ha demostrado en lavados broncoalveolares y en el suero, el aumento persistente de componentes de la matriz extracelular, indicando un proceso de fibrogenesis.
Histología
El cuadro morfológico normalmente visto en el S.D.R.A corresponde al “daño alveolar difuso”, esta apariencia histológica es temporal y puede ser dividida en tres fases que se relacionan y se sobre ponen.
Esta son, la fase exudativa del edema y hemorragia, la fase proliferativa de organización y reparación y por último, la fase fibrotica. La fase tardía (proliferativa y fibrótica) es una relación proiferativa estereotipada que se caracteriza por el remplazo de las células epiteliales dañadas y la acumulación de células mesenquimatosas y sus productos en los espacios aéreos.
En una minoría de pacientes se observa una rápida progresión a una fibrosis pulmonar que conduce a la muerte por falla respiratoria.
La fibroproliferación es un proceso difuso, como lo han mostrado los estudios con TAC de alta resolución, la inspección durante la cirugía y los análisis microscópicos de diferentes lóbulos pulmonares. Sin embargo existe cierta heterogeneidad regional y ocasionalmente se encuentran áreas de parénquima pulmonar normal.
Las soluciones de continuidad focales en la membrana basal permiten la comunicación directa entre el intersticio y el espacio aéreo. Los miofibroblastos activados del intersticio migran hacia el alveolo en respuesta a señales quimiotacticas y se adhieren a la superficie luminal de la membrana basal dañada.
Fibronectina en pacientes con SDRA
La fibronectina y el factor de crecimiento derivado de las plaquetas que tienen gran actividad quimiotactica para los miofibroblastos han sido encontrados en los espacios aéreos de pacientes con S.D.R.A. tardío.
Estudios inmunohistoquimicos han demostrado que casi todos los miofibroblastos que se encuentran en el alveolo se tiñen intensamente para procolageno lll y la matriz recientemente producida se colorea para fibronectina y colágeno lll, mientras que los miofibroblastos que se encuentran presentes en el intersticio no están secretando activamente colágeno mientras no migren hacia los alvéolos.
Varios factores solubles presentes en los procesos inflamatorios, como es el caso del factor de necrosis tumora y la interluquina –1, pueden inducir, por parte de las células parenquimatosas, la liberación de factores de crecimiento para células mesenquimales.
El grado de fibroproliferación en las primeras 2 semanas no predice la función pulmonar tardía entre los pacientes que sobre viven u un S.D.R.A, sin embargo se han descrito casos fatales en los cuales el contenido de colágeno de los pulmones aumenta hasta tres veces durante las primeras dos semanas, con el posterior desarrollo de fibrosis pulmonar.
Cuadro clínico de la fase fibroproliferativa en SDRA
En pacientes con S.D.R.A se han descrito múltiples factores predictores de pronóstico. La gran heterogeneidad de esta enfermedad, así como diferencias en las definiciones, en la población de pacientes estudiados y en los modos de tratamiento, ha traído como consecuencia algunas discrepancias entre los estudios.
La intensidad de el dao pulmonar agudo ha sido encontrada como predictor del mal pronostico. Otros autores sin embargo no han podido encontrar relación entre el compromiso pulmonar agudo y el resultado final.
El punto que parece estar mas claro es que aunque la mortalidad temprana se asocia al pronostico de la enfermedad que causo el S.D.R.A la mortalidad tardía esta relacionada de manera directa o indirecta con fibroproliferación.
Progresión del SRDA hacia el estado de fibroproliferación
La progresión del S.R.D.A hacia un estado de fibroproliferación se caracteriza clínicamente por un fracaso por parte de la presión positiva al final de la espiración (Peep) para mejorar la oxigenación, una disminución de la destinsibilidad pulmonar, sumados todo ello a un empeoramiento del infiltrado de ocupación alveolar en la placa de tórax.
Esta progresión dentro de la fase fibroproliferativa se caracteriza desde el punto de vista biológico, por la evidencia observada en muestras de laboratorio, consiste en un aumento de componentes de la matriz extracelular en el suero y en el lavado broncoalveolar (marcadores de síntesis de colágeno)
De manera directa la fibroproliferación puede progresar a fibrosis extensa con hipoxemia refractaria y/o hipercarbia, las cuales han sido implicadas como causa de muerte en el 15% al 40% de los pacientes con S,D,R,A , de manera indirecta, la fibroproliferación causa dependencia de la ventilación mecánica y compromete los mecanismos e defensa pulmonar, favoreciendo la aparición de neumonía.
La mayoría de las muertes que se suceden durante la fase tardía de el S.D.RA.están relacionadas con los procesos séptimos los cuales complican el curso de os pacientes entre un 40%-90%.
Hallazgos recientes muestran como la fibroproliferación es clínicamente indistinguible de una neumonía nosocomial. La fiebre y la leucocitosis están invariablemente presentes en ambas entidades, lo cual obliga tener criterios histológicos muy estrictos para su diferenciación.
El origen de la fiebre parece deberse a una estimulación hipotalamica a partir de citoquinas liberadas por el pulmón (Ll-1L-6, factor de necrosis tumoral), como respuesta al proceso inflamatorio de este órgano.
La persistencia de un aumento en las concentraciones sericas de citoquinas en los pacientes con S.D.R.A. que no sobrevivieron, sugiere el origen pulmonar de estas sustancias, abriendo un interesante campo para investigaciones futuras.
Cambios fisiológicos
La progresión de la fibroproliferación se caracteriza por una disminución de la distensibilidad estática, un aumento del espacio muerto y una incapacidad de obtener un reclutamiento alveolar con la PEEP27-28.
En las fases tempranas del S.D.R.A., la curva presión volumen tiene un contorno bifásico, caracterizado por la presencia de un punto de inflexión en el asa ascendente y una marcada histeresis, estas características se pierden durante la evolución del S.D.R.A.
El punto de inflexión se presenta al momento en que se realiza la apertura de unidades respiratorias previamente cerradas. En estados tardíos la presencia de fibroproliferación dentro de los espacios aéreos transforma estas unidades funcionales en sitios inefectivos para el intercambio gaseoso.
Dada su alta capacidad para el reclutamiento vascular, el hacho vascular pulmonar muestra alta capacitancia y baja presión, lo cual impide el aumento de la resistencia vascular pulmonar en S.D.R.A. tardío.
Ahora bien, ya que el proceso de fibroproliferación se asocia a remodelación del lumen de las arterias pulmonares la capacidad vascular pulmonar se ve severamente disminuida con aumentos leves del flujo. El grado de hipertensión pulmonar refleja la severidad del S.D.R.A.
Evaluación diagnóstica
Lavado broncoalveolar
El lavado broncoalveolar se refiere a un procedimiento diagnóstico y terapéutico consistente en la instalación y aspiración secuencial de una solución fisiológica (usualmente 100cc-200cc) a través de un fibrobroncoscopio acuñado en la vía aérea.
Con el lavado broncoalveolar se logra un complejo intercambio entre el segmento pulmonar lavado, el intersticio y la circulación pulmonar lavado,el intersticio y la circulación pulmonar.
En el curso temprano del S.D.R.A el lavado broncoalveolar se caracteriza por un aumento en la concentración de neutrofilos, el cual se correlaciona de manera directa con la severidad en la alteración del intercambio gaseoso, el grado de aumento de permeabilidad a las proteínas y la concentración de Ll-8en el lavado broncoalveolar.
La persistencia de un recuento aumentado de neutrofilos en el lavado broncoalveolar durante los días 7 y 14 del S.D.R.A se asocia a un pronóstico pobre; por el contrario la resolución y la mejoría se ve acompañada por una dramática disminución del recuento neutrofilico, con un aumento en el numero de macrófagos.
Durante la progresión de la fibroproliferación, dado el aumento de la permeabilidad vascular y epitelial, se favorece el paso de elementos formes como los neutrofilos y los glóbulos rojos del comportamiento intravascular al espacio aéreo alveolar a través de la succión negativa que se ejerce durante el lavado broncoalveolar.
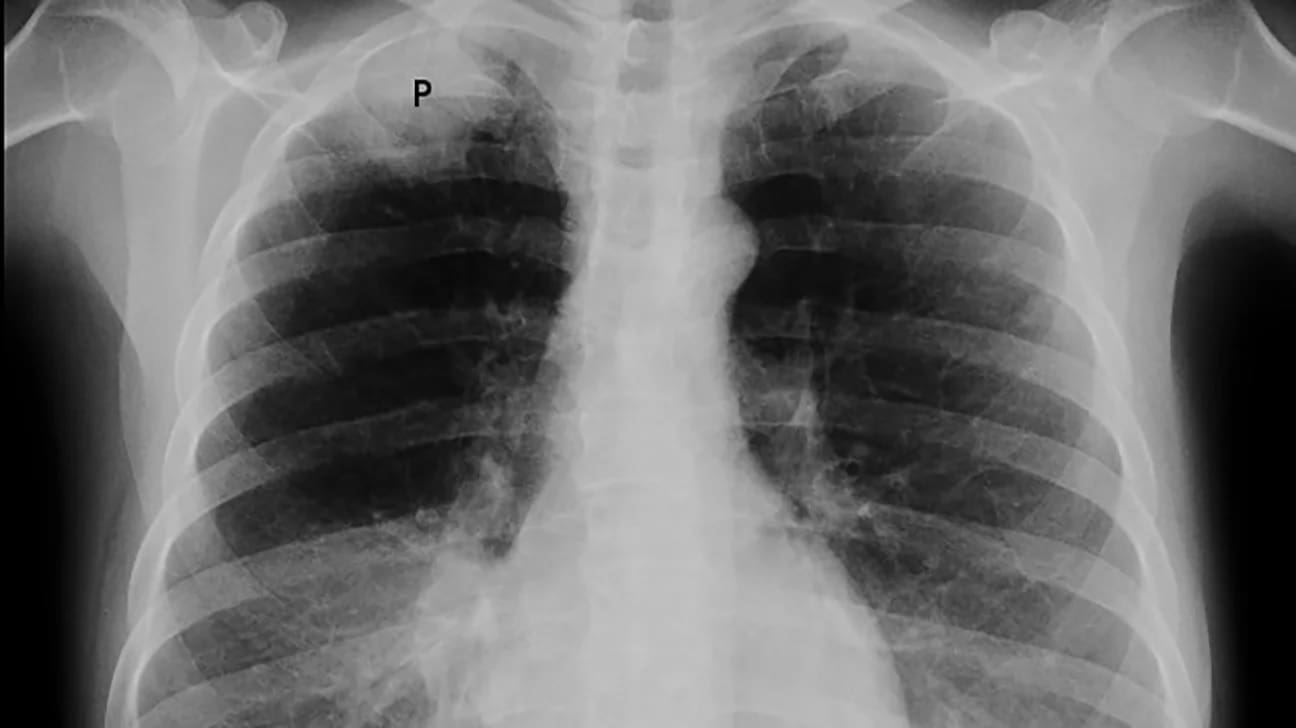
Placa simple de tórax
La placa simple de tórax es un componente integral de la monitoria diaria de un paciente con S.D.R.Aen la unidad de cuidados intensivos; algunos grupos han informado que la contraparte radiológica de la fase de fibroproliferación se caracteriza por la presencia de infiltrados alveolares difusos, menos pronunciados que la consolidación que se observa en las fases tempranas del S.R.D.A, con la asociación de infiltrados de tipo intersticial.
Vale la pena aclarar que ningún patrón radiológico identifica una neumonía nosocomial en un paciente con S.D.R.A en fase fibroproliferativa y fiebre.
En un estudio publicado por el Dr Meduri en el cual se pretendía de manera prospectiva investigar la causa de la fiebre en 20 pacientes con S.D.R.A tardío, se encontró que la fibroproliferación (con diagnóstico histológico) fue la causa de fiebre en solamente 25% de los casos, en el resto de pacientes otras fuentes de infección pulmonar y extrapulmonar eran las responsables.
Esto nos lleva a conducir que él diagnostico rápido y correcto de las posibles fuentes de fiebre en estos pacientes disminuye la confusión diagnostica y permite el uso racional de la antibioticoterapia.
Estrategias de tratamiento
La intervención terapéutica en el S.D.R.A, tanto en fase temprana como en fase tardía, puede dividirse en aquellas modalidades que tienen como objetivo el soportar y sostener las funciones vitales, como es el caso de la ventilación mecánica, y aquéllas dirigidas a resolver el proceso mismo.
Los corticoiteroides han sido usados en la fase tardía del S.D.R.Acon el objetivo de resolver o mejorar la fibroproliferación. Se han investigado los efectos de la terapia asteroidea en altas dosis (metilprednisolona 2-3mg/kg/día) en 25b pacientes con S.D.R.A tardío (promedio de ventilación mecánica 15+/-7 días) y fibroproliferacion progresiva, caracterizada por empeoramiento en el intercambio gaseoso y en la mecánica pulmonar.
En todos los pacientes se realizaron los estudios necesarios para descartar infección y en 13 de ellos se confirmo el diagnostico de fibroproliferación por biopsia abierta de pulmon. Se observó una marcada mejoría desde el punto de vista de la oxigenación y de la mecánica pulmonar en 21 pacientes con tasa de sobrevida de 86%en el grupo respondedor frente al 15% en el grupo que no respondió, a la terapia esteroides, indicando que el pronostico tiene relación con la resolución de la fase fibroproliferativa.
Los datos relacionados con él pronostico del S.D.R.A.tardío tienen una directa relación con los procesos de injuria y reparación durante el transcurso de la enfermedad; se cree que el insulto permanente torna el proceso de reparación inefectivo, causando una prolongación del tiempo que dura el paciente sometido a ventilación mecánica, aumentando así las probabilidades para el desarrollo de infecciones pulmonares y extra pulmonares. Estudios preliminares sugieren que los esteroides podrían intervenir en el proceso de fibroproliferacion.
Bibliografía
1. Mogomery AB, Stager MA,Carrico CJ et al: Causes of mortality in patients with the adult respiratory distress syndrome. Am Rev Respir Dis 1985; 132:485-9
2. Suter PM,Suter S, Girandin E, et al: High bronchoalveolar levels of tumor necrosis factor and its inhibitors, interleukin 1, interferon and elastase, in patients with adult respiretory distress syndrome after trauma, shock or sepsis. Am Rev Respir Dis 1992;145:1016-22
3. Snyder LS, Hertz Ml Harmon KR, et al: Failure of lung repair following acute lung injury, Regulation of the fibroproliferative response (part 1) . Ches 1990;98:733-8
4. Marks JD,Marks CB, Luce JM, et al: Plasma tumor necrosis factor in patients with septic shock. Mortality rate, incidence of adult respiratory distress syndrome, and effects of methylprednisolone administration. Am Rev . Respir Dis 1990;141:94-7
5. Kelly J: Cytokines of the lung. Rev Respir Dis 1990;141:765-88
6. Headley S, Meduri GU, Stentz F, et al: Unfaborable outcome in patients with ARDS is relate to persistent release of inflammatory cytokines. Abstr. Chest 1993;104(suppl): 15S
7. Chollett-Martin S, Montravers p, Gilbert C, et al:Increased Ll-8levels in plasma and bronchoanveolar lavage fluid during the adult respiratory distress syndrome. Abstr. Am Rev Respir Dis 1992;145:A453
8. Millar AB, Singer M, Meager A, et el: Tumour necrosis factor in bronchopulmonary secretions of patients with adult respiratory distress syndrome. Lancet 1989;712-14
9. Meduri GU et al: Late adult Respiratory Distress Syndrome. Soc.Crit Care Med 1993;563-77
10. Kohler G,Meduri GU, Stenz F, et al: Inflammatory cytokines in the BAL of ARDS. Abstr. Chest 1993;104(Suppl) : 151S
11. Pinski MR, Vincent JL, Deriere J, et al: Serum cytokine organ failure and mortality. Chest 1993;103:565-75
12. Entzian P, Huckstadt A, kreipe H, et el: Determination of serum concentrations of serum concentrations of type lll procollagen peptide in mechanically ventilated patients. Pronounced augmented concentration in the adult respiratory distress syndrome. Am Rev Respir Dis 1990;142:1079-82
13. Waydhas C, Nast-Kolb D, Trupka A, et al: Increased serum concentrations of procollagen type lll peptide in severely injured patients: An indicator of fibrosis activity? Crit Care Mad 1993;21:240-7
14. Clark JG, Milberg JA, Stenberg KP, et al:Elevated levels of N-terminal peptide of type lll procollagen in bronchoalveolar lavege are associated with increased fatality in adult respiratory distress syndrome. Abstr. Am Rev Reapir Dis 1993;147:A356
15. Tpmasheski JF Jr: Pulmonary pathology of the adult respiratory distress syndrome. Clin Chest Med 1990;11:593-619
16. Lamy M. Fallat, RL, Koeniger E, et al: Pathologic features and mechanisms of hipoxemia in adult respiratory distress syndrome. Am Rev Respir Dis 1976;114:267-284
17. Zapol Wm, Trelstad RL, Coffey JW, et al: Pulmonary Fibrosis in severe acute respiratory failure. Am Rev Resir Dis 1979;119:547-54
18. Kuhn C lll, Boldt J, King TE Jr, et al: An immunohistochemical study of architectural remodeling and connective tissue synthesis in pulmonary fibrosis. Am Rev Respir Dis 1989;140:1693-1703
19. Snyder LS, Hertz Ml, Harmon KR, et al:Failure of lung repair following acute lung injury. Regulation of the fibroproliferative responce (part 2) . Ches 1990:98:989-93
20. Suchyta MR, Elliot CG,Colby T, et al: Open lung biopsy does not correlate with pulmonary function after the adult respiratory distress syndrome. Chest 1991;99:1232-7
21. Bernard GR, Rinaldo J, Harris T, et al: Early predictors of ARDS reversal in patients with established ARDS. Abstr. Am Rev Respir Dis 1991;143:A143
22. Suchita MR, Clemmer TP, Elliot CG, et al;The adult respiratory distress syndrome. A report of survival and modifyng factors. Chest 1992;101:1074-9
23. Bone RC,Balk R,Slotman G, et al: Adult respiratory distress syndrome. Sequence and importance of development of multiple orgn failure. Chest 1992;101:320-6
24. Fowler AA, Hamman RF, Zerbe GO, et al:Adult respiratory distress syndrome. Prognosis after onset. Am Rev Respir Dis 1985;132:472-8
25. MeduriGU, Diagnosis of ventilator-associated pneumonia.Infect Dis Clin North Am 1993;7:295-329
26. MeduriGU, BelenchiaJM, EstesRJ, et al: Fibroproliferative phase of ARDS. Clinical findings and effects of corticosteroids. Chest 1991;100:943-52
27. Shimada y,Yoshiya l, Tanakak et al: Evaluation of the progress and prognosis of adult respiratory distress syndrome. Simple respiratory physiologic measurement.Chest 1979;76:180-6
28. Matamis D. Lemaire F, HarfA, et al;Total respiratory pressure-volume curves in the adult respiratory distress syndrome. Chest 1984;76:180-6
29. Holzapfel L, Robert D, Perrin F, et al;Static pressure-volume curves and effect of positive end-expiratory pressure on gas exchange in adult respiratory distress syndrome. Crit Care Med 1983;11:591-7
30. Pesenti A,Marcolin R, Prato P, et al;Mean airway pressure vs positive end-expiratory pressure during mechanical ventilation. Crit Care Med 1985;13:34-7
31. Zapol WM, SniderMT: Pulmonary hypertension in severe acute respiratory failure. N Engl J Med 1977;296:476-80
32. Kelli CA, Fenwick JD, Corris PA, et al:Fluid dynamics during bronchoalveolar lavage. Am Rev Respir Dis 1988;138:81-4
33. Weiland JE, Davis WB, Holter JF, et al: Lung neutrophils in the adult respiratory distress syndrome. Am Rev Respir Dis 1986;133:218-253
34. Winer-Muram HT,Rubin SA, Miniati M,et al:Guidelines for reading and interpreting chest radiographs in patients receiving mechanical ventilation. Chest 1992;102:565S-70S
35. Meduri GU: Ventilator-associated pneumonia in patients withnrespiratory failure. A diagnostic approach. Chest 1990;97:1208-19
36. Chinn A, Meduri GU, Leeper K, et al:Corticosteroid rescue treatment of progressive fibroproliferations in late ARDS. Patterns of response and predictors of out come. Chest, In Press.