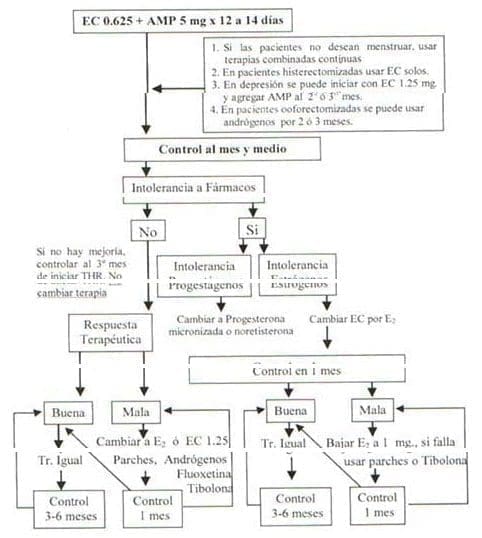
En la Fig 2 mostramos las pautas terapéuticas, señalando las diferentes conductas según la respuesta que tenga la paciente al tratamiento. Iniciamos la terapia con 0.625 mg de estrógenos conjugados todos los días, agregando 5 mg de acetato de medroxiprogesterona durante 12 a 14 días. Preferimos utilizar estrógenos conjugados, en lugar de estradiol oral, por su largo tiempo de uso clínico, porque la mayoría de las investigaciones que señalan los efectos positivos de la THR están realizados con este tipo de estrógenos y porque tienen mejor tolerancia
Figura 2. Pautas terapéuticas
En mujeres jóvenes, cercanas a los cuarenta años, que presenten bochornos y/o trastornos del ánimo, el uso de estrógenos transdérmicos durante seis meses puede ser adecuado, ya que atenúa las oscilaciones propias de la transición menopáusica; incluso en aquellas con ciclos irregulares el uso de estrógenos transdérmicos puede regularizarlos una vez suspendidos28. Si estas mujeres vuelven a presentar sintomatología una vez suspendida la terapia, es el momento de iniciar la terapia hormonal en forma definitiva.Los progestágenos pueden inducir síntomas similares al síndrome premenstrual25, razón por la cual en pacientes severamente deprimidas, ocasionalmente preferimos indicarles, aunque exista útero, estrógenos solos en los dos o tres primeros meses. No existe base científica para el uso de progesterona en las pacientes histerectomizadas26. En aquellas, que no deseen tener sangrados vaginales podemos indicar la asociación continua de estrógeno y progesterona; esta alternativa no la aconsejamos en mujeres jóvenes porque presentan una alta incidencia de sangrados irregulares27.
Los andrógenos asociados a los estrógenos son una excelente alternativa para iniciar el tratamiento a pacientes con síntomas climatéricos severos, especialmente en aquellas que han sido ooforectomizadas29; les prescribimos durante uno a tres meses y luego cambiamos a las terapias convencionales.
Los anticonceptivos orales en esta etapa de la vida se indican poco por el temor, tanto de los médicos como de las usuarias, a que aumenten el riesgo de enfermedad cardiovascular; sin embargo, los anticonceptivos con bajo contenido de estrógenos han demostrado ser seguros y efectivos en mujeres mayores de 40 años, evitando no sólo los embarazos no deseados y su secuencia de riesgos materno-fetales, sino también los sangrados perimenopáusicos, la dismenorrea, la pérdida de masa ósea y el riesgo de cáncer endometrial y ovárico30.
Una situación especial es la mujer con alto riesgo de cáncer de mama. El Instrumento para la Evaluación del Riesgo de Cáncer de Mama desarrollado por el Instituto Nacional del Cáncer de EE.UU. (https://bcra. nci.nih.gov/brc/) nos permite detectar a aquellas mujeres con mayor riesgo.
Se considera expuesta la mujer que tenga más de 1.6% de probabilidad de desarrollar cáncer en los próximos cinco años. También debemos considerar la densidad mamográfica; un reciente estudio de Salminen que siguió a más de cuatro mil mujeres de 40 a 47 años durante ocho años, señaló que la densidad aumentada significaba un riesgo 11 veces mayor de desarrollar cáncer de mama en las usuarias de THR31. En ambos casos preferiremos usar terapias alternativas a los estrógenos; si no hay bochornos podremos indicar tamoxifeno en dosis de 20 mg/día, ya que se ha demostrado que su uso durante cinco años disminuye el riesgo en un 49% la probabilidad de desarrollar cáncer de mama en mujeres con alto riesgo32. La tibolona también parece tener algún rol protector en la mama; Gompel mostró en cultivo de células epiteliales mamarias humanas normales y cancerosas que la tibolona disminuye la proliferación y aumenta la diferenciación y la apoptosis, tres mecanismos responsables de la homeostasis celular de la mama33.
En relación con los exámenes diagnósticos, consideramos que una gran cantidad de exámenes implica un costo que no siempre los servicios de salud o la paciente estarán en condiciones de financiar, lo que puede implicar un costo importante e impedir que pueda seguir el tratamiento; en este contexto, pedimos escalonadamente los exámenes. En la primera consulta solicitamos mamografía y perfil lipídico. Además, recomendamos estilos de vida sanos y explicamos los riesgos y beneficios de la terapia en cada caso en particular.
El control de la Terapia
Una vez indicada la terapia, controlamos al mes y medio para evaluar la tolerancia al fármaco. La mastodinia es una de las principales quejas de las pacientes que reciben THR34, por lo que es conveniente advertirles en la primera consulta que tendrán esta molestia de uno a tres meses y que luego desaparecerá. Con el fin de evitar el abandono de la terapia.
La THR, además de la mastodinia, origina síntomas secundarios no deseables. Este tema prácticamente no figura tratado específicamente en la literatura médica, aunque algunos estudios han estimado que entre el 23 al 36% de las mujeres con THR tienen síntomas y/o signos adversos, distintos a los sangrados, atribuibles a la terapia35. Esta alta prevalencia de efectos colaterales de corto plazo no debiera sorprendernos, ya que tanto la administración de estrógenos como la de progestágenos puede provocar síntomas en algunas pacientes.
Los niveles plasmáticos de estrógenos en la usuarias de THR que reciben un mismo tratamiento pueden variar entre 35 a 130%; esta gran variabilidad en la biodisponibilidad se observa con cualquier tipo de estrógeno, de formulación o de ruta de administración y es consecuencia de las diferencias individuales en la depuración metabólica (clearance) de los estrógenos36. Niveles plasmáticos de estradiol inferiores a 40 pg/ml se asocian a trastornos del ánimo, del sueño y fatigabilidad37; niveles superiores a 150 pg/ml, como los observados en la mitad de la fase luteal, se presentan con mastodinia, variaciones del ánimo e hinchazón38. Los niveles bajos explican la sintomatología climatérica que observamos en la menopausia y los niveles altos la intolerancia a los estrógenos que se aprecia con la THR.
En nuestra experiencia clínica hemos tenido que reducir, en algunas pacientes, la dosis a 12.5 ug de estrógenos transdérmicos para que los toleren y hemos visto casos en que son ellas mismas las que han subido la dosis a 200 ug para dominar los bochornos. Los síntomas que nosotros vemos como característicos de la sobredosis de estrógenos, pero que a la fecha nadie ha descrito científicamente, son: sensación de palpitación cardiaca, mareos, nauseas, crisis de pánico, sensación de muerte, dificultad respiratoria y curiosamente bochornos; este último síntoma nos llevó en varias ocasiones a subir las dosis de estrógenos sin lograr resultados positivos
En algunas mujeres estas molestias pueden alcanzar gran intensidad y al suspender la terapia, muchas veces por ellas mismas, la sintomatología desaparece. Se ha estimado que entre 40 a 50% de las mujeres obtendrán beneficios con el uso de dosis distintas a las corrientes, las cuales se han establecido con base a resultados promedio36. El ajuste de la dosis se hace de acuerdo a la respuesta clínica de cada paciente; si hay síntomas de déficit, deberíamos subir las dosis; si la clínica sugiere sobredosis, bajarlas. La medición de los niveles plasmáticos de estrógenos es sólo efectiva en la terapia transdérmica; el objetivo en este caso es alcanzar una media de 100 pg/ml, no saliéndonos del rango de 40 a 150. Otra forma de enfrentar los síntomas adversos de los estrógenos es cambiar el tipo de estrógenos, frecuentemente basta esta modificación para que desaparezcan las molestias.
Más conocida es la intolerancia a los progestágenos. Con cierta frecuencia se observan pacientes que cuando usan THR presentan síntomas adversos mientras toman los progestágenos; las molestias que se observan más frecuentemente son cefaleas y trastornos del ánimo, resultado de los efectos neuroquímicos de la progesterona en el sistema nervioso central; también se pueden presentar síntomas de retención de líquido como consecuencia de la retención de sodio que producen los progestágenos por sus efectos en el sistema renina-aldosterona39. No podemos bajar las dosis porque perdemos protección endometrial; dosis secuenciales de 2.5 mg de acetato de medroxiprogesterona no son efectivas40. Para evitar los efectos secundarios se debe cambiar el tipo de progestágeno o la vía de administración; una buena alternativa es la progesterona micronizada que produce menos síntomas adversos, tiene mejor acción a nivel de lípidos y puede usarse la misma cápsula por vía oral o vaginal41. Cuando hay hipertrigliceridemia y baja masa ósea podremos agregar a los estrógenos, progestágenos con acción androgénica como la noretisterona o usar tibolona, fármacos que por su leve acción androgénica bajan los triglicéridos y tienen mejor acción sobre el hueso que la medroxiprogesterona42-43.
En la Tabla 3 hemos esquematizado e integrado las acciones realizadas en las distintas consultas. En la primera, como señalamos previamente, evaluamos la necesidad de indicar terapia, la prescribimos si es necesaria, solicitamos mamografía, perfil lipídico y damos normas de estilos de vida sanos y educación a la paciente.
Tabla 3. Acciones en cada consulta de climaterio
Citamos a la paciente para una segunda consulta en mes y medio. En esta consulta evaluamos la tolerancia a la THR y la respuesta sintomática, que a esta altura puede ser escasa; no cambiamos la terapia si no se aprecia mejoría, ya que recién a los tres meses de THR la sintomatología sólo mejora en el 50% de los casos44. Si la mamografía es densa se complementa con ecotomografía mamaria. El ideal es que los niveles plasmáticos de LDL-colesterol estén por debajo de 160 mg/día o 130 mg/dl si hay dos o más factores de riesgo coronario asociado7; si el perfil lipídico tiene LDL superior a 160 mg/dl restringimos grasas de origen animal y lo controlamos en seis meses; normalmente con los estrógenos orales baja significativamente45; si a los seis meses de tratamiento no se logra bajar el LDL, es el momento cuando se indica un fármaco hipolipemiante, por ejemplo 10 mg/día de atorvastatina46. Si los triglicéridos se encuentran en niveles superiores a 200 mg/dl se restringen las calorías, especialmente los hidratos de carbonos, el tabaco, el consumo de alcohol y se indica aumentar la actividad física47; en general con estas simples medidas se normalizan los niveles plasmáticos; si fracasan, se toman otras alternativas para tratar la hipertriglicidemia tal como los estrógenos transdérmicos48, preparados con leve acción androgénica como la tibolona49 o mezclas estrogénicas con noretisterona50; si no logramos normalizar los triglicéridos deberemos indicar fibratos. En esta segunda consulta pedimos densitometría. Si hay síntomas de intolerancia a estrógenos o a progestágenos modificamos la terapia.
En el tercer control, que realizamos aproximadamente a los tres meses, evaluamos la respuesta terapéutica y si es pobre cambiamos la terapia de acuerdo a las pautas esquematizadas en la Fig 2. Aunque no tenemos respaldo científico, cuando no se producen menstruaciones con la terapia secuencial y la respuesta terapéutica ha sido insuficiente, cambiamos el estrógeno conjugado a estradiol o subimos la dosis de estrógenos conjugados a 1,25 mg, porque hemos observado que las pacientes que no responden con sangrados tienen frecuentemente asociados signos de hipoestrogenismos como adinamia, sequedad vaginal, trastornos del sueño y bochornos. Si la densitometría ósea tiene una T por debajo de 2 DE ó Z debajo de 1 DE, agregamos además de dos tazas de leche, 500 mg de calcio en la noche. Un porcentaje de mujeres con terapia de reemplazo hormonal continúan con su pérdida ósea a pesar del tratamiento51, por lo tanto es necesario controlar el resultado terapéutico con otra densitometría, al año con ultrasonido de falange o las dos con DEXA. En cuanto a los exámenes de apoyo diagnóstico en este control solicitamos la ecotomografía transvaginal postmenstrual y PAP.
En la cuarta consulta, entre cinco a seis meses de iniciado el tratamiento, evaluamos la respuesta terapéutica y si a esta altura no hemos logrado hacer desaparecer la sintomatología climatérica u observamos que algunos síntomas reaparecen, lo que no es inusual, cambiamos la terapia. Un concepto central es que no hay que indicar terapia, hay que mejorar las condiciones de salud de la paciente; no porque una paciente utilice THR está bien. Debemos lograr una mejoría. Si nosotros hemos descrito que la calidad de vida de la mujer entre 40 y 60 años depende fundamentalmente de la función ovárica52, el reemplazo hormonal debiera recuperar la calidad de vida que la mujer tenía en la premenopausia. En esta consulta la paciente vuelve con su ecotomografía transvaginal53; después de varios meses de terapia debería haberse normalizado el grosor endometrial si previamente existía un estado proliferativo. No existen puntos de corte exacto para determinar cuando un endometrio puede ser anormal; es así como Archer encontró en mujeres con THR y que tenían informe de biopsia endometrial normal, que el grosor endometrial iba de 1 a 25 mm y cuando tenían patologías endometriales, el grosor fluctuaba entre 2.8 y 23 mm54. Brooks mostró en usuarias de THR que un grosor endometrial superior a 8 mm asociado a sangrados anormales era compatible con mayor patología endometrial55. Con estos antecedentes, consideramos como normal a una mujer cuyo grosor endometrial es menor de 10 milimetros y que no tiene sangrados vaginales anormales. Si el grosor endometrial fluctúa entre 10 y 15 mm, aumentamos la dosis de medroxiprogesterona a 10 mg/día; si a los seis meses no ha alcanzado a su nivel normal, indicamos citología o biopsia endometrial; igual conducta seguimos cuando hay sangrados anormales repetidos.
En las consultas posteriores continuaremos evaluando la calidad de vida de la paciente hasta lograr los máximos beneficios con la terapia. Debemos continuar vigilando el riesgo de cáncer de mama, la respuesta ósea al tratamiento y el riesgo cardiovascular. Especial énfasis damos, una vez controlada la sintomatología climatérica, al control de la obesidad y de la hipertensión arterial. Para tratar la obesidad es necesario el adecuado manejo nutricional (1200 calorías/día), el incremento de la actividad física (caminar 30 a 45 minutos tres a cinco veces por semana) y el uso de anorexígenos como la sibutramina (10 a 15 mg/día); la FDA de Estados Unidos ha aprobado a la sibutramina para tratar la obesidad como medida adjunta a la dieta y actividad física para pacientes con índice de masa corporal (peso/talla[m]2) superior a 30 cuando no existen factores de riesgo cardiovascular y superior a 27 cuando se asocia a hipertensión, diabetes, dislipidemia o enfermedad coronaria56. Un segundo aspecto a considerar es la hipertensión, una condición muy prevalente en la mujer postmenopáusica; así, en un examen de salud de 1200 mujeres trabajadoras encontramos que el porcentaje de hipertensas se eleva desde 6.6% entre las mujeres de 40 años a 48% en las de 60 años57; además, la hipertensión arterial es el principal factor de riesgo cardiovascular, la primera causa de mortalidad en la mujer; por lo tanto tratarla es básico para la calidad de vida en la vejez; la terapia antihipertensiva tiene por objeto llevar la presión arterial a menos de 140/90 y consiste en restricción calórica, de sodio y el uso de fármacos como diuréticos y/o betabloqueadores o inhibidores de ACE58.
Conclusión
La THR es un recurso terapéutico que debe utilizarse en cada paciente en forma individual, en quien se deben evaluar los beneficios y riesgos que ella tiene en cada caso en que se prescribe. Su uso implica no sólo la indicación de una hormona, sino que también el ajuste de la terapia a la paciente y la evaluación global de la salud y el tratamiento de otras enfermedades que afectan la expectativa y calidad de vida. Implica una conducta holística, en que el tratamiento farmacológico debe ir asociado a cambios en el estilo de vida y en su educación. Sólo así garantizaremos el seguimiento de la terapia y los beneficios que de ella esperamos para nuestras pacientes.
Referencias
1. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52,705 women with breast cancer and 108,411 women without breast cancer. Lancet 1997; 350 (9084): 1047-59
2. Alder E. The Blatt-Kupperman menopausal index: a critique. Maturitas 1998; 29: 19-24.
3. Greene JG. Constructing a standard climacteric scale. Maturitas 1998; 29: 25-31
4. Hans D, Dargent-Molina P, Schott AM, Sebert JL, Cormier C, Kotzki PO, Delmas PD, Pouilles JM, Breart G, Meunier PJ. Ultrasonographic heel measurements to predict hip fracture in elderly women: the EPIDOS prospective study. Lancet 1996; 348 (9026): 511-4
5. Stamler J, Daviglus ML, Garside DB, Dyer AR, Greenland P, Neaton JD. Relationship of baseline serum cholesterol levels in 3 large cohorts of younger men to long-term coronary, cardiovascular, and all-cause mortality and to longevity. JAMA 2000; 284(3): 311-8
6. Manolio TA, Pearson TA, Wenger NK, Barrett-Connor E, Payne GH, Harlan WR. Cholesterol and heart disease in older persons and women: review of an NHLBI workshop. Ann Epidemiol 1992; 2:161_76
7. U.S. Department Of Health And Human Services. Public Health Service. National Institutes of Health. Second Report of the Expert Panel on
8. Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel II) del National Cholesterol Education Program
9. NIH Publication Nº. 93-3096. 1993
10. Blumel JE, Brandt A, Garavagno A, Cubillos M y Lozano A. Mujeres postmenopáusicas: cambios de los lípidos plasmáticos con distintas terapias estrogénicas de reemplazo. Rev Médica Chile 1990; 118: 382-87
11. Tikkanen MJ. The menopause and hormone replacement therapy: lipids, lipoproteins, coagulation and fibrinolytic factors. Maturitas 1996; 23 (2): 209-16
12. Milner MH, Sinnott MM, Cooke TM, Kelly A, McGill T, Harrison RF. A 2-year study of lipid and lipoprotein changes in postmenopausal women with tibolone and estrogen-progestin. Obstet Gynecol 1996; 87 (4): 593-9
13. DiSaia PJ, Grosen EA, Kurosaki T, Gildea M, Cowan B, Anton-Culver H. Hormone replacement therapy in breast cancer survivors: a cohort study. Am J Obstet Gynecol 1996; 174 (5): 1494-8
14. Brewster WR, DiSaia PJ, Grosen EA, McGonigle KF, Kuykendall JL, Creasman WT. An experience with estrogen replacement therapy in breast cancer survivors. International journal of fertility and women’s medicine 1999; 44 (4): 186-92
15. Sutcliffe S, Pharoah PD, Easton DF, Ponder BA. Ovarian and breast cancer risks to women in families with two or more cases of ovarian cancer. International journal of cancer. Journal international du cancer 2000; 87 (1): 110-7
16. Burger HG. The endocrinology of the menopause. J Steroid Biochem Mol Biol 1999; 69(1-6):31-5
Santoro N, Brown JR, Adel T, Skurnick JH. Characterization of reproductive hormonal dynamics in the perimenopause. J Clin Endocrinol Metab
17. 1996; 81 (4): 1495-501
18. NAMS. A decision tree for the use of estrogen replacement therapy or hormone replacement therapy in postmenopausal women: consensus opinion of The North American Menopause Society. Menopause 2000; 7 (2): 76-86
19. U.S. Department of Health and Human Services. Physical Activity and Health: A Report of the Surgeon General. Atlanta, GA: Centers for Disease
20. Control and Prevention, National Center for Chronic Disease, Prevention and Health Promotion; 1996
21. O’Connell MB. Pharmacokinetic and pharmacologic variation between different estrogen products. J Clin Pharmacol 1995; 35 (9 Suppl): 18S-24S
22. Losonczy KG, Harris TB, Cornoni-Huntley J, Simonsick EM, Wallace RB, Cook NR, Ostfeld AM, Blazer DG. Does weight loss from middle age to old age explain the inverse weight mortality relation in old age?. Am J Epidemiol 1995; 141(4): 312-21
23. Oster G, Thompson D, Edelsberg J, Bird AP, Colditz GA. Lifetime health and economic benefits of weight loss among obese persons. Am J Public
24. Health Oct 1999 89 (10) p1536-42
25. Ventura V, Mauloni M, Mura M, Paltrinieri F, de Aloysio D. Ultrasound velocity changes at the proximal phalanxes of the hand in pre-, peri- and postmenopausal women. Osteoporos Int 1996; 6 (5): 368-75
26. Cavalieri TA. Management of osteoporosis in the new millennium. J Am Osteopathic Assoc 2000; 100 (1 Suppl): S16-20
27. Waldman TN. Menopause: when hormone replacement therapy is not an option. Part I. J Womens Health 1998; 7 (5): 559-65
28. Blumel JE. Climaterio: Manual de consulta rápida. Ed. Abaco. Santiago de Chile 1998; 58
29. Lauritzen C. HRT prescribing guidelines: dream or reality?. Int J Gynaecol Obstet 1996; 52 Suppl 1: S3-9
30. Smith RN, Holland EF, Studd JW. The symptomatology of progestogen intolerance. Maturitas 1994; 18 (2): 87-91
31. Blümel JE, Roncagiolo ME, Gramegna G, Vasquez R, Estartus A, Tacla F, Brandt A. Estudio doble ciego del efecto sobre la sintomatología menopáusica, el perfil lipídico y el grosor endometrial de una terapia continua de valerato de estradiol más acetato de medroxiprogesterona.
32. Rev Chilena Obstet Ginecol 1994; 59(5): 354-360.
33. De Leo V, Lanzetta D, D’Antona D, De Palma P. Transdermal estrogen replacement therapy in normal perimenopausal women: effects on pituitary-ovarian function. Gynecol Endocrinol 1996; 10 (1): 49-53
34. Sarrel PM. Psychosexual effects of menopause: role of androgens. Am J Obstet Gynecol 1999; 180 (3 Pt 2): 319-24
35. Van Winter JT, Bernard ME. Oral contraceptive use during the perimenopausal years. Am Fam Physician 1998; 58 (6): 1373-7
36. Salminen TM, Saarenmaa IE, Heikkilä MM, Hakama M. Is a dense mammographic parenchymal pattern a contraindication to hormonal
37. replacement therapy?. Acta Oncologica 2000; 39 (8): 969-72
38. Fisher B, Costantino JP, Wickerham DL, Redmond CK, Kavanah M, Cronin Wmet al. Tamoxifen for prevention of breast cancer: report of the
39. National Surgical Adjuvant Breast and Bowel Project P-1 Study. J Natl Cancer Inst 1998; 90 (18): 1371-88
40. Gompel A, Siromachkova M, Lombet A, Kloosterboer HJ, Rostene W. Tibolone actions on normal and breast cancer cells. Eur J Cancer 2000; 36 Suppl 4: S76-7
41. Perrone G, Barillaro F, Bazzoffi R, Capri O, Critelli C, Galoppi P, et al. Hormone substitution therapy. Side-effects and compliance of various therapeutic regimens. Minerva Ginecol 1999; 51 (3): 53-8
42. Rozenberg S, Ylikorkala O, Arrenbrecht S. Comparison of continuous and sequential transdermal progestogen with sequential oral progestogen in postmenopausal women using continuous transdermal estrogen: vasomotor symptoms, bleeding patterns, and serum lipids. Int J Fertil
43. Womens Med 1997; 42 Suppl 2: 376-87
44. De Lignieres B. Hormone replacement therapy: clinical benefits and side-effects.. Maturitas 1996; 23 Suppl: S31-6
45. Fourestie V, de Lignieres B, Roudot-Thoraval F, Fulli-Lemaire I, Cremniter D, Nahoul K, Fournier S, Lejonc JL. Suicide atttempts in hypo
46. ostrogenic phases of the menstrual cycle. Lancet 1986; 8520: 1357-60
47. Moos RH, Kopell BS, Melges FT, Yalom ID, Lunde DT, Clayton RB, Hamburg DA. Fluctuations in symptoms and moods during the menstrual cycle. J Psychosom Res 1969; 13(1): 37-44
48. Panay N, Studd J. Progestogen intolerance and compliance with hormone replacement therapy in menopausal women. Hum Reprod Update 1997; 3 (2): 159-71
49. Castelo-Branco C, Casals E, Sanllehy C, Fortuny A, Vanrell JA, Gonzalez-Merlo J. Postmenopausal hormone replacement therapy with low-dose medroxyprogesterone acetate. Endometrium, plasma lipids, lipoproteins and apolipoproteins..J Reprod Med 1995; 40 (4): 305-11
50. Fitzpatrick LA, Good A. Micronized progesterone: clinical indications and comparison with current treatments. Fertility and sterility 1999; 72 (3): 389-97
51. Castelo-Branco C, Vicente JJ, Figueras F, Sanjuan A, Martinez de Osaba MJ, Casals E, Pons F, Balasch J, Vanrell JA. Comparative effects of estrogens plus androgens and tibolone on bone, lipid pattern and sexuality in postmenopausal women. Maturitas 2000; 34 (2): 161-8
52. Hart DM, Farish E, Fletcher CD, Barnes JF, Hart H, Nolan D, Spowart K. Long-term effects of continuous combined HRT on bone turnover and lipid metabolism in postmenopausal women. Osteoporos Int 1998; 8 (4): 326-32
53. Blümel JE, Roncagiolo ME, Gramegna G, Vasquez R, Estartus A, Tacla F, Brandt A. Estudio doble ciego del efecto sobre la sintomatología menopáusica, el perfil lipídico y el grosor endometrial de una terapia continua de valerato de estradiol más acetato de medroxiprogesterona.
54. Rev Chilena Obstet Ginecol 1994; 59(5): 354-60.
55. Blumel JE, Brandt A, Garavagno A, Cubillos M y Lozano A. Mujeres postmenopáusicas: Cambios de los lípidos plasmáticos con distintas terapias estrogénicas de reemplazo. Rev Médica Chile. 118: 382-87, 1990.
56. Yee HS, Fong NT. Atorvastatin in the treatment of primary hypercholesterolemia and mixed dyslipidemias.. Ann Pharmacother 1998; 32 (10): 1030-43
57. National Institutes of Health. Triglyceride, High Density Lipoprotein, and Coronary Heart Disease. NIH Consens Statement 1992 Feb 26-28; 10 (2): 1-28.
58. Nieto JJ, Cogswell D, Jesinger D, Hardiman P. Lipid effects of hormone replacement therapy with sequential transdermal 17-beta-estradiol and oral dydrogesterone. Obstet Gynecol 2000; 95 (1): 111-4
59. Albertazzi P, Di Micco R, Zanardi E. Tibolone: a review.. Maturitas 1998; 30 (3): 295-305
60. Spencer C, Crook D, Ross D, Cooper A, Whitehead M, Stevenson J. A randomised comparison of the effects of oral versus transdermal 17beta-oestradiol, each combined with sequential oral norethisterone acetate, on serum lipoprotein levels. British J obstet Gynaecol 1999; 106 (9): 948-53
61. Greendale GA, Wells B, Marcus R, Barrett-Connor E. How many women lose bone mineral density while taking hormone replacement therapy? Results from the Postmenopausal Estrogen/Progestin Interventions Trial. Arch Intern Med 2000; 160(20): 3065-71
62. J.E. Blumel, C. Castelo-Branco, L. Binfa, G. Gramegna, X. Tacla, B. Aracena, M.A. Cumsille, A. Sanjuan. Quality of life after the menopause: a population study. Maturitas 2000; 34 (1): 17-23
63. Prado J, López JL. Vigilancia endometrial y terapia de reemplazo hormonal. Rev Chil Obstet Ginecol 2000; 65(3): 215-220
64. Archer DF, Lobo RA, Land HF, Pickar JH. A comparative study of transvaginal uterine ultrasound and endometrial biopsy for evaluating the endometrium of postmenopausal women taking hormone replacement therapy. Menopause 1999; 6 (3): 201-8
65. Brooks SE, Yeatts-Peterson M, Baker SP, Reuter KL. Thickened endometrial stripe and/or endometrial fluid as a marker of pathology: fact or fancy? Gynecol Oncol 1996; 63 (1): 19-24
66. U.S. Department of Health and Human Services. Public Health Service. National Institutes of Health. Clinical Guidelines on the Identification, Evaluation, and Treatment of Overweight and Obesity in adults. NIH Publication. Nº 98-4083. 1998.
67. Blumel JE, Roncagliolo ME, Brandt A, Tacla X, Gramegna G. Prevalencia de factores de riesgo cardiovascular en mujeres. Cambios asociados con la edad, la menopausia y la terapia estrogénica. Rev Soc Argentina Nutrición.1994; 5(1):7-12.
68. National Institutes of Health. National Heart, Lung, and Blood Institute. National High Blood Pressure Education Program. The Sixth Report of The Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. NIH Publication. Nº. 98-4080. 1997