Bases Moleculares
Receptor de andrógenos (RA) viene de la subfamilia de genes NR3C4 y pertenece al grupo de receptores nucleares de hormonas esteroideas (figura 1), junto con el receptor de estrógenos, el receptor de glucocorticoides. El receptor de progesterona y el receptor de mineralocorticoides.
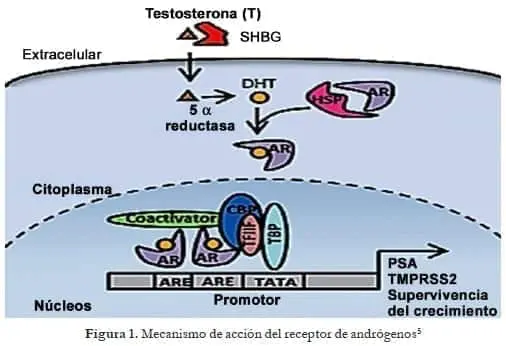
El receptor de andrógenos es un factor de transcripción ligando dependiente que controla la expresión de genes específicos. La unión del receptor a sus ligandos nativos 5á-dihidrotestosterona (DHT) y testosterona (T) inicia el desarrollo sexual masculino y la diferenciación.5
La dihidrotestosterona es detectada por primera vez entre las semanas 9 y 13 de gestación y puede ser mediadora de la diferenciación y el desarrollo de la próstata y la uretra prostática internamente, de la diferenciación de los genitales externos. Incluyendo el pene, la uretra peneana y el escroto, y también interviene en el descenso testicular.
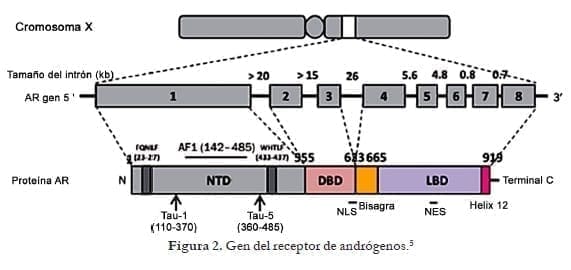
El gen del RA está localizado en el Xq11- Xq12. La proteína de la región codificadora tiene 2.757 nucleótidos y ocho exones, con intrones que varían en tamaño desde 0,7 a 2,6 Kb (figura 2). El gen RA codifica una proteína de 110 KDa consistente en 919 aminoácidos.
Como otros miembros de la familia de receptores nucleares, el RA tiene tres dominios funcionales principales: el dominio N-Terminal. Seguido por el dominio de unión de DNA y el dominio carboxilo terminal, el cual está conectado al dominio de unión a DNA por medio de una región de bisagra flexible. (VER: Síndrome de Insensibilidad a los Andrógenos, Pseudohermafroditismo Masculino)
Función del receptor
Los tres dominios son importantes en la función del receptor. La región de unión al DNA altamente conservada amarra el RA a las regiones genómicas del promotor y el enhancer o potenciador para permitir la activación de los dominios carboxi y aminoterminal y estimular la transcripción de estos genes.6
 En hombres, el gen SRY codifica el factor determinante de testículo y consiste de un único exón dentro de una región de 35 Kb; el dominio HMG, una región conservada que tiene propiedades de unión del DNA. La habilidad de mediar interacciones proteína-proteína, y contiene señales para la importación nuclear.
En hombres, el gen SRY codifica el factor determinante de testículo y consiste de un único exón dentro de una región de 35 Kb; el dominio HMG, una región conservada que tiene propiedades de unión del DNA. La habilidad de mediar interacciones proteína-proteína, y contiene señales para la importación nuclear.
En individuos con mutaciones del gen SRY, la vía del desarrollo ovárico continúa. Dado que un cariotipo XY no es compatible con el mantenimiento de los folículos, la gónada se degenera a tejido fibroso. Se han reportado cerca de 72 mutaciones del gen SRY, la mayoría localizadas en el dominio de unión al DNA.7
Los receptores de andrógenos son expresados en órganos reproductores masculinos, como los ductos deferentes, el seno urogenital, los conductos Wolffianos, epidídimo, conducto deferente, vesículas seminales, próstata y glándulas bulbouretrales desde el día 13 de desarrollo embrionario.
Los andrógenos influencian las funciones reproductivas femeninas también incluyendo la función ovárica durante el desarrollo folicular temprano. De tal manera que la disregulación de la señal andrógeno/RA altera el desarrollo reproductivo tanto masculino como femenino.8
En el citoplasma, el receptor de andrógenos se asocia a proteínas de choque térmico HSP 40 y HSP 70. El transporte nuclear es mediado por las importinas alfa y beta. Dentro del núcleo el RA es liberado por medio de proteínas RAS GTPasa. Donde se homodimeriza y se une a los elementos de respuesta a andrógenos, divididos en co-represores y co-activadores.9
Rol del receptor de andrógenos en la enfermedad
Aunque el receptor de andrógenos está involucrado en diversas actividades, sus funciones primarias están relacionadas a la fisiología masculina, como la diferenciación sexual y las patologías específicas del sexo. Los defectos en el gen del RA pueden evitar el desarrollo normal de las estructuras masculinas internas y externas en individuos 46 XY, de manera parcial o completa.
Los defectos en el gen del RA pueden ser causados por dos tipos de mutaciones: mutaciones únicas que resultan en sustitución del codón normal por un codón de parada, inserciones de nucleótidos y deleciones; y mutaciones intrónicas que afectan el splicing o empalme del RNA. Actualmente se han descrito 1.029 mutaciones diferentes en humanos, distribuidas predominantemente sobre las regiones de unión del DNA y del ligando.
Algunas investigaciones están asociadas a repeticiones de poliglutamina en la región N-Terminal que resultan en la enfermedad de Kennedy, conocida como atrofia espinobulbar progresiva. Mutaciones del RA predisponen al hombre a cáncer de próstata, especialmente repeticiones CAG en el dominio N Terminal del gen.
Las células del cáncer de próstata, similar a las normales, requieren andrógenos para crecer y sobrevivir e incluso durante la terapia de deprivación. Los niveles de andrógenos son suficientes para activar el RA sobreexpresado, debido a la síntesis intratumoral y la síntesis residual en la glándula suprarrenal.5
En mujeres, los andrógenos son producidos principalmente por los ovarios y las glándulas suprarrenales. En el ovario, la testosterona es sintetizada por las células de la teca en respuesta a la LH.
Se cree que los andrógenos influencian directamente la función ovárica por medio de la interacción con el RA durante el desarrollo folicular temprano. Sirviendo como precursores de los estrógenos preovulatorios.8
Funciones de los andrógenos
Las funciones de los andrógenos fueron descritas inicialmente en 1889, cuando el fisiólogo francés y profesor de Medicina, Charles Edward Brown-Sequard. Identificó la acción de los andrógenos por autoinyecciones de extractos testiculares. Posteriormente, en 1935, el profesor Ernst Laqueur, de Holanda, caracterizó el ingrediente activo en el extracto de testosterona.10
Las acciones programadas de los andrógenos incluyen la fusión reversible de los genitales en la línea media en el embrión humano entre la semana 7 y 12 de gestación como parte del proceso de diferenciación normal.
Experimentos en ratas proponen el término «ventana de programación masculina», que describe las acciones tempranas en el embrión que predicen las características genitales fenotípicas del adulto como la distancia anogenital. El crecimiento del pene, el tamaño testicular, el número de células de Leydig y Sertoli. Así como su función.
El Mecanismo molecular
Por el cual los transcriptomas programados por andrógenos son inicialmente establecidos y luego mantenidos no es claro. La modificación epigenética del DNA y la metilación en sitios CpG de los promotores del gen o la modificación de las histonas se cree que tienen un rol en la especificidad tisular y la función.
Sin embargo, la programación también es propia de las hembras; la exposición en útero lleva a alteraciones a largo plazo de la función ovárica. Inhibiendo el desarrollo folicular temprano e induciendo cambios metabólicos como resistencia a la insulina y disfunción hepática11 y en modelos animales –monos y ovejas–. El exceso de testosterona en la madre eleva la posibilidad de que el exceso en el feto promueva el desarrollo de SOA en la edad adulta.29
La pubertad es otro momento de ventana sensible a los andrógenos, donde son evidentes los cambios en la voz y en las proporciones de la cara. La androgenización de la pubertad y especialmente su naturaleza irreversible son de relevancia clínica en los trastornos del desarrollo sexual.11


