Actualidad Inmediata
Marcia L. Stefanick, Garnet L. Anderson, Karen L. Margolis, Susan L. Hendrix,
Rebecca J. Rodabough, Electra D. Paskett, Dorothy S. Lane, F. Allan Hubbell,
Annlouise R. Assaf, Gloria E. Sarto, Robert S. Schenken, Shagufta Yasmeen,
Lawrence Lessin, Rowan T. Chlebowski
En el estudio Women’s Health Initiative (WHI), un estudio aleatorizado de estrógenos más progesterona (EP) en mujeres posmenopáusicas, los estrógenos equinos conjugados (EEC) combinados con acetato de medroxiprogesterona (AMP) producen más riesgos para la salud que beneficios1, incluyendo una mayor incidencia de cáncer invasivo, que se diagnosticaron en un estado más avanzado, y una proporción sustancialmente mayor de mamografías anormales comparadas con el placebo2. El estudio paralelo del WHI con estrógenos solos, en el que fueron aleatorizadas mujeres con histerectomía previa a EEC solos o a placebo, se suspendió más temprano por un aumento de la incidencia de ACV y noreducción del riesgo de enfermedad cardiaca coronaria (ECC)3. En contraste con una evidencia epidemiológica de la asociación de estrógenos exógenos que aumentan la incidencia de cáncer de mama4-9, un análisis preliminar encontró menos cánceres de mama en las mujeres del grupo de EEC, llevando a un análisis detallado y actualizado de la incidencia de cáncer de mama y reportes de mamografía. Los resultados del estudio completo reportados aquí incluyen todos los eventos ocurridos antes de la suspensión de la intervención y abriéndolo.
La mejor explicación biológica para la posible disminución de la incidencia de cáncer de mama con EEC es considerada y examinada en un análisis exploratorio, incluyendo interacciones de asignación y tratamiento con factores de riesgo de base.
Métodos
El estudio de estrógenos solos del WHI reclutó 10.739 pacientes posmenopáusicas con histerectomía previa desde 1993 hasta 2006 en 40 centros clínicos de los EUA. Diez mujeres fueron reclutadas primariamente por correos masivos y fueron elegibles si estaban entre 50 y 79 años al ingreso al estudio, eran posmenopáusicas y residían preferencialmente en la misma área por tres años. Se hizo un esfuerzo especial de reclutar mujeres de las minorías en un intento de estudiar los efectos de la terapia hormonal en una cohorte que refleje la diversidad étnica racial de mujeres posmenopáusicas entre 50 y 79 años en una población estadounidense.
Mujeres individuales se clasificaron ellas mismas con relación a la etnicidad-raza. El protocolo y los formatos de consentimiento fueron revisados y aprobados por el comité institucional de revisión en cada centro participante. Cada mujer dio por escrito el consentimiento informado. Las exclusiones del estudio incluyeron incidencia anterior de cáncer de mama y condiciones médicas que pudieran resultar en muerte en un período de tres años. El uso de hormonas menopáusicas al tamizaje requiere un período de lavado de tres meses antes del reclutamiento. Todas las mujeres tenían una mamografía al ingreso y un examen clínico de la mama; hallazgos sospechosos requirieron aclararlos antes de entrar en el estudio. El riesgo de cáncer de mama fue medido por entrevistas y cuestionarios estandarizados. Ya se han publicado las definiciones de características demográficas y salud general y reproductiva, médica e historia familiar, incluyendo uso de hormonas10. La preservación de los ovarios se definió como ooforectomía bilateral no auto-reportado. Las mujeres fueron asignadas aleatoriamente a 0.625 mg de EEC (Premarin, Wyeth, Collegeville, Pa) o a un placebo de apariencia idéntica. La randomización fue llevada a cabo usando una base de datos distribuida por la coordinación de los centros clínicos del WHI; las botellas de las píldoras del estudio tenían un código de barras único y una selección basada en el computador para asegurar entregarlas en doble ciego.
La medicación del estudio fue descontinuada por el desarrollo de cáncer de mama, trombosis venosa profunda o embolismo pulmonar, melanoma maligno, niveles de triglicéridos altos, mayores de 1000 mg/dl (11.3 nmol/L, o uso de tamoxifene, raloxifene, u otro estrógeno diferente al del estudio, progestina o andrógeno).
Procedimiento de seguimiento
Las participantes fueron contactadas cinco semanas después de entrar al estudio para determinar síntomas y promover adherencia, con un intervalo de seis meses para determinar resultados clínicos, y anualmente para visitas clínicas. La medicación del estudio fue suspendida hasta completarse el tamizaje de la mamografia anual requerida y el examen de los senos. Los resultados iniciales fueron certificados por cuestionarios autoadministrados.
Los resultados de cáncer de mama fueron confirmados por un médico local revisor de historias clínicas y por reporte de patología. Los casos fueron adjudicados al centro clínico coordinador usando el sistema de códigos de Sobrevivencia, Epidemiología, y Resultados Finales11.
Los cánceres de mama o tales incluyen el primero de cáncer de mama invasivo o in situ. Los reportes mamográficos fueron obtenidos y revisados localmente en los centros clínicos y codificados por recomendación del radiólogo (negativo, hallazgos benignos negativos, sugerencia de seguimiento a corto plazo, sospechoso de anormalidad, y altamente sugestivo de malignidad).
Las mamografías con sugerencia de seguimiento a corto plazo y con sospecha o altamente sugestivas se consideraron anormales; en las últimas dos categorías aclara el diagnóstico antes de iniciar la medicación del estudio. Las decisiones médicas acerca del manejo de los hallazgos en la mama fueron dirigidas primariamente por los médicos de la comunidad
Terminación del estudio
El tamaño de la muestra se basó en los efectos hipotéti- cos de los estrógenos en la ECC después de un seguimien- to propuesto de nueve años. Para propósitos de monitoreo, se definió un índice global de riesgos y beneficios como el tiempo del primer evento entre ECC, cáncer invasivo de mama, ACV, cáncer colorectal, embolismo pulmonar, fractura de cadera y muerte por otras causas. El National Institute of Health suspendió el estudio prematuramente antes de lo planeado por un aumento del riesgo de ACV en mujeres sa- nas que era inaceptable en la ausencia de una reducción del riesgo de ECC.
En ese momento, 218 cánceres invasivos de mama fue- ron descritos y los cánceres de mama in situ no habían sido cuantificados3. El estudio actual provee el análisis de 237 cán- ceres invasivos y 55 in situ centralmente adjudicados como cánceres de mama diagnosticados en febrero 29 de 2004, el día en que a las participantes les fue pedido que suspendieran la toma de las píldoras, lo que resultó en un promedio de seguimiento de 7.1 (1.6) años.
Análisis estadístico
Los resultados primarios fueron medidos por el método de tiempo del evento y se basaron en el principio de inten- ción de tratar. Los riesgos de peligro (RRs) se basaron en
el análisis estratificado de peligro proporcional de Cox por edad y estado de randomización en el estudio Dietary Modi- fication del WHI. Intervalos nominales de confianza (ICs) del
95% se usaron para inferencias relacionadas con el cáncer de mama cuando estas fueron similares a los ICs que reconoce el monitoreo secuencial de los días próximos a la fecha de suspensión a la terminación planeada del mismo.
En un análisis exploratorio, se midieron efectos en subgru- pos como interacciones entre la asignación de aleatorización y las características basales seleccionadas en los modelos de peligro proporcionales de Cox que incluían ambos factores como efectos principales. Los valores de P. para interacción se computaron del test de relaciones usando una variable con- tinua para las características basales, cuando era posible. Se presentaron valores nominales de P, reflejando significancia estadística sin ajuste para comparaciones múltiples.
Debido a que se probaron 20 características basales, por azar podría esperarse de producir un Test de interacción po- sitiva significativa al nivel de 0.05 de significancia y dos en el nivel 0.10. Las mujeres con valores perdidos para un factor dado fueron omitidas solo para el análisis requerido para esa variable.
Los RRs por tiempo desde la randomización se calcu- laron del modelo de riesgos proporcionales de Cox y los test para tendencia en el tiempo se obtuvieron incorporando un término de interacción linear de tiempo. Las gráficas de Kaplan /Meier describen las tasas de cáncer de mama en el tiempo. La medición del efecto potencial del análisis de adhe- rencia y la adherencia-ajustada fue hecha por censo del segui- miento para una mujer seis meses después de que ella no era adherente (definida como consumiendo menos del 80% de las píldoras del estudio, o el comienzo de terapia hormonal diferente al del estudio durante el intervalo más reciente del estudio). La comparación de las características seleccionadas del tumor de cáncer de mama se basó en X2, Fisher exacto, o t test. El análisis estadístico fue realizado usando el software de SAS, versión 9.1.3 (SAS Institute Inc, Cary, NC).
Resultados
Características de la población del estudio
Todas las mujeres tenían histerectomía previa y 41% te- nían ooforectomía bilateral. La ooforectomía previa fue me- nos común en el grupo de EEC.
Las mujeres con ooforectomía bilateral difirieron de ova- rios conservados pero no hubo diferencias sustanciales por la asignación de tratamiento.
El riesgo basal de cáncer de mama fue comparable en am- bos grupos. Las participantes estuvieron a moderado riesgo
por su edad12, con un promedio (DS) de cinco años de esti- mado de riesgo de Gail13 de 16% (1.0%) (Media 1.4% [rango intercuartil, 1.03%- 1.88%]). Una leve menor proporción de mujeres en el grupo de EEC reportaron biopsias benignas de mama anteriores (19.3% vs. 21.7%; p = 0.004).
Cincuenta y dos por ciento de todas las participantes nunca habían tomado terapia hormonal antes de entrar al estudio, menos del 5% habían estado tomando estrógenos combinados con una progestina, y el resto habían tomado estrógenos solos. Las mujeres sin uso previo de hormonas difirieron de aquellas con uso previo en la mayoría de las variables pero no hubo diferencias sustanciales por la asigna- ción de tratamiento Solamente el 5.2% de las participantes se salieron o se perdieron del seguimiento y estas pérdidas fueron similares entre el grupo de EEC y el grupo placebo3.
A la terminación del estudio, 54% de las participantes no eran adherentes a la medicación del estudio. Las tasas de des- continuación de las pastas no difieren significativamente por la asignación a la randomización. Aunque las mujeres dieron muchas razones para la suspensión de la medicación del estu- dio, la distribución de razones fue similar entre ambos grupos. La diferencia más grande en razones para suspenderla fue en los síntomas reportados que están comúnmente asociados con la menopausia o iniciación de hormonas menopáusicas (24.5% para EEC frente a 19.8% para placebo) con la mayoría de las diferencias atribuidas a los síntomas mamarios (5.8% frente a 1.6%).
El uso de medicamentos diferentes a los del estudio fue reportado en un 8.4% de los participantes asignados a place- bo y un 5.3% de los participantes asignados a EEC.
Resultados clínicos
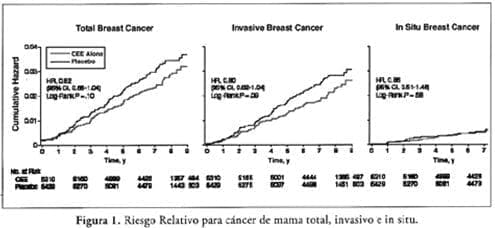
En análisis de intención de tratar de todos los eventos (n 237) qué ocurre antes de la terminación de la intervención, se observaron reducciones para el cáncer de mama invasivo (RR, 0.80; IC 95%, 0.62 = 1.04; p = 0.09) y para cáncer de mama total (RR, 1.82; IC 95%, 0.65 = 1.04; p = 0.10) en muje- res randomizadas a EEC solos, mientras que no se encontró efecto en la enfermedad in situ (Figura 1). Estos resultados no se alteraron al ajustarlos por pequeñas diferencias en el número de familiares en primer grado con cáncer de mama o historia de enfermedad benigna de mama.
No hubo evidencia de tendencia de RR de cáncer inva- sivo de mama en el tiempo (p = 0.29). En análisis adicionales, menos cánceres de mama con enfermedad localizada se diag- nosticaron en el grupo de EEC que en el grupo de placebo (RR, 0.69; IC, 0.51 = 0.95), mientras la incidencia de cánceres en estados más avanzados fue comparable en los dos grupos. Una reducción similar se encontró para carcinomas ductales (RR, 0.71; IC 95%, 0.523-0,99) pero no para enfermedad lobu-
lar. La interacción entre la asignación a tratamiento y la histo- logía (ductal frente a lobular) alcanza significancia (p = 0.054), mientras no hubo interacción significante entre la asignación y el estadío localizado frente al regional, p= 0.09) o grado de tumor (bien frente a moderado, frente a pobremente diferen- ciado anaplásico, p = 0.74).
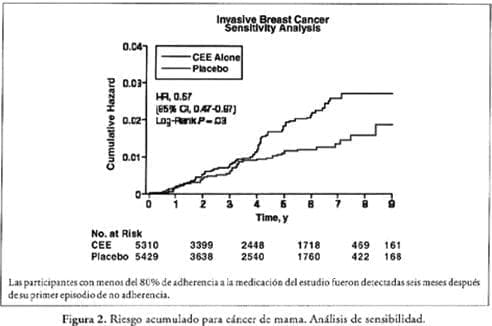
En el análisis ajustado de adherencia que se censó a los seis meses de tratamiento después de que la mujer fue no adherente (Figura 2), una reducción mayor y significante en la incidencia de cáncer invasivo de mama se observó en el grupo de EEC comparado con el grupo placebo (RR, 0.67; IC
95%, 0.47-0.97; p = 0.03).
Interacciones significantes se vieron entre asignación al tratamiento y estimado de riesgo de cáncer a cinco años (p=0.01), historia de enfermedad benigna de mama (p=0.005) y número de familiares de primer grado con cáncer de mama (p=0.01). Hubo un aparente efecto protector de los EEC so- bre la incidencia observada de cáncer de mama observada en las categorías asociadas, con el menor riesgo en las tres cir- cunstancias descritas. No se vio interacción con el estado de ooforectomía, índice de masa corporal (calculado como peso en Kg. dividido por la estatura en metros al cuadrado), edad al tamizaje, menarca, primer parto o menopausia, antecedentes de anticonceptivos orales, o uso de drogas antiinflamatorias no esteroideas. No se observó interacción significante de EEC con uso previo de estrógenos; sin embargo, aunque los datos fueron pocos, la interacción de EEC con uso previo de E-P combinados fue nominalmente significante (p=0.03). Los resultados específicos por estrato sugirieron la posibili- dad de que un efecto de los EEC se concentrara en mujeres sin exposición previa a hormonas de cualquier tipo (Figura
3). No se vieron interacciones con la duración o novedad de uso de terapia hormonal previa de cualquier tipo. Un análisis, examinando los RRs por tiempo desde la aleatorización, no reveló tendencias significantes en general o por el uso previo de hormonas.
Características del tumor
Los cánceres invasivos de mama entre las mujeres asig- nadas a EEC fueron más grandes comparados con los de las mujeres asignadas a placebo (promedio DE, 1.8 cm [1.2] fren- te a 1.5 cm [0.9]; p = 0.03) y una mayor proporción tiende a ser nodo positivo (35.5% frente a 23.3%, respectivamente; p
= 0.07).
Mamografías y biopsia de mama
De entrada, lecturas detalladas (diferentes a cáncer / no cáncer) estuvieron disponibles para 9.844 mamogramas y la frecuencia de las mamografías con anormalidades fueron muy comparables en los dos grupos de estudio. Después del primer año, el porcentaje de mamografías con anormalida-
des que requerían seguimiento fue sustancialmente mayor en el grupo de EEC comparado con el placebo (436 [9.2%] de
4 718 frente a 260 [5.5%] de 4 763, respectivamente; p =
0.001).
Cada año después, el porcentaje de mamografías que re- querían seguimiento fueron significantemente más altas en el grupo de EEC, resultando en un porcentaje acumulativo de
36.2% en el grupo de EEC y 28.1% en el grupo placebo (p =
0.001) en el curso del estudio. Esta diferencia se concentró en la categoría de los que se recomendó un seguimiento más cercano. El número de reportes de biopsia de mama o aspi- ración fue similar entre los dos grupos al año 1, pero desde el año 2 en adelante el número de tales reportes fue mayor en el grupo de EEC cada año (rango de diferencia, 27-43) en el total de 198 o más biopsias o aspiraciones durante la duración del estudio.
Comentarios
En el estudio de estrógenos solos del WHI, la inciden- cia de cáncer invasivo de mama no difiere significativamente entre las mujeres randomizadas a 0.625 mg/día de EEC com- paradas con el placebo en un seguimiento promedio de 7.1 años. Los resultados preliminares sugieren una más baja inci- dencia de cáncer de mama en mujeres en el grupo de EEC, lo que pareció una sorpresa con relación a la evidencia previa14 y necesitaba un análisis detallado. En la base de datos com- pleta del estudio, la incidencia de cáncer invasivo de mama no difiere significativamente entre el grupo de EEC y el grupo placebo (RR, 0.80; IC 95%, 0.62-1.04).
Sin embargo, un análisis exploratorio sugirió que los EEC podían disminuir la incidencia de cáncer de mama en ciertos subgrupos. En contraste, la proporción de mamografías que necesitaban seguimiento se aumentó significativamente en el grupo de EEC en el primer año y en cada año posterior.
Aunque la evidencia sustancial indica que el riesgo de cáncer de mama está aumentado por ambos factores repro- ductivos –que influyen en los niveles endógenos de estróge- nos15– y terapia de estrógenos combinada con progestinas exógenos, la evidencia acerca de un efecto de estrógenos exógenos solamente en el riesgo de cáncer de mama ha sido
mixta6-9, 16-19. La preponderancia de anteriores estudios observacionales que reportaron un modesto aumento en el diagnóstico de cáncer de mama con el uso de estrógenos sin oposición fueron ampliamente controlados para tamizaje de mamografía4, 6 y sesgos de detección han podido producir resultados confusos. Sin embargo, en reportes recientes hay diferencias. En el estudio One Million Women9 (un análisis cruzado y análisis de cohorte), hubo un aumento en el cáncer de mama con uso de estrógenos solos de corta duración mientras otro estudio de similar tamaño observacional, no reportó aumento en el cáncer de m am a con solam ente estrógenos16 y tampoco lo hicieron otros dos estudios du- rante este período17, 18.
De hecho, Kerlikowskw y col.19 reportaron una disminu- ción del 8% (IC 95%, -16%) al 0% en la incidencia de cáncer de mama entre mujeres que toman estrógenos solos por más de cinco años comparadas con las que no toman hormonas en una cohorte grande de mujeres vista en una práctica de mamografía basada en una comunidad.
Un modelo conceptual basado solamente en la estimu- lación del crecimiento de cáncer de mama por la adición de estrógenos e inhibición por la reducción de estrógenos no explica los hallazgos clínicos disponibles20. En modelos pre- clínicos, las células de cáncer de mama21, 22 y xerografías de cáncer de mama23, 24 demuestran apoptosis o regresión tumoral en respuesta a bajas dosis de estradiol después de una deprivación previa de estrógenos.
En pacientes posmenopáusicas con cáncer de mama, la reducción de estrógenos con inhibidores de aromatasas25, bloqueó con moduladores selectivos de los receptores es- trogénicos como el tamoxifeno25, y estrógenos exógenos24-
28 que tienen efectos anticáncer. Además, la suspensión de la terapia hormonal29 (tamoxifen)30, moduladores selectivos de los receptores estrogénicos o exemestane el inhibidor de aromatasas31, pueden terminar en regresión del cáncer de mama. Estos datos son consistentes con células cancerosas de mama que son susceptibles a las fluctuaciones de estróge- nos ya sea por encima o por debajo que las toleradas por el tejido glandular mamario normal. En un análisis de subgrupo, el cual requiere una interpretación cautelosa, se vio una sig- nificante reducción en carcinomas ductales (RR 0.71; IC 95%,
0.52- 0.99) pero no de tumores lobulares, y en cánceres de mama invasivos en mujeres que fueron adherentes a la medi- cación del estudio (RR, 0.67; IC 95%, 0.47-0.97; p = 0.03).
Un efecto de los EEC sobre el cáncer de mama fue visto en algunos subgrupos a más bajo riesgo (más bajos estimados de lo estimado y riesgo de Gail, no familiares de primer grado con cáncer de mama, o ausencia de enfermedad benigna de mama).
Tales hallazgos sugieren una fuerte influencia de los EEC sobre el cáncer de mama no relacionada con historia familiar y/o aquellas menos supuestas a asociarse con microcalcifica- ciones, un hallazgo mamográfico que a menudo lleva a reco- mendaciones de biopsia de mama.
La observación de una más baja incidencia de cáncer de mama con EEC relativo al placebo en mujeres sin uso previo de hormonas, pero no en mujeres con uso previo de hor- monas quiebra la hipótesis de que subsecuente o continuo uso de estrógenos podría no reducir el riesgo adicionalmente porque las células cancerosas mamarias sensibles ya se habían expuesto a estrógenos exógenos. En este aspecto, se vieron tasas anuales similares de la incidencia de cáncer de mama (entre 0.26% y 0.29%) en los tres grupos con uso previo actual de estrógenos mientras una tasa de incidencia anual mayor (0.40%) se vio solo en mujeres con o sin exposición previa de estrógenos quienes fueron randomizadas a placebo. De forma alterna, el subgrupo con mayor incidencia puede simplemente haber sido por azar.
En el estudio del WHI-EP, los EEC combinados con ace- tato de medroxiprogesterona se aumentan significantemente, las mamografías con recomendaciones más cortas de segui- miento tan bien como aquellas altamente sugestivas de ma- lignidad2.
En este estudio, los EEC solos aumentaron las mamo- grafías con recomendaciones de seguimientos mamográficos
más frecuentes pero no las que tenían hallazgos más sospe- chosos. La variabilidad del uso de los radiólogos de recomen- daciones para seguimientos a intervalos más cortos como también la relación de tales hallazgos de riesgo de cáncer de mama es reconocida32-34. Sin embargo, una mamografía con esta recomendación en la práctica clínica requiere repetir la mamografía después de seis meses35-38. Este hallazgo podría incluirse en la discusión de riesgo y beneficios del uso de EEC.
Se reportaron un total de 198 biopsias más sin diagnósti- co de cáncer en las mujeres en el grupo de EEC, en el curso del estudio. Solamente cerca del 20% de las biopsias en esta población de tamizaje podría tener enfermedad proliferativa de mama39; un hallazgo que se asocia con un 2% a 3% de riesgo de cáncer de mama en la década siguiente40; así, la re- moción diferencial de lesiones precancerosas en el grupo de EEC por biopsia no puede explicar los hallazgos del estudio.
El uso de hormonas combinadas aumenta la densidad mamaria mamográfica comparado con el placebo o los es- trógenos solos41-43. Se necesitan estudios posteriores para definir cualquier papel en los cambios de la densidad mamaria en la diferencia de los hallazgos mamográficos vistos en los estudios hormonales del WHI22. Los estudios observacio- nales acerca de las características de los cánceres de mama diagnosticados mientras tomaban estrógenos solos han sido mixtos19, 44. En este estudio randomizado, los hallazgos de una incidencia reducida de tumores localizados sin aumento de las tasas en estados avanzados de la enfermedad es con- sistente con el modesto aumento en el tamaño del tumor, visto en mujeres asignadas a EEC. Una reducción relativa en invasión ductal comparada con carcinomas lobulares también puede contribuir porque el último demuestra una sensibili- dad menor en la detección mamaria45, 46.
El análisis explorando indirectamente la demora en el diagnóstico al considerar el uso previo de hormonas no fue definitivo y esto permanece como un factor contribuyente.
Sin embargo, el relativamente corto tiempo de doblar- se el cáncer de mama de alrededor de 150 días47-49 y la continua divergencia de las curvas de incidencia a través de mamas de seis años de seguimiento argumenta en contra de una hipótesis enmascarada de una influencia mayor. Segui- miento posterior para tener datos adicionales acerca de las consecuencias a largo plazo de la exposición a EEC están en camino.
Una interacción relativa consistente de índice de masa corporal con hormonas menopáusicas sobre el cáncer de mama ha sido reportado en estudios observacionales con mayores efectos hormonales en mujeres con más bajo índice de masa corporal7, 8, 43, 50. Sin embargo, no hubo interacción significante de EEC e índice de masa corporal sobre el riesgo de cáncer de mama en las usuarias actuales de estrógenos solos o en el grupo combinado de E+P del estudio WHI2.
Con relación a las diferencias halladas los estudios de E+P y estrógenos solos, las cohortes de estudio difieren por el estado uterino (es decir, todas las de estrógenos solos te- nían histerectomía previa) y por otro gran número de otras características basales51. Sin embargo, el promedio del esti- mado de Gail a cinco años fue similar (1.6% en el estudio de estrógenos solos y 1.5% en el de E+P) y las tasas analizadas de cáncer de mama invasivo fueron similares a las del grupo placebo en los dos estudios (0.34% en el de estrógenos so- los y 0.33% en el de E+P). Así pues, las diferencias entre las cohortes de los estudios no explican las diferencias en los efectos del cáncer de mama vistos y los resultados sugieren fuertemente un papel de las progestinas en relación con el aumento del riesgo de cáncer mamario.
En conclusión, los EEC solos por 7.1 años no aumentan el riesgo de incidencia de cáncer de mama en mujeres posme- nopáusicas con histerectomía y pueden disminuir los estados tempranos de la enfermedad y los carcinomas ductales.
Estos resultados contrastan claramente con los del estu- dio combinado del WHI en mujeres con útero, el cual mostró un aumento significante en la incidencia de cáncer de mama en un período de seguimiento de 5.6 años2. Ambos estudios mostraron un sustancial aumento en la frecuencia del reque- rimiento de mamografías desde el primer año para adelante. Sin embargo, este aumento se vio solamente para el segui- miento recomendado a corto plazo de mamografías en el estudio de estrógenos solos, mientras se aplicaba también a esos con anormalidades sospechosas o altamente sugestivas en el estudio de E+P2.
La iniciación de estrógenos solos en mujeres después de histerectomía, podría seguir siendo basada en una cuidadosa consideración del riesgo potencial y de los beneficios en un individuo dado.
Afiliación de los autores: Stanford Prevention Research Center, Department of Medicine, Stanford University, Stan- ford, Calif (Dr. Stefanick); Women’s Health Initiative Clinical Coordinating Center, Division of Public Health Sciences, Fred Hutchinson Cancer Research Center, Seattle, Wash (Dr. Anderson and Ms Rodabough); Hennipin County Medi- cal Center, Minneapolis, Minn (Dr. Margolis); Department of Obstetrics and Gynecology, Wayne State University School of Medicine/Hutzel Women’s Hospital, Detroit, Mich (Dr. Hendrix);Division of Epidemiology, School of Public Health, Ohio State University, Columbus (Dr Paskett); Department of Preventive Medicine, State University of New York, Stony Brook (Dr. Lane); Department of Medicine, University of Cali- fornia, Irvine (Dr. Hubbell); Center for Primary Care and Pre- vention, Memorial Hospital of Rhode Island, Pawtucket (Dr. Assaf); Department of Obstetrics and Gynecology, University of Wisconsin, Madison (Dr. Sarto); Department of Obstetrics and Gynecology, University of Texas Health Science Center, San Antonio (Dr. Schenken); Department of Obstetrics and
Gynecology, University of California, Davis (Dr. Yasmeen); Medstar Research Institute,Washington, D.C. (Dr. Lessin); and Los Angeles Biomedical Research Institute at Harbor- UCLA Medical Center,Torrance, Calif (Dr. Chlebowski).
Contribución de los autores: el Dr. Anderson tuvo ac- ceso a todos los datos del estudio y tiene la responsabilidad de la integridad y la veracidad del análisis de los datos.
Estudio conceptual y diseño: Stefanick, Hendrix, Lane.
Adquisición de datos: Stefanick, Margolis, Hendrix, Lane, Hubbell, Assaf, Sarto, Lessin, Chlebowski.
Análisis e interpretación de datos: Stefanick, Ander- son, Margolis, Hendrix, Rodabough, Paskett, Lane, Hubbell, Schenken,Yasmeen, Lessin, Chlebowski.
Escritura del manuscrito: Stefanick, Sarto,Yasmeen.
Revisión crítica del manuscrito por valor intelectualt: Stefanick, Anderson, Margolis, Hendrix, Rodabough, Paskett, Lane, Hubbell, Assaf, Schenken, Lessin, Chlebowski.
Análisis estadístico: Anderson, Rodabough.
Obtención de Fondos: Stefanick, Hendrix, Lane.
Apoyo administrativo, técnico o material: Stefanick, Margolis, Hendrix, Assaf, Schenken, Chlebowski. Supervisión del estudio: Stefanick, Anderson, Margolis, Hendrix, Paskett, Hubbell, Assaf, Chlebowski.
Declaración de intereses: el Dr. Hendrix recibe do- naciones de Bristol-Myers Squibb, 3M, Organon, Merck, TAP, Wyeth-Ayerst, Glaxo- SmithKline; es consultor de Eli Lilly, Merck, Organon, Procter & Gamble, GlaxoSmithKline; y es del grupo de conferencistas de Eli Lilly, Merck, 3M, and Pfizer. El Dr. Assaf es un empleado de Pfizer. El Dr. Chlebowski es consultor de Astra- Zeneca, Eli Lilly, and Organon. Ningún otro autor hizo declaración de intereses.
Financiación: el Women’s Health Initiative fue financiado por The National Heart, Lung, and Blood Institute of the Na- tional Institutes of Health, Department of Health and Human Services.
Papel del financiador: la organización financiadora te- nía representación en el comité director; él participó en el di- seño y conducción del estudio, la interpretación de los datos, y la preparación y aprobación del manuscrito. Directivos de The National Heart, Lung, and Blood Institute’s revisaron los manuscritos antes de la publicación.
Investigadores del Women’s Health Initiative (WHI):
National Heart, Lung, and Blood Institute, Bethesda, Md (Bar- bara Alving, Jacques Rossouw, Linda Pottern, Shari Ludlam, Joan McGowan, Nancy Geller, Leslie Ford).
Una lista completa se encuentra disponible en https://www.whi.org.
Centro de coordinación clínica del WHI: Fred Hut- chinson Cancer Research Center, Seattle,Wash (Ross Prenti- ce, Garnet Anderson, Andrea LaCroix, Ruth Patterson, Anne McTiernan, Barbara Cochrane, Julie Hunt, Lesley Tinker, Char- les Kooperberg, Martin McIntosh, C.Y. Wang, Chu Chen, De- borah Bowen,Alan Kristal, Janet Stanford, Nicole Urban, Noel Weiss, EmilyWhite); Wake Forest University School of Medi- cine, Winston- Salem, NC (Sally Shumaker, Ronald Prineas, Michelle Naughton); Medical Research Laboratories, Highland Heights, Ky (Evan Stein, Peter Laskarzewski); San Francisco Coordinating Center, San Francisco, Calif (Steven R. Cum- mings, Michael Nevitt, Lisa Palermo); University of Minnesota, Minneapolis (Lisa Harnack); Fisher BioServices, Rockville, Md (Frank Cammarata, Steve Lindenfelser); University of Was- hington, Seattle (Bruce Psaty, Susan Heckbert).
Centros clínicos del WHI: Albert Einstein College of Medicine, Bronx, NY (Sylvia Wassertheil-Smoller, William Frishman, Judith Wylie-Rosett, David Barad, Ruth Freeman); Baylor College of Medicine, Houston, Tex (Jennifer Hays, Ro- nald Young, Jill Anderson, Sandy Lithgow, Paul Bray); Brigham and Women’s Hospital, Harvard Medical School, Boston, Mass (JoAnn Manson, J. Michael Gaziano, Claudia Chae, Kathryn Rexrode, Caren Solomon); Brown University, Providence, RI (Annlouise R. Assaf, Carol Wheeler, Charles Eaton, Miche- lle Cyr); Emory University, Atlanta, Ga (Lawrence Phillips, Margaret Pedersen, Ora Strickland, Margaret Huber, Vivian Porter); Fred Hutchinson Cancer Research Center, Seattle, Wash (Shirley A.A. Beresford,Vicky M.Taylor, Nancy F.Woods, Maureen Henderson, Robyn Andersen); George Washington University, Washington,D.C. (Judith Hsia, Nancy Gaba, Joao Ascensao); Harbor-UCLA Research and Education Institute, Torrance, Calif (Rowan Chlebowski, Robert Detrano, Ani- ta Nelson, Michele Geller); Kaiser Permanente Center for Health Research, Portland, Ore (Evelyn Whitlock, Patricia Elmer, Victor Stevens, Njeri Karanja); Kaiser Permanente Di- vision of Research, Oakland, Calif (Bette Caan, Stephen Sid- ney, Geri Bailey, Jane Hirata); Medical College of Wisconsin, Milwaukee (Jane Morley Kotchen, Vanessa Barnabei, Theo- dore A. Kotchen, Mary Ann C. Gilligan, Joan Neuner); MedS- tar Research Institute/ Howard University, Washington, DC (Barbara V. Howard, Lucile Adams-Campbell, Lawrence Lessin, Monique Rainford, Gabriel Uwaifo); Northwestern University, Chicago/ Evanston, Ill (Linda Van Horn, Philip Greenland, Ja- nardan Khandekar, Kiang Liu, Carol Rosenberg); Rush Univer- sity Medical Center, Chicago, Ill (Henry Black, Lynda Powell, Ellen Mason, Martha Gulati); Stanford Prevention Research Center, Stanford, Calif (Marcia L. Stefanick, Mark A. Hlatky, Bertha Chen, Randall S. Stafford, Sally Mackey); State Universi-
ty of New York, Stony Brook (Dorothy Lane, Iris Granek,Wi- lliam Lawson, Gabriel San Roman, Catherine Messina); Ohio State University, Columbus (Rebecca Jackson, Randall Harris, Electra Paskett, W. Jerry Mysiw, Michael Blumenfeld); Univer- sity of Alabama, Birmingham (Cora E. Lewis,Albert Oberman, James M. Shikany, Monika Safford, Mona Fouad); University of Arizona, Tucson/ Phoenix (Tamsen Bassford, Cyndi Thomson, Marcia Ko, Ana Maria Lopez, Cheryl Ritenbaugh); State Uni- versity of New York, Buffalo (Jean Wactawski- ende, Maurizio Trevisan, Ellen Smit, Susan Graham, June Chang); University of California at Davis, Sacramento (John Robbins, S. Yasmeen); University of California, Irvine (F. Allan Hubbell, Gail Frank, Nathan Wong, Nancy Greep, Bradley Monk); University of California, Los Angeles (Howard Judd, David Heber, Robert Elashoff ); University of California at San Diego, LaJolla/Chu- la Vista (Robert D. Langer, Michael H. Criqui, Gregory T. Ta- lavera, Cedric F. Garland, Matthew A. Allison); University of Cincinnati, Cincinnati, Ohio (Margery Gass, Suzanne Wernke); University of Florida, Gainesville/ Jacksonville (Marian Lima- cher, Michael Perri, Andrew Kaunitz, R. Stan Williams,Yvonne Brinson); University of Hawaii, Honolulu (J. David Curb, Helen Petrovitch, Beatriz Rodriguez, Kamal Masaki, Santosh Shar- ma); University of Iowa, Iowa City/Davenport (Robert Walla- ce, James Torner, Susan Johnson, Linda Snetselaar, Jennifer Ro- binson); University of Massachusetts/Fallon Clinic,Worcester (Judith Ockene, Milagros Rosal, Ira Ockene, Robert Yood, Pa- tricia Aronson); University of Medicine and Dentistry of New Jersey, Newark (Norman Lasser, Baljinder Singh, Vera Lasser, John Kostis, Peter McGovern); University of Miami, Miami, Fla (Mary Jo O’Sullivan, Linda Parker, Timothy DeSantis, Diann Fernandez, Pat Caralis); University of Minnesota, Minneapolis (Karen L. Margolis, Richard H. Grimm, Mary F. Perron, Cynthia Bjerk, Sarah Kempainen); University of Nevada, Reno (Robert Brunner, William Graettinger, Vicki Oujevolk, Michael Bloch); University of North Carolina, Chapel Hill (Gerardo Heiss, Pamela Haines, David Ontjes, Carla Sueta, Ellen Wells); Uni- versity of Pittsburgh, Pittsburgh, Pa (Lewis Kuller, Jane Cau- ley, N. Carole Milas); University of Tennessee Health Science Center, Memphis (Karen C. Johnson, Suzanne Satterfield, Ra- ymond W. Ke, Stephanie Connelly, Fran Tylavsky); University of Texas Health Science Center, San Antonio (Robert Brzyski, Robert Schenken, Jose Trabal, Mercedes Rodriguez- Sifuentes, Charles Mouton); University of Wisconsin, Madison (Gloria E. Sarto, Douglas Laube, Patrick McBride, Julie Mares-Perlman, Barbara Loevinger); Wake Forest University School of Medi- cine, Winston-Salem, NC (Denise Bonds, Greg Burke, Robin Crouse, Mara Vitolins, Scott Washburn); Wayne State Univer- sity School of Medicine/Hutzel Hospital, Detroit, Mich (Susan Hendrix, Michael Simon, Gene McNeeley).
Principales investigadores del WHI y directores del proyecto:
John Foreyt, PhD (Baylor College of Medicine); Dallas Hall, MD (Emory University);Valery Miller, MD (George Was- hington University); Robert Hiatt, MD (Kaiser, Oakland, Calif); BarbaraValanis, Dr Ph (Kaiser, Portland, Ore); Carolyn Clifford (National Cancer Institute, Bethesda, Md); Frank Meyskens,
Jr, MD (University of California, Irvine); James Liu, MD, and Nelson Watts, MD (University of Cincinnati); Marianna Baum, PhD (University of Miami); Richard Grimm, MD (University of Minnesota); Sandra Daugherty, MD (University of Nevada); David Sheps, MD, and Barbara Hulka, MD (University of Nor- th Carolina, Chapel Hill); William Applegate, MD (University of Tennessee, Memphis); Catherine Allen, PhD (University of Wisconsin). †Deceased.
Reconocemos y agradecemos los esfuerzos dedicados de los investigadores y trabajadores de los centros clínicos del WHI, del centro clínico coordinador del WHI, y de la oficina del programa del National Heart, Lung, and Blood Institute. Más importante aún, queremos hacer un reconocimiento a las participantes del WHI por su extraordinaria cooperación con el programa del WHI.
Referencias
1. Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative. JAMA 2002; 288: 321-333.
2. Chlebowski RT, Hendrix SL, Langer RD, et al. Influence of estrogen plus progestin on breast cancer mammography in healthy postmenopausal women: the Women’s Health Initiative randomized trial. JAMA 2003; 289: 3243-3253.
3. Women’s Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy. JAMA 2004; 291: 1701-1712.
4. Steinberg KK, Thacker SB, Smith SJ, et al. A meta-analysis of the effect of estrogen replacement therapy on the risk of breast cancer. JAMA 1991; 265: 1985-1990.
5. Colditz GA, Hankinson SE, Hunter DJ, et al. The use of estrogens and progestins and the risk of breast cancer in postmenopausal women. N Engl J Med 1995; 332: 1589-1593.
6. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological Studies of 52,705 women with breast cancer and 108,411 women without breast cancer. Lancet 1997; 350: 1047-1059.
7. Schairer C, Lubin J, Troisi R, et al. Menopausal estrogen and estrogen plus progestin replacement therapy and breast cancer risk. JAMA 2000; 283: 485-491.
8. Ross RK, Paganini-Hill A, Wan PC, Pike MC. Effect of hormone replacement therapy on breast cancer risk: estrogen versus estrogen plus progestin. J Natl Cancer Inst 2000; 92: 328-332.
9. Million Women Study Collaborators. Breast cancer and hormone replacement therapy in Million Women Study. Lancet 2003; 362: 419-427.
10. Women’s Health Initiative Study Group. Design of the Women’s Health Initiative clinical trial and observational study. Control Clin Trials 1998; 19: 61-109.
11. National Cancer Institute. About SEER. Available at: https://www.seer.cancer.gov/. Accessibility verified March 28, 2005.
12. American College of Radiology. Breast Imaging Reporting and Data System. Reston, Va: American College of Radiology; 1993.
13. Gail MH, Costantino JP, Bryant J, et al. Weighing the risks and benefits of tamoxifen treatment for preventing breast cancer. J Natl Cancer Inst 1999; 91: 1829-1846.
14. Hulley SB, Grady D. The WHI Estrogenalone trial: do things look any better? JAMA 2004; 291: 1769-1771.
15. Yager JD, Davidson NE. Mechanisms of disease: estrogen carcinogenesis in breast cancer. N Engl J Med 2006; 354: 270-282.
16. Allen DE, de Vries CS, Farmer DT. Pharmaceutical content and regimen of hormone replacement therapy and risk of breast cancer. harmacoepidemiol Drug Saf 2002; 1(suppl 1): 296-298.
17. Li CI, Malone KE, Porter PL, et al. Relationship between long durations and different regiments of hormone therapy and risk of breast cancer. JAMA. 2003; 289: 3254-3263.
18. Olsson HL, Bladstrom A, Ingvar C. Breast cancer incidence in relation to HRT use in Sweden. Proc Am Soc Clin Oncol 2004: 2049.
19. Kerlikowske K, Miglioretti DL, Ballard- Barbash R, et al. Prognostic characteristics of breast cancer among postmenopausal hormone users in a screened population. J Clin Oncol 2003; 21: 4314-4321.
20. Jordan VC, Osipo C, Schafer JM, Fox JE, Cheng D, Liu H. Changing role of the oestrogen receptor in the life and death of breast cancer cells. Breast 2003; 12: 432-441.
21. Liu H, Lee ES, Gajdos C, et al. Apoptotic action of 17 beta-estradiol in raloxifene resistant MCF-7 cells in vitro and in vivo. J Natl Cancer Inst 2003; 95: 1586-1596.
22. Song RX, Mor G, Naftolin F, et al. Effect of longterm estrogen deprivation on apoptotic responses of breast cancer cells to 17 betaestradiol. J Natl Cancer Inst 2001; 93: 1714- 1722.
23. Lewis JS, Meeke K, Osipo C, et al. Intrinsic mechanism of estradiol-induced apoptosis in breast cancer cells resistant to estrogen deprivation. J Natl Cancer Inst 2005; 97: 1746-1759.
24. Berstein LM, Wang JP, Zheng H, et al. Longterm exposure to tamoxifen induces hypersensitivity to estradiol. Clin Cancer Res 2004; 10: 1530-1534.
25. Baum M. The endocrine management of postmenopausal women with early breast cancer. Breast Cancer 2004; 11: 15-19.
26. Ingle JN, Ahmann DL, Green SJ, et al. Randomized clinical trial of diethylstilbestrol versus tamoxifen in postmenopausal women with advanced breast cancer. N Engl J Med 1981; 304: 16-21.
27. Ingle JN. Estrogen as therapy for breast cancer. Breast Cancer Res 2002; 4: 133-136.
28. Lonning PE, Taylor PD, Anker G, et al. Highdose estrogen treatment in postmenopausal breast cancer patients heavily exposed to endocrine therapy. Breast Cancer Res Treat 2001; 67: 111-116.
29. Prasad R, Boland GP, Cramer A, et al. Shortterm biologic response to withdrawal of hormone replacement therapy in patients with invasive breast carcinoma. Cancer 2003; 98: 2539-2546.
30. Howell A, Dodwell DJ, Anderson H, Redford J. Response after withdrawal of tamoxifen and progestogens in advanced breast cancer. Ann Oncol 1992; 3: 611-617.
31. Bhide SA, Rea DW. Metastatic breast cancer response after exemestane withdrawal case report. Breast 2004; 13: 66-68.
32. Kerlikowske K, Smith-Bindman R, Lynn A, et al. Breast cancer yield for screening mammographic examinations with recommendation for short-interval follow-up. Radiology 2005; 234: 684-692.
33. Chlebowski RT, Khalkhali I. Abnormal mammographic findings with short-interval follow-up recommendations. Clin Breast Cancer 2005; 6: 235-239.
34. Yasmeen S, Romano PS, Pettinger M, et al. Frequency and predictive value of a mammographic recommendation for shortinterval follow-up. J Natl Cancer Inst 2003; 95: 429- 436.
35. Thorne SE, Harris SR, Hislop TG, Vestrup JA. The experience of waiting for diagnosis after an abnormal mammogram. Breast J 1999; 5: 42-51.
36. Lerman C, Trock B, Rimer BK, et al. Psychological and behavioral implications of abnormal mammograms. Ann Intern Med 1991; 114: 657-661.
37. Lowe JB, Balanda KP, Del Mar C, Hawes E. Psychologic distress in women with abnormal findings in mass mammography screening. Cancer 1999; 85: 1114-1118.
38. Barton MB, Moore S, Polik S, et al. Increased patient concern after false-positive mammograms: clinician documentation and subsequent ambulatory visits. J Gen Intern Med 2001; 16: 150-156.
39. Weaver DL, Rosenberg RD, Barlow WE, et al. Pathologic findings from the Breast Cancer Surveillance Consortium: population-based outcomes in women undergoing biopsy after screening mammography. Cancer 2006; 106: 732-742.
40. Hartmann LC, Sellers TA, Frost MH, et al. Benign breast disease and the risk of breast cancer. N Engl J Med 2005; 353: 229-237.
41. Greendale GA, Reboussin BA, Sie A, et al. Effects of estrogen and estrogen-progestin on mammographic parenchymal density. Ann Intern Med 1999; 130: 262-269.
42. Thurfjell E. Breast density and the risk of breast cancer. N Engl J Med 2002; 347: 866.
43. McTiernan A, Martin C, Peck J, et al. Women’s Health Initiative Mammogram Density Study Investigators. Estrogen and progestin influence on mammogram density in healthy postmenopausal women in the Women’s Health Initiative Randomized Trial. J Natl Cancer Inst 2005; 97:
1366-1376.
44. Chen W, Petitti DB, Geiger AM. Mortality following development of breast cancer while using oestrogen or oestrogen plus progestin: a computer record-linkage study. Br J Cancer 2005; 93: 392-398.
45. Krecke KN, Gisvold JJ. Invasive lobular carcinoma of the breast: mammographic findings and extent of disease at diagnosis in 184 patients. AJR Am J Roentgenol 1993; 161: 957-960.
46. Berg WA, Gutierrez L, Nessaiver MS, et al. Diagnostic accuracy of mammography, clinical examination, US, and MR imaging in preoperative assessment of breast cancer. Radiology 2004; 233: 830-849.
47. Peer PG, van Djick JA, Hendricks JH, Holland R, Verbeek AL. Age-dependent growth of primary breast cancer. Cancer 1993; 71: 3547-3551.
48. Tilanus-Linthorst MMA, Kriege M, Boetes C, et al. Hereditary breast cancer growth rates and its impact on screening policy. Eur J Cancer 2005; 41: 1610-1617.
49. Kuroishi T, Tominaga S, Morimoto T, et al. Tumor growth rate and prognosis of breast cancer mainly detected by mass screening. Jpn J Cancer Res 1990; 81: 454-462.
50. Morimoto LM, White E, Chen Z, et al. Obesity, body size, and risk of postmenopausal breast cancer: the Women’s Health Initiative (United States). Cancer Causes Control 2002; 13: 741-751.
51. Stefanick ML, Hsai J, Barad D, Johnson SJ, Cochrane B, Liu J. The Women’s Health Initiative postmenopausal hormone trials: overview and baseline characteristics of participants. Ann Epidemiol 2003; 13(suppl I): S78-S86.
