Jorge Mario Gómez Jiménez*;
Natalia Aguirre Zimerman;
Alejandro Quintero Galeano;
Jader Gómez Gallego**
Resumen
Presentamos una actualización del conocimiento acerca de la asociación entre la Preeclampsia y los anticuerpos antifosfolípidos, con el ánimo de optimizar el enfoque diagnóstico y terapéutico que ofrecemos a nuestras pacientes y sentar las bases que permitan plantear hipótesis para iniciar investigaciones que ayuden a los profesionales que responden por las enfermas a su mejor comprensión y atención.
Palabras Claves: Preeclampsia, anticuerpos antifosfolípidos, anti b2 glicoproteína 1.
Summary
We are looking to give un update about the relationship between preeclampsia and antiphospholipid antibodies, with the aim to optimize the diagnostics and therapeutical clinical keys offered to patients. Therefore, to improve the generation of hypothesis and in consequence to do easier to the Physicians and patient carers the research processes, with a better comprehension and treatment skills.
Key Words: Preeclampsia, antibodies, antiphospholipid, anti b2 Glicoprotein 1.
Introducción
La Hipertensión inducida por el embarazo causa entre el 30 y el 50 % de la mortalidad materna en todo el mundo y todavía es muy frecuente en los países pobres (15 % en los hospitales universitarios) (1-2).
La presentación antes de las 34 semanas de gestación y en la variedad severa o complicada se asocia generalmente a una enfermedad de base: glomerulonefritis, transtornos de la coagulación en su fase fibrinolítica, diabetes insulinodependiente, etc.
Se ha postulado que existe relación entre el síndrome antifosfolípido y la preeclampsia, especialmente cuando se presenta antes de las 34 semanas de gestación o con complicaciones graves como el accidente cerebro vascular, la cardiomiopatía, la ceguera transitoria y otros fenómenos trombóticos. (3-4)
Hemos iniciado una investigación sobre éstos tópicos y deseamos compartir con los lectores algunos aspectos del marco conceptual que nos permitió diseñar el proyecto.
Bases inmunológicas
Los aPL son un grupo heterogéneo de autoanticuerpos (Igs de tipo G, Ig M o ambas) dirigidos frente a los fosfolípidos con carga negativa, que se caracterizan por interferir in vitro con el complejo activador de la protrombina (protrombina, factores Xa, V, Calcio) probablemente inhibiendo la interacción de dichos factores y los fosfolípidos; otra característica es que pueden ocasionar falsos positivos biológicos con el VDRL. (5, 12).
Paradójicamente los pacientes que presentan el anticoagulante lúpico (AL) o los aCL no sufren diátesis hemorrágicas, sino, al contrario, tienen tendencia a la trombosis, incluso de tipo catastrófico. Existen factores exógenos y endógenos para la producción de aPL (6, 11):
– Estímulos exógenos no asociados con trombosis como Infecciones, Neoplasias, Enfermedades autoinmunes y consumo de drogas como Clorpromazina, Hidralazina, Propanolol, Procainamida, Quinidina, Acido valproico, Amoxicilina, Estreptomicina, Interferón, etc. Un modificador del efecto biológico de los aPL es la resistencia del huésped. Los pacientes con más grandes concentraciones en la superficie endotelial de antitrombina III, proteínas C y S o prostaciclina sintetasa pueden ser menos susceptibles a las consecuencias adversas potenciales de los aPL. La variación en el contenido fosfolipídico de las membranas causada por factores genéticos o dietarios también pueden modificar la resistencia del huésped al efecto de los Acs.
Los factores endógenos: Incluye aPL asociados con perturbaciones de la membrana endotelial y a menudo están asociados con trombosis. Son aPL que generalmente reconocen complejos proteína-fosfolípidos. Tales aPL, se piensa, son generados en respuesta a la inmunorregulación aberrante que acompaña los desórdenes autoinmunes.
Recientemente, se ha teorizado que estos aPL pueden ser generados por cualquier condición patológica que cause que los fosfolípidos aniónicos normalmente residentes sobre la membrana más interna (citoplasmática) de la célula endotelial se expresen sobre la membrana externa (extracelular) o que induzca fosfolípidos de fase hexagonal; los cuales son inherentemente inmunogénicos. Esto, a su vez, permite a un número de proteínas de unión a fosfolípidos ser presentadas al sistema inmune en conformaciones únicas neoantigénicas dando origen a los aPL. Tal mecanismo podría dar cuenta de la aparición de aPL en una amplia variedad de condiciones,cada una de las causales está asociada con disturbios en la homeostasis endotelial (p.e. enfermedades autoinmunes, trombosis, síndrome de Sneddon, enfermedad vascular aterosclerótica y ciertos desórdenes del embarazo) (11).
Patogénesis
El RCIU, la PE y las MFs, procesos todos ellos comunes a las gestaciones asociadas a la presencia de los aPL, constituyen un grupo de trastornos con una patología similar en el lecho placentario: trombosis en la circulación úteroplacentaria, con la consiguiente inadecuada perfusión sanguínea que lleva a una placentación anómala en el embarazo inicial y posteriormente al infarto placentario. Los pacientes con aPL también presentan evidencia de vasculopatía de las arterias espirales, “aterosis aguda”.
Los mecanismos patogénicos para la trombosis placentaria son:
– Interferencia con fosfolípidos endoteliales y plaquetarios.
– Hiperagregabilidad de la membrana plaquetaria inducida por aPL.
– Interferencia con la síntesis endotelial de prostaciclina.
– Síntesis endotelial incrementada del factor de Von Willebrand y del factor activador plaquetario.
– Inhibición de la actividad anticoagulante de las proteínas C y S, y/o antitrombina III sobre los fosfolípidos endoteliales.
– Deterioro de la fibrinolísis.
El actual epitope para aCL con o sin actividad anticoagulante in vitro parece ser el complejo B2GP1- fosfolípido aniónico. La B2GP1 puede funcionar como un anticoagulante uniéndose a fosfolípidos aniónicos expuestos e inhibiendo la cascada intrínseca de la coagulación, inhibiendo la actividad protrombinasa o inhibiendo la agregación plaquetaria. Así, la interferencia mediada por los aPL con estas funciones de la B2GP1 pueden promover la trombosis placentaria y sistémica.
La Anexina V humana, también llamada proteína anticoagulante placentaria y endonexina II, es una proteína de 35,000 MW la cual, al igual que la B2GP1, se une a fosfolípidos aniónicos exteriorizados para hacer sus superficies no trombogénicas. La anexina V ha sido inmunolocalizada en la placenta a nivel de las microvellosidades sincitiotrofoblásticas y se ha demostrado que es constitutivamente expresada en cultivos de trofoblastos. En este sitio impide la trombosis intervellosa y promueve el flujo sanguíneo úteroplacentario.
Lockwood y Rand (13) han observado recientemente que la anexina V está disminuida en pacientes con concentraciones altas de aPL y con una historia de mortinatos recurrentes o pérdidas tardías del embarazo.
Debido a que la Anexina V inhibe la unión de los aPL al complejo B2GP1-Fosfolípidos, se sugiere que los aPL pueden, contrariamente, causar desplazamiento de la anexina V de la superficie sincitiotrofoblástica y hacerla procoagulante.
Es posible que una interferencia mediada por los aPL con esta Anexina V pueda causar también interferencia de la sincialización trofoblástica proporcionando un mecanismo alterno para una función placentaria aberrante.
El resultado del embarazo depende de la severidad de esta patología, y queda por resolverse el interrogante de si los aPL son la causa, la consecuencia o una coincidencia en los fenómenos tromboembólicos.
Indicaciones de Pesquiza
– Dos o más abortos del primer trimestre.
– MF intraútero de causa inexplicable durante los dos últimos trimestres del embarazo.
– Enfermedad clínica autoinmune complicando la gestación.
– Falso positivo de la serología luética en el embarazo o anteriormente.
– PE, especialmente si apareció en más de una gestación y en casos graves de inicio precoz.
– RCIU.
– Abrupcio placentario, hematoma subcorial.
– Antecedentes de trombosis (arterial o venosa)
– Trombocitopenia de causa inexplicable o pruebas de coagulación alteradas en el embarazo.
Los aPL pueden estar presentes también en personas sanas, incluyendo a mujeres gestantes y ancianos, generalmente a niveles bajos y sin consecuencias clínicas significativas. (15-17).
Aspectos Epidemiológicos
La prevalencia de aCL en pacientes sanos según El Roely A y Collicher N., en 400 personas sanas (50% hombres) fue de 1.8% para Ig G y 1% para Ig M. (18). En 300 ancianos sanos fue del 12% para Ig G y 12% para Ig M (19).
La prevalencia de aCL en poblaciones de embarazadas saludables ha sido reportada en un rango del 1 al 4%. Harris y colaboradores en un grupo de 1.449 mujeres encontraron 1,8% de prevalencia para Ig G y 4.3% para Ig M. Los autores recomiendan que las pruebas de aCL no se utilicen como tamizaje de mujeres sanas ya que es infrecuentemente positivo en esta población, y aún cuando fueran positivos los niveles son usualmente bajos y de significancia incierta. Sugieren que el tratamiento agresivo puede estar justificado durante el embarazo de mujeres con antecedentes de aborto recurrente que tienen resultados positivos bajos de Ig G aCL o bajos o moderados de Ig M aCL; pacientes con trombosis venosa profunda (TVP), enfermedad cerebrovascular (ECV) y lupus eritematoso sistémico (LES). Sugieren el tratamiento en pacientes con resultados de la prueba Ig G aCL moderada o altamente positiva o el test de LA positivo (17).
Aspectos Técnicos y Correlación Clinicopatológica
Debido a la falta de estandarización de las pruebas para la determinación de los aPL y a la marcada variabilidad de laboratorio a laboratorio, se han publicado recientemente diferentes líneas básicas y criterios recomendados para su determinación (20).
La cardiolipina es parte del Ag usado en la práctica del VDRL. Los aCL se detectan habitualmente mediante técnicas de Elisa que determinan las Ig G o Ig M aCL empleando cardiolipina disuelta en etanol como Ag. Actualmente se dispone de varios estuches comerciales para su determinación.
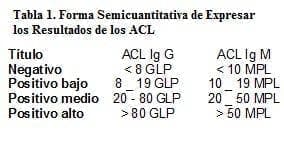
Las pruebas de determinación de los aCL, en comparación con los del LA, son más sensibles, tienen menos errores intraobservador y pueden realizarse empleando suero congelado. Sin embargo, aún así, existe una relativamente amplia variación de los resultados para una muestra dada, tanto interensayo como entre los diferentes laboratorios que realizan la prueba. En un intento por lograr una mejor concordancia de los resultados, un taller internacional (20) ha recomendado una manera semicuantitativa de expresar los resultados, que deben ser dados como positivos altos, medios, bajos o negativos.
GPL y MPL se refieren a las unidades Ig G e Ig M de los aCL. (20).
En el estudio realizado por Branch y cols. (7) con 43 mujeres gestantes que presentaron PE severa antes de la semana 34 de edad gestacional, se encontró que un 16% de las pacientes tenía niveles significativos de aPL y ninguno de los controles normotensos de edad gestacional similar tuvieron aPL ( p< 0.001 ). También encontraron complicaciones periparto en 3 de las 7 mujeres con los aPL positivos (infarto cerebral, episodios de ceguera monocular transitoria, TEP, TVP y amnesia); estos autores sugieren que los aPL se encuentran en una proporción sustancial de casos con PE severa de presentación temprana y tienen importantes implicaciones clínicas. Sugieren que estas pacientes sean tamizadas para los aPL y en el caso de hallarse positivos se inicie terapia profiláctica con anticoagulación.
En el estudio de Oshiro y cols. (21) en un análisis retrospectivo de 366 mujeres que tuvieron dos o más embarazos perdidos, con un sólo hijo vivo, encontraron que el 21% eran positivas para aPL con títulos mayores de 20 unidades GLP y concluyen que la muerte fetal (MF) es más característica que la pérdida temprana del embarazo en el primer trimestre.
Polzin y cols. en un estudio prospectivo de un año de duración, siguieron a 55 mujeres a quienes se les sospechaba RCIU, encontraron que el 27% de estas pacientes eran positivas para aCL y concluyeron que existe una asociación estadísticamente significativa entre la presencia de éstos Acs y el RCIU. Sugieren que una asociación causal debe aclararse con otros estudios (22).
Yasuda, y cols. (8) publicaron en 1995 un estudio prospectivo donde investigaron la asociación aCL con resultados adversos del embarazo (aborto espontáneo, RCUI, PE). La población de estudio fue de 860 mujeres embarazadas a las cuales se les midió aCL por método de Elisa durante el primer trimestre del embarazo. Se compararon posteriormente los resultados de las pacientes positivas con los resultados de las negativas para los aCL. Se excluyeron de este trabajo las pacientes con pérdida fetal recurrente que estaban siendo manejadas con prednisona. Los resultados mostraron que el aborto, el retardo en el crecimiento intrauterino y la preeclampsia se presentaron significativamente más frecuentemente en los casos. (p< 0.001 para las tres complicaciones)
La prevalencia de los aCL fue del 7%, la que es más alta que la encontrada en otros estudios (2,1% reportada por Petri y cols. (23) y 2.2% reportada por Lockwood y cols. (16)). La razón de esta discrepancia la atribuyen los autores a haberse realizado el estudio en un centro de referencia.
La conclusión del trabajo fue que la presencia de los aCL está asociada a resultados adversos del embarazo (8).
En el cuarto simposio internacional sobre aPL realizado en Italia en abril de 1990, Matsuura y cols. (24) reportaron que los aCL obtenidos del suero de pacientes con enfermedades autoinmunes reaccionaban con un complejo: “cofactor” – Fosfolípidos cargados negativamente; se identificó este cofactor como B2GP1 o apolipoproteína H; el cual tiene una masa molecular de 50 KD. y es un inhibidor natural de la cascada de la coagulación ya que inhibe la vía intrínseca de la coagulación y la agregación plaquetaria mediada por el ADP. Esto explica por qué la interferencia con la función de la B2G1 por parte de los aPL podría dar como resultado trombosis y aumento de la agregación plaquetaria (9).
Los niveles séricos de B2GP1 pueden variar significativamente. Se ha observado una variación cuantitativa genéticamente controlada con una herencia codominante autosómica que involucra un alelo normal BgN y un alelo deficiente BgD. Los heterocigotos tienen la mitad de los niveles normales de B2GP1 (11mg/ 100ml) y los homocigotos para BgD tienen niveles casi no detectables del cofactor (9).
El papel jugado por el cofactor sigue siendo controvertido. Galli y cols. sugirieron que la B2GP1 era el Ag blanco real para los aPL (25), mientras otros creen que un complejo proteína fosfolípido es reconocido por los aPL y que la presencia del cofactor es un requerimiento absoluto para ese reconocimiento. Otros investigadores controvierten esta visión expresando que aunque el cofactor aumenta la unión de los aPL purificados a los fosfolípidos, la presencia del cofactor no es un requerimiento absoluto ya que los aPL (Ig G purificada) puede unirse a los fosfolípidos en la ausencia del cofactor (25).
Matsuura y cols. (26) demuestran que en 1992 los aCL pueden ser divididos en dos subgrupos:
– B2GP1 “dependiente” aCL: como un tipo asociado con enfermedades autoinmunes.
– B2GP1 “independiente” aCL: como un tipo asociado con infecciones.
El estudio de Katano y cols. (27) publicado en 1996 es el primero en aclarar prospectivamente si la B2GP1 de dependiente aCL puede predecir un resultado adverso en el embarazo de mujeres saludables y si ésta debería ser utilizada como una prueba de tamizaje. Se diseñó un estudio de cohorte prospectivo con 1,125 mujeres embarazadas sanas a quienes se les midió mediante técnica de Elisa modificada la presencia o ausencia de los anticuerpos antiB2GP1 en presencia o no de anticardiolipina.
Dividieron la población en tres grupos: antiB2GP1 dependiente positivo, antiB2GP1 independiente y negativos. Los grupos se compararon para los siguientes resultados adversos del embarazo: MF intrauterina (después de las 12 semanas de edad gestacional), RCIU, PE. Los resultados fueron (ver tabla 2):
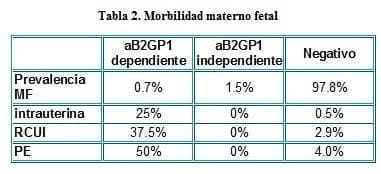
Referencia (27)
Las conclusiones de este trabajo fueron las siguientes:
1. La Anti B2GP1 dependiente de aCL está significativamente asociada con resultados adversos del embarazo.
2. La Anti B2GP1 independiente no está asociada con los resultados adversos del embarazo. En concordancia con Aoki y cols. en 1994. (28).
Los autores sugieren la introducción de la Anti B2GP1 dependiente de aCL como una prueba de tamizaje rutinaria para las mujeres embarazadas en general.
Faden, D. y cols. publicaron en 1997 el primer estudio prospectivo de aCL y Acs anti B2GP1 como posible nuevo marcador de patología relacionada con los aPL. (10). Los autores estudiaron 510 mujeres embarazadas sanas entre las 15 y 18 semanas de edad gestacional y las categorizaron en tres grupos de acuerdo con los resultados:
Grupo I: negativo para ambos Acs, grupo II: positivo para los Acs anti B2GP1 y grupo III: positivos para aCL. En los tres grupos se comparó: la rata de pérdida fetal, abrupcio placentario, preeclampsia eclampsia (PE-E), y RCIU. Los resultados fueron (ver tabla 3):
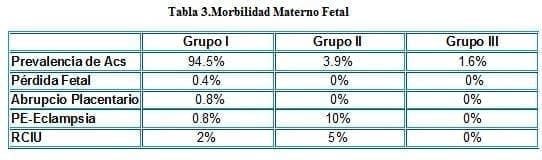
Con una p< 0.021 para PE-E
Las otras asociaciones no significantes (10)
Los hallazgos del estudio indican que los Acs anti B2GP1 están asociados con algunas complicaciones obstétricas, principalmente PE- E, aún si los aPL más convencionales no están presentes.
Por todo esto los autores concluyen que según sus hallazgos los Acs anti-B2GP1 no deben buscarse rutinariamente en las pacientes obstétricas de bajo riesgo, pero sí deben ser investigados en las pacientes con PE-E, historia de PE severa temprana y/o recurrente, con seguimiento en los siguientes embarazos, para administrar terapia profiláctica con bajas dosis de aspirina o heparina. Y además que la asociación de los Acs anti-B2GP1 con otras complicaciones gestacionales como son RCIU y MF no están aún clarificadas.
Terminan su trabajo con los siguientes comentarios:
Está ampliamente aceptado que los mecanismos patogénicos responsables de la PE pueden deberse al daño del endotelio, por la liberación de compuestos vasoactivos (29). De otro lado, reportamos que líneas de B2GP1 se encuentran en la superficie del endotelio placentario en las pacientes con aPL que desarrollan PE (30). Además está demostrado también que las células del endotelio de la vena umbilical humana son reconocidas por aPL únicamente a través de la unión de la B2GP1 a las células. (31-32). A este respecto Del Papa y cols. demostraron la afinidad de los Acs policlonales, purificados anti B2GP1 y también que los Acs humanos monoclonales son capaces de promover la activación endotelial con la expresión de diferentes moléculas de adhesión, como la molécula leucocitaria de adhesión endotelial (ELAM-1), VCAM-1 y la molécula de adherencia intercelular (ICAM-1), así como también la producción de interleucina 6 (IL 6) y 6cetoPGF1alfa (32). Sin embargo podríamos suponer que la promoción del daño endotelial por los Acs anti B2GP1 es el punto inicial para la cascada de eventos subsiguientes que llevan al síndrome de PE (33).
Se deben realizar más estudios con un gran número de pacientes PE para clarificar si la presencia de éstos nuevos Acs descritos puede jugar un papel patogénico en el desarrollo de éste síndrome (10).
Glosario
Abreviaturas
APL: Anticuerpos antifosfolípidos
IgG: Inmunoglobulina G
IgM: Inmunoglobulina M
VDRL: Serología para sífilis
AL: Anticoagulante lúpico
AcI: Anticardiolipina
RCIU: Retardo en el crecimiento intrauterino
PE: Preeclampsia
MF: Muerte fetal
B2GP1: Beta 2 Glicoproteína 1
AB2GP1: Anticuerpos antibeta2glicoproteína1
LA: Anticoagulante lúpico
TEP: Tromboembolismo pulmonar
TVP: Trombosis venosa profunda
ADP: Adenosindifosfato
Bibliografía
1. E.U. Population Reference Bureau (PRB). Resumen de las conclusiones del Consejo Nacional de Investigación de la Academia Nacional de Ciencias de los E.U. “Cómo mejorar la salud reproductiva de los países en desarrollo”. Washington. Oct 1997.
2. Presidencia de la República, Departamento Nacional de Planeación, Ministerio de Salud y otros. “Mortalidad Materna en Colombia”. Santafé de Bogotá, Agosto 1996.
3. Williams Obstretrics, 20 Edición, Cap. 31, Pg. 693-744.
4. Creasy. Maternal-fetal Medicine. Cuarta edición, W. B. Saunders Company, Cap. 48. Págs. 833-872.
5. Stone J. y cols. Risk Factors for Severe Preeclampsia. Obstetrics and Gynecology. 1994; 83(3): 357-61.
6. Sibai B. Aspectos inmunitarios de la PE. Clínicas Obstétricas y Ginecológicas. 1991; 1: 27-33.
7. Branch D. y cols. The association of Antiphospholipid Antibodies With Severe Preeclampsia. Obstetrics and Gynecology. 1989; 73(4): 541-45.
8. Yasuda M, Takakuwa K, Tokunaga A, Tanaka K. Prospective Studies of the Association Between Anticardiolipin Antibody and Outcome of Pregnancy. Obstetrics and Gynecology. 1995; 86(4) parte 1: 555-59.
9. Gharavi A. Antiphospholipid Cofactor. Stroke. 1992; Suplement 1 23(2) 1-7.
10. Faden D. y cols. anti-beta 2 glycoprotein I antibodies in a general obstetric population: preliminary results on the prevalence and correlation with pregnancy outcome. Anti-b2 glycoprotein I antibodies are associated with some obstetrical complications, mainly preeclampsia-eclampsia. European Journal of Obstetrics and Gynecology and Reproductive Biology. 1997; 73: 37-421.
* Profesor Asistente. Departamento de Obstetricia y Ginecología. Facultad de Medicina. Universidad de Antioquia.
** Residentes de primer año. Departamento de Obstetricia y Ginecología. Facultad de Medicina. Universidad de Antioquia.
