Blanca Cecilia Díaz Gutiérrez*
* Enfermera, Pontifi cia Universidad Javeriana. Coordinadora
de Pediatría Fundación Santa Fe de Bogotá.
Correspondencia: enfermeria@fsfb.org.co
Recibido: Noviembre de 2004
Aceptado para publicación: Junio de 2005
Actual. Enferm. 2005;8(3):25-29
Resumen
La oxigenación por membrana extracorpórea conocida tradicionalmente con las siglas en ingles de ECMO, es una forma de asistencia vital extracorpórea de alta complejidad en el tratamiento de la insuficiencia respiratoria aguda neonatal.
Este soporte cardiaco y pulmonar proporciona tiempo (general mente tres semanas) para que los neonatos mejoren su sistema respiratorio y puedan ser regresados a la ventilación convencional y el soporte cardiaco mínimo. Las com plicaciones durante y después de la ECMO pueden ser severos, razón por la cual esta técnica no es ofrecida a menos que haya una mortalidad pronosticada de 80% con la terapia convencional.
Las causas respiratorias neonatales constituyen los diagnósticos más comunes en ECMO. A pesar de los avances hechos en ventilación asistida, incluyendo terapias tales como la ventilación oscilatoria de alta frecuencia (HFOV) y el óxido nítrico, algunos neonatos no mejoran y mueren de insuficiencia respiratoria. En estos casos es cuando la terapéutica con ECMO se constituye en una terapia alternativa que va a permitir un soporte cardiaco pulmonar per mitiendo tiempo para que el neonato mejore y pueda ser regresado a la ventilación convencional.
Palabras clave: ECMO (Extracorporeal Membrane Oxygenation), HFOV (High Frecuency Oscillatory ventilation, ONi (Nitric Oxide), surfactante, insuficiencia respiratoria neonatal.
Abstract
Extracorporeal membrane oxygenation, known as ECMO is a modality of extracorporeal vital support in the treatment of acute neonatal respiratory insufficiency.
This type of cardiac and pulmonary support (generally of three weeks duration) allows the improvement of the infants respiratory a system so that they can be placed on conventional ventilatory support and minimal cardiac support.
Complications of ECMO can be severe, and for this reason it is offered to infants with a predicted mortality rate of 80% under conventional therapy.
Causes of neonatal respiratory insufficiency represent the most common diagnoses in patients under ECMO. Despite advances in assisted mechanical ventilation, including modalities such as high frequency oscillatory ventilation and nitric oxide, some neonates fail to improve and die of respiratory insufficiency. This is the situation where ECMO becomes a therapeutic alternative that provides cardiopulmonary support and allows time for improvement so that the neonate can be returned to conventional ventilation.
Key words: ECMO (Extracorporeal Membrane Oxygenation), HFDV (High Frequency Oscillatory Ventilation), NiO (Nitric Oxide), surfactant, respiratory insufficiency.
Introducción
La técnica ECMO fue derivada de los primeros sistemas de pulmón y corazón artificiales descritos por John Gibbon(1) y empleada por primera vez en cirugía cardio vascular en 1956. Sin embargo, a finales de 1969 fue cuando estos sistemas se modificaron para poder mantener en forma prolongada las fun ciones vitales. Barlett en 1975 aplicó la ECMO por primera vez en un recién nacido que sobrevivió gracias al uso de está. Inicialmente las indicaciones se limitaban a la patolo gía respiratoria grave en la edad neon atal pero a mediados de 1980 se adop taron los sistemas para su aplicación en pacientes pediátricos y finalmente en la década de 1990 en adultos. La asociación ELSO (Extracor poreal Life Support Organization), fundada en 1989 documentó más de 24.000 pacientes tratados (18.000 neonatos, 4.000 pacientes pediátricos y 1.000 dultos) (Figura 1).
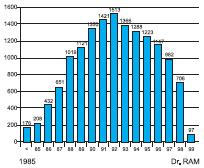
Figura 1. Número de Casos por Año que Requirieron ECMO de Acuerdo con el Registro de la Organización para el Soporte de Vida Extra Corpórea (ELSO), Ann Arbor, Michigan, 1980-1999.
A diferencia de la circulación extra corpórea clásica empleada durante la cirugía cardiovascular, la mayor duración del procedimiento, (de días y no horas), obligó a la evolución del circuito ECMO siendo el principal avance el oxigenador de membrana, que intercambia gases más fisiológicamente por difusión en lugar de la exposición di recta. Igualmente se refinaron las técnicas de anticoagulación prolongadas, el man te nimiento de la normoter mia y la ausen cia de hemodilución.
La conexión del circuito al paciente se realiza mediante la utilización de los vasos sanguíneos del cuello por medio de la canulación de la vena yugular interna para el flujo de salida y la arteria carótida común para el flujo de entrada.
Las bombas que impulsan la sangre son en general de dos tipos, de rodillos, oclusivas y no oclusivas y centrífugas, con diferentes ventajas y desventajas para cada una de ellas. La mayoría de los centros ECMO, continúan con el uso de bombas de rodillo. La oclusividad del sistema requiere la inter posición entre la cánula venosa y la bomba, de un reservorio o “bladder ” que garantiza un débito de sangre con tinuo a la bomba que impulsa la san gre, permitiendo un flujo y circulación ade cuada en el circuito y manteniendo al paciente en condi cio nes de actividad metabólica próximas a la situación de normalidad.
Un estudio británico, multicéntrico aleatorizado y controlado pu blicado en 1996(3) demostró disminu ción de la mortalidad con el empleo de la ECMO, frente al tratamiento con vencional en pato lo gía respiratoria neonatal y la disminu ción del riesgo de fallecimiento no asociado con un au mento de secuelas en el paciente que sobrevive.

Los altos costos del mantenimiento de este programa exigen a cada centro tratar mínimo 12 pacientes por año.
Actualmente se cuenta con 145 centros de ECMO en el mundo.
Las terapias alternativas como HFOV, el surfactante y el ONi, han contribuido a disminuir los centros activos. Se estima que actualmente en U.S.A, uno de cada 1309 nacidos vivos se beneficiaría del tratamiento con esta téc nica.(6)
Durante el último año se dio inicio al programa de ECMO en la Fundación
Santa Fe de Bogotá, creando un grupo interdisciplinario conformado por un pediatra neonatólogo, tres pe diatras de la unidad neonatal, un cirujano pediatra, tres terapeutas respiratorias, y cinco enfermeras profesionales, coordinados todos en la parte médica por el neonatólogo y en la parte de enfermería por la enfermera jefe del área con entrenamiento en circulación extra corpórea.
En el mes de abril, se tuvo la primera experiencia con una paciente de 4 días de edad, remitida de un centro hos pitalario local con dia gnóstico de Hernia Diafragmática Con génita. Ingresó a la unidad Neonatal y desde ese momento se mantuvo por ocho días en ECMO, al cuarto día se realizó la corrección qui rúrgica de la hernia diafragmática y se retiró con éxito del sistema de circu lación extracorpórea.
La paciente fallece por insuficiencia respiratoria ocasionada por la hipo plasia pulmo nar. (Figura 2)
Figura 2. Primer caso de paciente neonatal
sometido a ECMO en la Fundación Santa Fe de Bogotá
Componentes del Sistema
El sistema tiene un circuito confor mado por tubos de plástico de diferente calibre según el flujo que se requiera mantener, en el que se intercala un reservorio ve no so, una bomba que impulsa la sangre, un oxigenador, generalmente de mem brana de si li co na, un módulo de con trol de gas para el suministro de oxí geno y gas carbónico y un sistema de calenta miento de la sangre; ade más de cánulas para el acceso vascu lar que van a conectarse con el circui to. Dentro de este sistema existe un control de módulos de presión que van a regular y a supervisar el buen funcionamiento del circuito, aseguran do que las tasas de entrega de sangre de la bomba al paciente y el drenaje de sangre del paciente a la bomba, sea exacto.
El reservorio venoso (bladder) hace las veces de aurícula derecha y asegura que un adecuado volumen de sangre de reserva sea mantenido mediante el monitoreo de presión de la sangre que viene a la bomba. Los oxigenadores más empleados son los de membrana siliconada enrollada sobre sí misma a través de la cual circula la sangre y el gas en sentido contrario. La membrana siliconada porosa permite el intercambio gaseoso. Los tamaños más apropiados para uso neonatal son de 0,6 m2 y 0,8 m2 los cuales tiene tasas de flujo de 1 y 2 L/min. La superficie del oxigenador que se em pleará dependerá del flujo total necesario para mantener el gasto cardia co. (Figura 3)

Figura 3. Oxigenador de Membrana
El circuito toma la sangre del paciente a través de una cánula venosa situada en la aurícula derecha introducida a través de la vena yugular interna derecha; la sangre es drenada por gravedad al reservorio venoso y es impulsada por la bomba hacia el oxigenador donde se permite el intercambio gaseoso, posteriormente pasa al calentador y es impulsada a la aorta, a través de la arteria carótida del mismo lado.

Figura 4. Circuito Venoarterial Utilizado para ECMO
Tipos de Bomba
Diferentes tipos de bombas han sido utilizados para la circulación extra corpórea, la de rodillo, la bomba de “impelador”, y la bomba centrifuga.

Figura 5. Diferentes Tipos de Bomba
Algunas bombas han sido diseñadas para proveer un flujo pulsátil preciso, copiando el impulso cardiaco; y otras bombas no pulsátiles dan el flujo más alto posible.
La mayoría de los centros ECMO continúa usando la bomba de rodillo no pulsátil, en las cuales un segmento de la tubería del circuito es posicio nado dentro de un compartimento de metal circular o canal en el cual la tu bería es comprimida por los rodillos. La cantidad de presión de los rodillos comprimiendo la tubería contra el canal, es llamada “oclusión”, la cual genera un flujo continuo empujando un bolo de líquido en cada revolución; el flujo es controlado por la velocidad de rotación, longitud y diámetro de la tubería en el cabezal de la bomba.

Figura 6. Bomba de Rodillo Stoker Shiley
La bomba centrífuga, no maneja oclusividad, generando presión negativa con riesgo importante de alteración sobre la membrana eritrocitaria representa da en hemólisis y trastornos iónicos.(6)
Tipos de Oxigenación de Membrana Extracorpórea
El soporte extracorpóreo consiste en el drenaje de sangre venosa, la remoción del dióxido de carbono, la adición de oxigeno a través de un pulmón artificial y el retorno de la sangre a la circulación mediante dos tipos de oxigenación por membrana extracorpórea: venovenoso (V-V) y venoarterial (V-A).
En ECMO V-A, las funciones del corazón y pulmón son reemplazadas parcial o totalmente. Está indicada cuando existe necesidad de soporte hemodinámico por falla miocárdica o ante la presencia de insuficiencia cardiacarefractaria al tratamiento médico como en las cardiopatías congénitas antes o después de su corrección quirúrgica. Se realiza un cortocircuito o by-pass cardiopulmonar completo, tomándosela sangre desde el territorio venoso sistémico, a través de una cánula situada en la aurícula derecha y devolviéndola una vez oxigenada, por la cánula arterial, comúnmente ubicada en la arteria carótida derecha con su extremo en dirección al arco aortico.
Proporciona una buena oxigenación y remoción de CO2.
En ECMO V-V, el gasto cardiaco es completamente dependiente de la función del corazón nativo. Este tipo de bypass permite a la circulación nativa proveer flujo pulsátil fisiológico de un modo natural, y sustituir la función respiratoria. La alta capacidad de remo ver CO2, permite al paciente quedar en apnea, ofreciendo un soporte respiratorio eficaz mientras la pato logía de base mejora. Utiliza una cánula de doble luz en la aurícula derecha, usualmente a través de la vena yugular in terna derecha.
Principios Fisiopatológicos
Los principios fisiopatologicos son aplicados de igual manera tanto en recién nacidos, como en niños y adultos.
El objetivo de la ECMO es garantizar un transporte adecuado de oxígeno a los tejidos. Ésta depende en circunstancias normales de un adecuado contenido de oxígeno en la sangre y un gasto car diaco suficiente. El em pleo de la ECMO garantiza el contenido de O2 en la san gre al poder saturarse la hemoglobina extracorporalmente y no depender de la función pulmonar primitiva del pa ciente. El intercambio de O2 se hace dependiente de la velocidad a la cual la sangre pasa la membrana del oxige nador o velocidad del flujo sanguíneo y el área de superficie de la membrana. Además el barrido de CO2 se realiza también en forma extracorpórea y es función de la relación ventilación perfusión del oxigenador.
La eliminación de CO2 de un pulmón de membrana es dependiente de dos factores: las concentraciones relativas de CO2 en la sangre y el flujo de gas que ingresa a través del oxigenador (gas barrido). El flujo sanguíneo en el circuito y hacia la membrana está limitado por el volumen sanguíneo circulante total del paciente y por la longitud y el diámetro (resistencia) del catéter venoso.
El sistema deberá manejar un flujo de 120 ml/kg/min para un soporte cardiorespiratorio casi total. Si el volumen de sangre removida es exactamente igual al volumen de sangre infundida, no habrá efectos en la PVC, en el llenado ventricular derecho e izquierdo ni en el comportamiento hemodinámico del paciente.
Criterios de Selección de Pacientes(7)
• Edad gestacional mayor de 34 semanas.
• Peso neonatal mayor de 2.000 g.
• Coagulación adecuada sin complicaciones hemorrágicas
• Ausencia de hemorragia intra craneal grave
• Ventilación mecánica por menos de 10 a 14 días
• Lesión pulmonar reversible
• Ausencia de malformaciones letales
• Falla circulatoria reversible: isquemia miocárdica, cardiopatía quirúrgica
• Insuficiencia respiratoria refractaria a la terapia convencional “máxi ma” con riesgo de muerte sin ECMO mayor de 80%.
• Dentro de las alteraciones respira torias o cardiacas agudas y rever sibles que podrían tener resultados satisfactorios con la utilización del ECMO están:
• Síndrome de dificultad respiratoria
• Síndrome de bronco- aspiración de meconio hipertensión pulmonar persistente en el neonato
• Hernia diafragmática congénita
• Sepsis
• Apoyo vital antes de cirugía cardiaca o después de realizada
• Síndrome de dificultad respiratoria aguda.
Criterio para Considerar a un Neonato como Candidato para ECMO
Cada caso debe individualizarse en el contexto de la gravedad de la enfer medad o la velocidad de deterioro del paciente. Típicamente los criterios de selección analizan la oxigenación arterial en relación con el grado de res paldo respiratorio, determinados por:

La estabilización del paciente antes de usar ECMO incluye la asistencia ventilatoria óptima y un lapso de prueba con ventilación de alta frecuencia, apoyo volumétrico, vasopresores, vasodilatadores, agentes tenso activos y óxi do nítrico. Estas medidas deben utili zar se en un centro en el cual se pueda iniciar rápidamente la ECMO si el niño no reacciona de manera adecua da.
La Intervención de Enfermería en la Oxigenación con Membrana Extracorpórea Exige:
• Conocimiento técnico científico que le permita una actuación pre cisa oportuna y eficiente acorde con la situación de cada paciente
• Control y registro de parámetros fisiológicos: signos vitales, tiempo de coagulación activado, flu jo de ECMO, ingreso y egreso de líquidos, nivel de conciencia, pará metros de ventilador.
• Control y registro escrito de parámetros bioquímicos: gases arte riales, electrolitos, cuadro hema tico, pruebas de coagulación, cul tivos de sangre según estén indica dos.
• Administración de medicamentos: elimi nar burbujas de aire, corroborar exhaustivamente la identidad de las dosis de fármacos antes de in troducirlos en goteo, no admi nistrarmedicamentos por via IM o pun ción venosa, administrar los me dicamentos por el lado venoso del circuito ECMO, administrar alimentación parenteral.
• Ofrecer apoyo pulmonar: en coordinación con la terapeuta respiratoria, conservar las vías respiratorias libres de obstrucciones, tubo orotraqueal en adecuada posición, con servar los parámetros ventilatorios y asistirlo durante la radiografía de tórax.
• Evitar hemorragias en los si guientes procedimientos: introducción de sondas, inyecciones, punciones venosas y punción del talón, no practicar cambios de sondas, utilizar la técnica de aspiración “premedida” de sonda endotraqueal. Che quear sangre en orina, heces y del material que sale de las sondas endotraqueal o nasogástrica.
• Aplicación estricta de técnicas de asepsia y antisepsia.
• Brindar asistencia física: conservar la piel seca, limpia y sin puntos de presión, realizar los cuidados y el aseo de la boca, cambios de posición cada una o dos horas.
• Realizar medidas contra el estrés, el dolor y mantener la sedación: llevar al mínimo el nivel del ruido ambiental, administrar analgésicos comofentanyl o morfina en forma de goteo intravenoso continuo, corregir la dependencia física iatrogénica causada por disminución de dosis.
• Estar alerta en la aparición de complicaciones y situaciones de urgencia: embolia de aire, rotura de tubos, función defectuosa del oxigenador, descanulación accidental, falla en la fuente de gases, falla de corriente eléctrica.
Apoyo a los Padres
Es de vital importancia mantener una relación estrecha entre los padres y el equipo humano ECMO con el fin de disminuir el nivel de estrés que pueda generar el tiempo de permanencia del paciente en este soporte vital.
La enfermera identifica las necesidades del paciente y su familia y de acuerdo con cada situación particular establece el plan por seguir e involucra otras disciplinas necesarias para dar apoyo emocional a los padres del niño afectado.
Los padres del candidato para recibir ECMO están en crisis. Ellos deben estar conscientes de que la ECMO es un “último recurso” sin garantía de re sultado positivo y que la tecnología utilizada es abrumadora. Esta situación re quiere manejo e intervención en crisis, con asesoría del grupo de apoyo emocional.
Se debe mantener información concisa y exacta del estado de su hijo y los métodos necesarios para su tratamiento.
Deben concientizarse de que los candidatos para recibir ECMO deben tener un pronóstico cada vez más positivo y se hará todo para instar a los padres que participen e interactúen con el lactante.
Referencias Bibliográficas
1. Gibbon JH Jr. Application of a mechanical heart and drug apparatus in cardiac surgery . Minn Med 1954; 37:171.
2. Bartlett RH, Gazzaniga AB, Jefferies MR. Extracorporeal membrane oxygenation (ECMO) cardiopulmonary support in infancy trans am sol artif intern organs 1976; 22:8093.
3. Bartlett RH, Roloff DW, Cornell RG, et al: Extracorporeal circulation in neonatal respiratory failure; a prospective randomized study. Pediatrics. 1985;76:479-487.
4. Bailey PV, Connors RH, Tracy TF, et al. A critical analysis of extacorporeal membrane oxigenation for cogenital diaphragmatic hernia. Surgery 1989;106:611-15.
5. Heaton JF, Redmond CR, Graves ED, et al. Congenital diphragmatic hernia: Improving survival with extracorporeal mem bra ne oxygenation. Pediatr Surg Int 1988;3:6-10.
6. Pedersen TH, Videm V. Svenneving JL, et al. Extracorporeal membrane oxigenatyon using a centrifugal pump and a servo regu lator to prevent negative inlet presure. Ann Thorac Surg 1997;63:1333-39.
7. Kossel H, Bauer K, Kewitz G, et al. Do we need new indications for ECMO in neo nates pretreated with high frecuency ventilation and /or inhaled nitric oxide?. IntensiveCare Med 2000;26: 1489-95.
