Para predecir la tasa de recurrencia y la indicación de la Quimioterapia
GUILLERMO RAMÍREZ, MD, FACP1
Palabras clave: neoplasias de la mama; pruebas genéticas; quimioterapia adyuvante; receptores estrogénicos; pronóstico.
Resumen
El carcinoma mamario es el cáncer más frecuente en mujeres en todo el mundo. En Colombia es la neoplasia maligna más frecuente en las mujeres.
Aun cuando su incidencia ha aumentado en las últimas décadas, su mortalidad se ha reducido algo o ha permanecido estable. A pesar de los progresos obtenidos en el manejo quirúrgico que permiten obtener resultados similares con intervenciones menos mutiladoras, de las nuevas técnicas de radioterapia que producen menos efectos secundarios y de los avances en los tratamientos con quimioterapia, aún no tenemos la habilidad de predecir qué pacientes van a tener recurrencias y quiénes se beneficiarán de la terapia adyuvante.
En el pasado nos hemos confiado en paradigmas establecidos, tales como el tamaño y el grado tumoral, la edad de las pacientes, la presencia de receptores hormonales y el compromiso por el tumor de los ganglios linfáticos. Sin embargo, el descubrimiento de diferentes subtipos de cáncer mamario nos demuestra que el cáncer mamario no es una entidad única y, por lo tanto, la terapia debe ser individualizada, pues es posible que en algunos casos el tratamiento usado no sea el mejor y en otros, tal vez, sea innecesario.
En este artículo se presentan varias de las pruebas genéticas disponibles, las que predicen las posibilidades de recurrencia del tumor y determinan cuáles pacientes se pueden beneficiar con la quimioterapia y cuáles no se benefician.
El carcinoma mamario es el cáncer más frecuente en mujeres, con un estimado de 1’380.000 nuevos casos en 2008, y es el cáncer más común, tanto en los países desarrollados como en aquellos en vías de desarrollo. Su incidencia varía de 19,3 por 100.000 mujeres en África oriental a 89,9 por 100.000 mujeres en Europa occidental, y la incidencia más alta se encuentra en los países desarrollados, excepto Japón (1,2). La incidencia mundial del carcinoma mamario ha aumentado en las últimas cuatro décadas, pero la mortalidad ha permanecido estable o disminuido ligeramente, tal vez porque los métodos de detección más efectivos permiten un diagnóstico más temprano, con mayores posibilidades de curación, y existen hoy tratamientos más efectivos para el manejo de la enfermedad metastásica
Según el Instituto Nacional de Cancerología, en Colombia se diagnostican alrededor de 7.000 nuevos casos por año, lo que la hace la neoplasia más frecuente en mujeres, por encima de la de cuello uterino. En un análisis de las tendencias de incidencia y mortalidad en el país, comparadas con las de Bogotá, entre los años 1980 y 2000, se observó un aumento de 40% en la mortalidad del cáncer de seno en el país y un descenso de 25% en Bogotá. Los autores consideraron que la disminución del riesgo en Bogotá podía estar asociada a cambios generacionales en los factores protectores en la infancia y el aumento del riesgo en el resto del país se puede explicar por una mayor urbanización y la disminución de la fecundidad en las últimas décadas (3).
El cáncer de seno es una enfermedad que aumenta de manera directa con la edad de las pacientes. Como la expectativa de vida de la población se ha incrementado de manera notable en las últimas décadas, cada día es mayor el volumen de población que envejece y, por ende, el número de casos de cáncer (4).
Es evidente que durante las últimas tres décadas han ocurrido avances significativos en la comprensión de los mecanismos implicados en el desarrollo y la evolución del cáncer mamario, lo que ha hecho posible desarrollar nuevos tratamientos quirúrgicos, farmacológicos y de radioterapia.
La cirugía ha evolucionado de la cirugía radical ejecutada en el siglo XVI, a la cirugía radical extendida propuesta por Urban (5,6) y Cáceres (7). Pero la técnica de la cirugía radical para cáncer mamario, practicada durante la mayor parte del siglo XX, está asociada al nombre de William S. Halsted, pues su mayor contribución fue la unificación de los conceptos de la anatomía y la patología, que combinados con una meticulosa técnica operatoria plantearon una rigurosa estandarización de la cirugía, convirtiendo la mastectomía radical en el paradigma de la cirugía oncológica (8).
En un estudio del National Surgical Adjuvant Breast Project (NASBP) (9,10), se comprobó que las cirugías menos agresivas, estéticamente más aceptables y menos mutiladoras, propuestas por Crile (11), Fisher (12) y Veronesi (13,14), eran tan eficaces como la cirugía radical.
Las cirugías más conservadoras ahora posibles, con resecciones segmentarias y nuevas técnicas de reconstrucción, permiten obtener buenos resultados estéticos, pero, al decir del doctor Patiño: “El nuevo panorama, que significa un enfoque más humano y racional, más de acuerdo con los nuevos conocimientos y las nuevas tecnologías, exige una más rigurosa acción profesional y una más cuidadosa selección de las pacientes” (15).
La radioterapia también ha evolucionado, empleando varias técnicas y dando como resultado la misma o una mayor efectividad, sin los efectos colaterales de las técnicas iniciales (16,17).
La quimioterapia, de igual forma, también ha sufrido cambios sustanciales, desde la monoterapia (18) y luego las combinaciones de medicamentos (19), hasta las terapias con anticuerpos monoclonales (20) o aquellas dirigidas a receptores específicos (21). Todos estos avances se han visto reflejados en una prolongación de la supervivencia y una mejor calidad de vida para las pacientes.
La terapia adyuvante también ha tenido cambios favorables desde cuando el reporte de Bonadona et al. en 1976 demostró que la combinación de ciclofosfamida, metotrexato y 5-fluorouracilo disminuía el riesgo de recurrencia en mujeres con ganglios positivos (22). Los estudios posteriores del NASBP y del Early Breast Cancer Trialists’ Collaborative Group reportaron que las combinaciones de citotóxicos que contenían antraciclinas eran más efectivas que la combinación de ciclofosfamida, metotrexato y 5-fluorouracilo (23,24).
No obstante, los trabajos posteriores no han resuelto las preguntas sobre cuál es la combinación óptima de medicamentos, ni por cuánto tiempo se deben administrar. Aun cuando la terapia adyuvante ha mejorado ostensiblemente el período libre de enfermedad y la supervivencia total, todavía no se puede predecir si una paciente va a recaer o se va a beneficiar de la terapia adyuvante y, tal vez, una gran mayoría de las pacientes reciben terapia innecesaria.
La necesidad de seleccionar mejor las pacientes para terapia adyuvante es reconocida desde hace mucho tiempo (25,26). Hasta recientemente, los únicos factores de pronóstico validados en cáncer mamario habían sido el compromiso de los ganglios linfáticos, el tamaño del tumor, la edad, el índice de proliferación, los receptores hormonales y la expresión del HER-2/neu (Human Epidermal Growth Factor Receptor-2). Estos marcadores pueden usarse para estimar el riesgo de recurrencia (27); además de los factores mencionados, se añaden la aneuploidía y una alta fase-S de división celular, que están generalmente asociadas con receptores negativos. Los tumores diploides presentan una recurrencia de 12% a cinco años, en tanto que en los aneuploides ésta es de 26%. También confieren peor pronóstico los niveles elevados de catepsina-D (28). Estos marcadores pueden usarse para estimar el riesgo de recurrencia, pero los factores predictores son útiles para predecir el beneficio del tratamiento e incluyen: estado de receptores de estrógenos y progestágenos, HER-2/ neu y Oncotype DX (29,30).
Existe un programa computadorizado llamado Adjuvant! Online que, con información sobre los pacientes (edad, menopausia, estimados de enfermedades concomitantes), el estadio del tumor y sus características (tamaño, número de ganglios positivos, receptores de estrógenos), permite hacer estimados pronósticos de la eficacia de terapia endocrina (tamoxifeno por 5 años) y de la poliquimioterapia (CMF, AC, ACT) y, también, estimados que pueden usarse en forma numérica y gráfica. No obstante, al decir de su creador Peter Ravdin, los resultados para supervivencia global y supervivencia libre de enfermedad se pueden moldear con el programa Adjuvant!, pero una validación para los diferentes subtipos de pacientes no es posible. El programa es útil para predecir resultados, excepto en mujeres jóvenes, pero no tiene en cuenta la complejidad biológica de un tumor en particular (31).
En el pasado se han usado los parámetros dictados por la edad, el tamaño del tumor, el número de ganglios comprometidos por tumor, etc., como una manera de determinar la terapia, y así se han tratado las pacientes con carcinoma mamario como si fuesen una población homogénea, sin saberse si el tratamiento es demasiado, insuficiente o inadecuado.
En la era de la biología molecular, los diferentes análisis genéticos han permitido diferenciar algunos subtipos de cáncer mamario y, de esta manera, identificar las pacientes cuyos tumores van a responder a la quimioterapia adyuvante o no lo van a hacer.
Existen varios perfiles de expresión genética que pueden alterar el manejo clínico al poder identificar ciertos subtipos de cáncer mamario y, de esta manera, individualizar el manejo para cada paciente, indicando las terapias que sean más efectivas y sin incluir aquellas para quienes la quimioterapia puede tener un efecto mínimo. Uno de los primeros trabajos más importantes fue el de Perou et al., quienes, por un método denominado subtipo intrínseco y usando un método de microarreglos para detectar el ADN y el ARNm, lograron subclasificar los tumores mamarios en: luminal A, luminal B, expresan HER-2, basaloides y normales.
La experiencia clínica nos ha demostrado que los tumores luminal A tienen un pronóstico más favorable que los que expresan HER-2 o los basaloides (32,33).
En el trabajo de Soitirou et al. sobre el grado del índice de expresión genética, se demostró que el cáncer mamario no es una enfermedad con características morfológicas y biomarcadores variables, sino más bien un grupo de alteraciones neoplásicas molecularmente distintas. Los perfiles de expresión genética apoyan la hipótesis de que los cánceres de mama con receptores de estrógenos positivos o negativos se originan en distintos tipos celulares (34).
En el estudio de 76 genes, conocido como la rúbrica de Rotterdam, se clasifican los pacientes como de alto o bajo riesgo de desarrollar enfermedad metastásica (35). Según el estudio de Chang et al., la expresión de los genes MYC y CSN5 es suficiente para activar la rúbrica de cierre de las heridas e induce cambios asociados con células tumorales invasoras (36). Otro estudio interesante es el de Ma et al., en el que analizan la expresión de dos genes: el gen homeobox B13 (HOXB13) y el gen receptor de interleucina (IL17BR). El HOXB13 se expresa en células mamarias cancerosas y es regulado negativamente por los estrógenos. El IL17BR se pierde en presencia de células cancerosas y es regulado positivamente por el estrógeno (37).
Existen otra gran cantidad de pruebas genéticas para predecir resultados en el cáncer mamario, pero están en procesos de investigación o de comercialización. Algunas de ellas son:
• Breast Bioclassifier: incluye 50 genes y 5 de control.
• eXagen: usa técnica FISH.
• Mammotrast: usa cinco anticuerpos monoclonales biomarcadores.
• Theros Breast Cancer Index: es un índice de dos genes.
• Breast Cancer Gene Expression: Prognosis Profile (Tutt et al.): es una rúbrica de 14 genes en pacientes positivos para G-ER.
Cabe mencionar dos pruebas que sobresalen por su utilidad en la práctica clínica: Mammaprint® y Oncotype DX®.
Mammaprint® es un ensayo de microarreglo del ADN que emplea 70 genes. El grupo holandés de van de Veer et al. usó otro enfoque supervisado de multitud de patrones de expresión genética, usando datos clínicos para construir un modelo pronóstico de los resultados y así identificar ciertas rúbricas genéticas asociadas con tal o cual pronóstico (bueno o malo). Comenzando con ~5.000 genes, usó un método de clasificación de tres pasos, para seleccionar 221 genes asociados con metástasis a distancia. Usando un método de validación, se creó un perfil óptimo de expresión de 70 genes que puede identificar de una manera más confiable los tumores de pronóstico bueno o malo.
Para substanciar la clasificación basada en esta rúbrica de 70 genes, analizaron 295 pacientes menores de 53 años: 180 tuvieron un “pronóstico pobre” con una supervivencia a 10 años de 54,6%, y 115 tuvieron un “pronóstico bueno” y una supervivencia de 94%.
Si bien es cierto que en los estudios iniciales de 78 pacientes, menores de 55 años y con ganglios negativos, se hicieron en muestras de tejido fresco congelado, en la actualidad se emplea tejido fresco, que no ha sido fijado en formalina para preservar la estructura del ARN. Con un sacabocado, se toma una muestra y se deposita en un tubo con un diluente especial, ambos incluidos en el kit, el cual es enviado a Holanda para su análisis (38).
Oncotype DX® es una prueba de 21 genes que determina el riesgo de recurrencia a diez años, en pacientes con tumores positivos para ER, desarrollada por Genomic Health Inc. Como no todas las mujeres se benefician de la quimioterapia, el Oncotype DX® es una prueba que ofrece una predicción individualizada del beneficio de la quimioterapia y las recidivas a 10 años, para tomar una decisión sobre la terapia adyuvante en ciertas casos de cáncer mamario. Para el análisis se emplea el bloque de parafina que usan los patólogos y de allí se hacen laminillas para su análisis. Oncotype DX® usa un proceso de transcriptasa-inversa y reacción de la polimerasa en cadena (PCR) para cuantificar la expresión de un ARNm específico para 16 genes de cáncer y 5 genes de referencia en muestras de parafina, obtenidas de una biopsia de cáncer mamario, combinando los resultados de la expresión en un solo resultado llamado puntaje de recurrencia (recurrence score, RS) (39).
En la figura 1 se enumeran los genes empleados en el análisis. Los genes de proliferación, los hormonales y los de invasión; los genes GSTM1, BAG1 y CD68 son posiblemente genes de proliferación. También, se analizan cinco genes de referencia, para verificar que no existe contaminación del espécimen. Según el grado de expresión de los distintos genes, a cada uno se le da un valor matemático y la suma de los diferentes valores determina el puntaje de recurrencia (RS). Si la cifra está por debajo de 18, se considera de bajo riesgo, de 18 a 30 es de riesgo intermedio, y por encima de 31, de riesgo alto.

¿Tiene indicaciones el Oncotype DX® para su uso en la práctica clínica y se ha demostrado su validez en algunos estudios clínicos? La respuesta es afirmativa para ambas preguntas. Una vez que se han enviado los bloques de parafina o las laminillas para su análisis, el resultado llega al médico tratante y al patólogo en un plazo no mayor de 10 a 12 días, y los resultados se pueden ver en Internet en unos 8 a 10 días.
El reporte incluye:
– El puntaje de recurrencia,
– El promedio de recurrencia a 10 años, para ese dato,
– El gráfico del riesgo de recurrencia a 10 años, como una función del dato de recurrencia,
– Los valores cuantitativos de los receptores de estrógenos,
– Los valores cuantitativos de los receptores de progesterona y
– La expresión del HER-2, por el método FISH.
– Los datos cuantitativos adicionales sobre los receptores hormonales y el HER-2 son utilizados por algunos patólogos como pruebas de control para sus propios laboratorios.
La prueba ha sido validada por NSABP (40) en sus estudios B-14 y B-20, cuyo objetivo era validar prospectivamente el puntaje de recurrencia como factor de predicción de recidiva a distancia y recidiva local y regional en pacientes positivos para ER y ganglios negativos. Esta información tiene consecuencias biológicas y posibles implicaciones clínicas relativas a las decisiones sobre la terapia local y regional en pacientes con tumores ER positivos y ganglios negativos. Fueron estudios multicéntricos con un ensayo preespecificado de 21 genes, algoritmo, puntos finales y plan de análisis.
Los resultados llevaron a las siguientes conclusiones:
• El puntaje de recurrencia se confirmó como factor predictor de recidiva en las pacientes con ganglios negativos y ER positivos, tratadas con tamoxifeno.
• El desempeño del puntaje de recurrencia supera las medidas estándar (edad, tamaño, grado).
• El 50% de los pacientes son reclasificados por el puntaje de recurrencia cuando se compara con el criterio de National Comprehensive Cancer Network (NCCN).
• El puntaje de recurrencia cuantifica más exactamente el riesgo de recurrencia a distancia que las guías del NCCN (basadas en edad, tamaño y grado del tumor).
• Mostró los beneficios de la quimioterapia para las pacientes con puntaje de recurrencia alto.
• El puntaje de recurrencia puede añadir discriminación sobre el pronóstico que no siempre la ofrecen los factores pronóstico tradicionales.
Edad: el 44% de las pacientes menores de 40 años tienen un puntaje de recurrencia bajo. Es decir, en un número grande de pacientes jóvenes la quimioterapia tiene un beneficio mínimo.
Tamaño del tumor: el 46% de las pacientes con tumores grandes (más de 4 cm) tienen un puntaje de recurrencia bajo. Algunas pacientes con tumores pequeños (menos de 1 cm) tienen un puntaje de recurrencia intermedio o alto.
Grado del tumor: según la evaluación por patólogos locales, aun con tumores mal diferenciados, el 36% de las pacientes tienen un puntaje de recurrencia bajo. Aproximadamente, 20% de tumores pobremente diferenciados aún tienen un puntaje de recurrencia bajo.
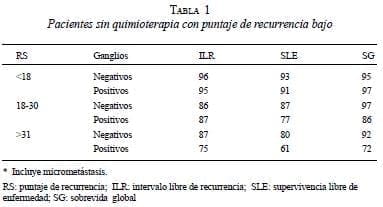
¿Qué ocurre en pacientes con 1 a 3 ganglios positivos? La validación por el Eastern Cooperative Oncology Group (ECOG) en su estudio 2197, encontró que a las pacientes con 1 a 3 ganglios positivos y puntaje de recurrencia bajo, les va bien sin quimioterapia (figura 2 y tabla 1) (41).
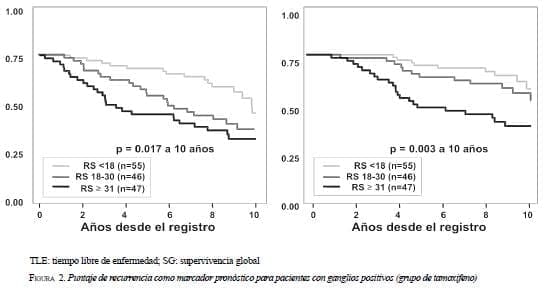
Otro estudio que validó la utilidad del Oncotype DX® en pacientes con ganglios positivos fue el del South West Oncology Group (SWOG) 8814. En este análisis se incluyeron 357 pacientes posmenopáusicas, positivas para ER y con ganglios positivos: 148 se trataron con sólo tamoxifeno y 219 recibieron tamoxifeno más CAF. El 40% de las pacientes fueron clasificadas de bajo riesgo, el 28% como de riesgo intermedio y el 32% como de alto riesgo.
En las mujeres tratadas sólo con tamoxifeno, el tiempo libre de enfermedad y la supervivencia global fueron peores. Este efecto fue independiente del número de ganglios comprometidos. Entre aquellas con un puntaje de recurrencia bajo, ni el tiempo libre de enfermedad ni la supervivencia global mejoraron con la adición de quimioterapia. El tiempo libre de enfermedad a 10 años fue de 60% en las pacientes tratadas sólo con tamoxifeno y de 64%, en las tratadas con tamoxifeno más quimioterapia.
Entre las pacientes con un puntaje intermedio, el tiempo libre de enfermedad y la supervivencia global mejoraron con la adición de quimioterapia. El tiempo libre de enfermedad a 10 años fue de 49% para el grupo con sólo tamoxifeno y de 63%, para el grupo que recibió tamoxifeno más quimioterapia. En el grupo de puntaje alto, el tiempo libre de enfermedad y la supervivencia global mejoraron significativamente con la adición de quimioterapia. El tiempo libre de enfermedad a 10 años fue de 43% para el grupo tratado con sólo tamoxifeno y de 55%, para el que recibió tamoxifeno más quimioterapia (42).
¿En la práctica esto qué significa? Que las pacientes de bajo riesgo se beneficiarán muy poco con la quimioterapia y, por el contrario, las de riesgo alto son candidatas para recibir quimioterapia porque la posibilidad de recurrencia a 10 años también es muy alta. Para las pacientes de riesgo intermedio, la decisión depende del criterio del médico tratante y allí juegan un papel muy importante los factores tradicionales que antes considerábamos como un paradigma. Unos ejemplos nos darán una idea de la utilidad de Oncotype DX.
Algunos estudios han demostrado que los resultados del Oncotype DX han ayudado a modificar los planes terapéuticos en 30% a 40% de los casos (43,44).
Una vez más, es evidente que el enfoque interdisciplinario en el manejo del cáncer mamario es imperativo. Desde el momento en que el ginecólogo, el cirujano, el internista o el oncólogo sospechan la presencia de cáncer, es preciso aunar los esfuerzos de los diferentes especialistas para brindar a las pacientes los objetivos que se persiguen de producir el mayor número de curas, prolongar la supervivencia al máximo, aliviar los síntomas y mejorar la calidad de vida de las pacientes (45).
Las pruebas genéticas son una ayuda importante para ofrecer una terapia más individualizada a cada paciente, pero todavía existen interrogantes por resolver, tales como las limitaciones por la tecnología necesaria, porque se requiere de unas instalaciones muy sofisticadas para realizar las pruebas, que no están disponibles en todo laboratorio de patología.
Además, debemos familiarizarnos con el reporte e interpretación de los resultados, pues es decisión del médico tratante el ofrecer el manejo óptimo a sus pacientes y, también, hay que considerar la posible aplicación a poblaciones más heterogéneas de carcinoma mamario, a medida que éstas se descubran.
Conflictos de interés: Asesor científico de Amarey Nova Medical, S. A.
Genetic Predictors in Mammary Cancer. Importance of the 21 Gene Test in the Prediction of Recurence Rates and Indication for Chemotherapy
Abstract
Breast cancer is the most frequent cancer in women around the world. In Colombia it is the most common malignancy in women. Although its incidence has increased in the last decades, the mortality has decrease somewhat or remained stable. Despite the progress observed in the surgical management, where the same results were obtained with less surgical mutilating procedures, in the treatment with radiotherapy with less adverse side effects and the advances with chemotherapy, we still lack the ability to predict which patients will recur and which patients will benefit from adjuvant treatments. In the past, we have relied on established paradigms as the size and grade of the tumors, the patient’s age, the presence of hormone receptors and the involvement of the lymph nodes. However, the discovery of different subtypes of breast tumors has shown that breast carcinoma is not a sole entity and that therapy should be individualized, because in some cases we may be under treating while in others we may be treating patients unnecessarily. We present many of the available genetic tests which predict the percentage of recurrence and tell us which patients may or may not benefit from chemotherapy.
Key words: breast neoplasms; genetic testing; chemotherapy, adjuvant; receptors, estrogen; prognosis.
Referencias
1. WHO, International Agency for Research on Cancer. Cancer incidence and mortality in cancer. Globocan 2008. Disponible en https://globocan.iarc.fr/ Fecha de descarga octubre de 2010.
2. Autier P, Boniol M, LaVecchia C, Vatten L, Gavin A, Héry C, et al. Disparities in breast cancer mortality trends between 30 European countries: Retrospective trend analysis of WHO mortality database. Br Med J. 2010;341:c3620.
3. Hernández G, Herrán S, Cantor LF. Análisis de las tendencias de mortalidad por cáncer de mama en Colombia y Bogotá, 1981- 2000. Revista Colombiana de Cancerología. 2007;11:32-9.
4. Ferlay J, Parkin DM, Steliarova-Foucher E. Estimates of cáncer incidence and mortality in Europe in 2008. Eur J Cancer. 2010;46:765-81.
5. Urban JA, Baker HW. Radical mastectomy with in bloc resection of the internal mammary lymph node chain. Cancer. 1952;5:992.
6. Urban JA. Clinical experience and results of excision of internal mammary lymph node chain in primary operable breast cancer. Cancer. 1959;12:14.
7. Cáceres E. Radical mastectomy with resection of internal mammary chain. Acta Union Intern Contre Cancrum. 1958;15:106.
8. Patiño JF. Historia de la mastectomía y estado actual del tratamiento del cáncer mamario. En: Patiño JF. Lecciones de cirugía. Bogotá: Editorial Médica Panamericana; 2001.
9. Fisher B, Bauer M, Margolese R, Poisson R, Pilch YL, Redmond C, et al. Five-year results of a randomized clinical trial comparing total mastectomy and segmental mastectomy with or without radiation in the treatment of breast cancer. N Engl J Med. 1985;312:665-73.
10. Fisher B, Redmond C, Fisher ER, Bauer M, Wolmark N, Wickerham L, et al. Ten-year results of a randomized clinical trial comparing radical mastectomy and total mastectomy with or without radiation. N Engl J Med. 1985;312:674-81.
11. Crile G Jr. Rationale of simple mastectomy without radiation for stage I cancer of the breast. Surg Gynecol Obstet. 1965;120:975.o o1 he changing role o
12. Fisher B. The changing role of surgery in the treatment of cancer. In: Becker FF, editor. Cancer: A comprehensive treatise. New York: Plenum Publishing Comp.; 1977;401-21.
13. Veronesi U, Saccozzi R, Del Vecchio M, Banfi A, Clemente C, De Lena M, et al. Comparing radical mastectomy with quadrantectomy, axillary dissection, and radiotherapy in patients with small cancers of the breast. N Engl J Med. 1981;305:6-11.
14. Veronesi U, Cascinelli N, Mariani L, Greco M, Saccozzi R, Luini A, et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med. 2002;347:1227-332.
15. Patiño JF. Una visión actual sobre cirugía conservadora en cáncer mamario. Revista Colombiana de Cirugía. 1989;4:57-62.
16.The START Trialists’ Group. The UK Standardization of Breast Radiotherapy (START) Trial A of radiotherapy hypofractionation for treatment of early breast cancer: A randomized trial. Lancet Oncol. 2008;9:331-41.
17. Whelan TJ, Pignol JP, Levine MN, Julian JA, MacKenzie R, Parpiaet S, et al. Long-term results of hypofractionated radiation therapy for breast cancer. N Engl J Med. 2010;362:513-20.
18. Mackman S. Ramírez G, Ansfield FJ. Results of 5-fluorouracil (NSC-19893) given by the multiple daily dose method in disseminated breast cancer. Cancer Chemother Rep. 1967;51:483.
19. Canellos GP, Pocock SJ, Taylor S, Sears ME, Klaasen DJ, Band PR, et al. Combination chemotherapy for metastatic breast carcinoma. Prospective comparison of multiple drug therapy with L-phenylalanine mustard. Cancer. 1976;38:1882-6.
20. Hortobagyi GN. Trastuzumab in the treatment of breast cancer. N Engl J Med. 2005;353:1734-6.
21. Moreira C, Kaklamani V. Lapatinib and breast cancer: Current indications and outlook for the future. Expert Rev Anticancer Ther. 2010;10:1171-82.
22. Bonadonna G, Brusamolino E, Valagussa P, Rossi A, Brugnatelli L, Brambilla C, et al. Combination chemotherapy as an adjuvant treatment in operable breast cancer. N Engl J Med. 1976;294:405-10.
23. Fisher B, Brown AM, Dimitrov NV, Poisson R, Redmond C, Margolese RG, et al. Two months of doxorubicincyclophosphamide with and without interval reinduction therapy compared with 6 months of cyclophosphamide, methotrexate, and fluorouracil in positive-node breast cancer patients with tamoxifen-nonresponsive tumors: Results from the National Surgical Adjuvant Breast and Bowel Project B-15. J Clin Oncol. 1990;8:1483-96.
24. Early Breast Cancer Trialists’ Collaborative Group. The effects of adjuvant tamoxifen and of cytotoxic therapy on mortality in early breast cancer: An overview of 61 randomized trials among 28,859 women. N Engl J Med. 1988;319:1681-92.
25. Adjuvant therapy for breast cancer. NIH Consensus Development Conference, November 1-3, 2000, Program and Abstracts, Office of the Director, National Institutes of Health.
26. Goldhirsch A, Glick JH, Gelber RD, Coates AS, Senn HJ. Meeting highlights: International Consensus Panel on the treatment of primary breast cancer. J Clin Oncol. 2001;19:3817-27.
27. Cianfrocca M, Goldstein LJ. Prognostic and predictive factors in early-stage breast cancer. Oncologist. 2004;9:606-16.
28. Abaúnza H. Cáncer mamario. Factores pronósticos. Revista Colombiana de Cirugía. 1993;8:24-9.
29. Paik S, Tang G, Shak S, Kim C Baker J, Kim W, et al. Gene expression and benefit of chemo therapy in women with nodenegative, estrogen receptor-positive breast cancer. J Clin Oncol. 2006;24:3726-34.
30. Lønning PE. Breast cancer prognostication and prediction: Are we making progress? Ann Oncol. 2007;18(Suppl.8):3-7.
31. Ravdin PM, Siminoff LA, Davis GJ, Mercer MB, Hewlett J, Gerson N et al. Computer program to assist in making decisions about adjuvant therapy for women with early breast cancer. J Clin Oncol. 2001;19:980-91.
32. Perou CM, Sørlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, et al. Molecular portraits of human breast tumours. Nature. 2000;406:747-52.
33. Clinical implementation of the intrinsic subtypes of breast cancer. Lancet Oncol. 2010;11:718-9.
34. Sotiriou C, Wirapati P, Loi S, Harris A, Fox S, Smeds J, et al. Gene expression profiling in breast cancer: Understanding the molecular basis of histologic grade to improve prognosis. J Natl Cancer Inst. 2006;98:262-72.
35. Desmedt C, Piette F, Loi S, Wang Y, Lallemand F, Haibe-Kains B, et al. TRANSBIG Consortium. Strong time dependence of the 76-gene prognostic signature for node-negative breast cancer patients in the TRANSBIG multicenter independent validation series. Clin Cancer Res. 2007;13:3207-14.
36. Chang HY, Sneddon JB, Alizadeh A, Sood R, West RB, Montgomery K, et al. Gene expression signature of fibroblast serum response predicts human cancer progression: Similarities between tumors and wounds. Biology. 2004;2:206-14.
37. Ma XJ, Wang Z, Ryan PD, Isakoff SJ, Barmettler A, Fuller A, et al. A two-gene expression ratio predicts clinical outcome in breast cancer patients treated with tamoxifen. Cancer Cell. 2004;5:607- 16.
38. van de Vijver MJ, He YD, van de Veer LJ, Dai H, Hart AA, Voskuil DW, et al. Gene expression profiling predicts clinical outcome of breast cancer. Nature. 2002;415:530-6.
39. Paik S, Shak S, Tang G, Chungyeul K, Baker J, Cronin M, et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. N Engl J Med. 2004;351:2817-26.
40. Mamounas E, Tang G, Bryant J. Association between the 21- gene recurrence score assay (RS) and risk of locoregional failure in node-negative, ER-positive breast cancer: Results from NSABP B-14 and NSABP B-20. Proceedings from the 28th annual San Antonio Breast Cancer Symposium. San Antonio, Texas. December 8-11, 2005. Abstract # 29.
41. Badve SS, Baehner FL, Gray RP, Childs BH, Maddala T, Liu M-L, et al. Estrogen- and progesterone-receptor status in ECOG 2197: Comparison of immunohistochemistry by local and central laboratories and quantitative reverse transcription polymerase chain reaction by central laboratory . J Clin Oncol. 2008;26:2473-81.
42. Albain KS, Barlow WE, Shak S, Hortobagyi GN, Livingston RB, Yeh IT; Breast Cancer Intergroup of North America. Prognostic and predictive value of the 21-gene recurrence score assay in postmenopausal women with node-positive, oestrogenreceptor- positive breast cancer on chemotherapy: A retrospective analysis of a randomized trial. Lancet Oncol. 2010;11:55-65.
43. Asad J, Jacobson AF, Estabrook A, Smith SR, Boolbol SK, Feldman SM, et al. The American Society of Breast Surgeons. Does oncotype DX recurrence score affect the management of patients with early-stage breast cancer? Am J Surg. 2008;196:527-9.
44. Lo SS, Mumby PB, Norton J, Rychlik K, Smerage J, KashJ, et al. Prospective multicenter study of the impact of the 21-gene recurrence score assay on medical oncologist and patient adjuvant breast cancer treatment selection. J Clin Oncol. 2010;28:1671-6.
45. Pruthi S, Brandt KR, Degnim AC, Goetz MP, Goetz MP, Pérez EA, et al. A multidisciplinary approach to the management of breast cancer. Part 1: Prevention and diagnosis. Mayo Clin Proc. 2007;82:999-1012.
Correspondencia:
GUILLERMO RAMÍREZ, MD
Correo electrónico: gramirezpinto@gmail.com
Bogotá, Colombia
1 Profesor emérito de Medicina, Universidad de Wisconsin, Estados Unidos; director científico, Centro de Investigaciones Oncológicas, CIOSAD, Bogotá.
