Esofagectomía transtorácica con ascenso gástrico laparoscópico, cómo lo hacemos
Palabras clave:
Esófago; neoplasias esofágicas; esofagectomía; toracotomía; laparoscopía.
Resumen
La esofagectomía es el manejo de elección en pacientes con enfermedades como el cáncer esofágico, entre otras. Existen diferentes abordajes y opciones, las cuales se han ampliado con la cirugía asistida con video que permite estancias hospitalarias cortas, menores tasas de infección, menos dolor y un pronto regreso a las actividades diarias.
En este artículo se describe el abordaje de una esofagectomía híbrida transtorácica, con ascenso gástrico laparoscópico y anastomosis intratorácica latero-lateral mecánica, que mezcla las ventajas de la laparoscopia con un abordaje abierto transtorácico.
Introducción
La esofagectomía es el tratamiento de referencia en pacientes con condiciones como cáncer esofágico potencialmente resecable, quemaduras esofágicas, acalasia terminal o perforaciones esofágicas, entre otras. Existen diferentes abordajes y opciones, las cuales se han ampliado con la cirugía asistida con video que permite estancias hospitalarias cortas, menores tasas de infección, menos dolor y un pronto regreso a las actividades diarias 1-3.
El abordaje laparoscópico cumple los mismos principios y objetivos del abordaje abierto, con reducción del trauma quirúrgico, y baja tasa de eventraciones e infecciones posoperatorias. Esto contrasta con las ventajas del abordaje abierto transtorácico que proporciona una amplia exposición, la reducción de lesiones (nervio laríngeo recurrente) y comodidad para practicar la anastomosis 4-5.
El objetivo de este artículo es describir paso a paso una esofagectomía híbrida transtorácica, con ascenso gástrico laparoscópico y anastomosis intratorácica latero-lateral.
Periodo prequirúrgico – Esofagectomía Híbrida
Valoración y manejo preanestésico y anestésico.
La valoración prequirúrgica anestésica, al igual que para cualquier procedimiento, es de suma importancia; se debe evaluar la necesidad de cuidados intensivos posoperatorios y de derivados sanguíneos, adelantándose a la pérdida potencial de sangre.
El manejo del dolor posoperatorio debe ser una prioridad, por lo que hay que implantar para este fin un catéter torácico epidural antes del procedimiento. La monitorización de la presión arterial, del estado metabólico ácido-básico y el respiratorio debe ser continua mediante un catéter arterial para la toma de gases arteriales.
Después de la inducción de la anestesia general con un tubo de doble luz que permite el adecuado colapso pulmonar con una buena visualización durante el tiempo torácico, no se debe olvidar colocar una sonda nasogástrica conectada a drenaje libre, lo cual permite su fácil manipulación. En algunas ocasiones esto no es posible, por lo que no se debe forzar su paso.
Posición del paciente
Tiempo quirúrgico abdominal.
En el primer tiempo quirúrgico, el abdominal, el paciente se ubica en posición de litotomía con las piernas en estribos, formando un ángulo de 20 a 30º con las rodillas. El cirujano se ubica justo frente al monitor, el cual se localiza en la cabecera del paciente. El primero y el segundo asistente estarán al lado derecho e izquierdo del paciente (figura 1).
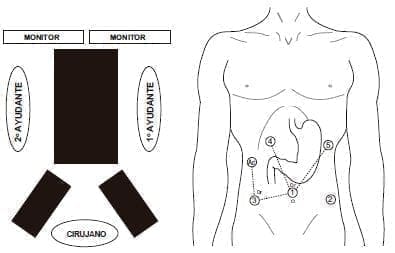 Figura 1. Tiempo quirúrgico abdominal: posición del paciente y de los trocares
Figura 1. Tiempo quirúrgico abdominal: posición del paciente y de los trocares
Tiempo quirúrgico torácico. En el segundo tiempo quirúrgico, el torácico, el paciente se coloca en decúbito lateral izquierdo, con un rollo axilar para extender los espacios intercostales y optimizar la visibilidad durante el abordaje; el brazo derecho debe estar extendido y suspendido, para evitar lesiones nerviosas. Se utilizan rollos extras laterales y una fijación de la cadera, para minimizar el movimiento del paciente. Las piernas deben estar cómodas, evitando zonas de presión (figura 2). (Lea También: Trabajo en Equipo o Equipo de Trabajo)
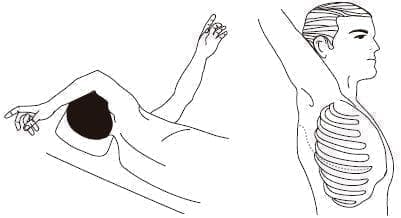 Figura 2. Tiempo quirúrgico torácico: Posición del paciente con toracotomía postero-lateral derecha.
Figura 2. Tiempo quirúrgico torácico: Posición del paciente con toracotomía postero-lateral derecha.
Periodo quirúrgico – Esofagectomía Híbrida
Tiempo quirúrgico abdominal
Posición de los trocares.
El tamaño de los trocares depende del material de instrumentación que se use. Algunas instituciones cuentan con separadores de hígado de 5 o 10 mm y esto puede generar pequeñas variaciones. Generalmente, se usan cinco trocares ubicados en la siguiente forma (figura 1):
- Trocar umbilical de 12 mm para la inserción de la cámara; en pacientes de gran tamaño, se inserta 16 cm por debajo del apéndice xifoides.
- Trocar de 12 mm en la línea medio clavicular derecha, al mismo nivel del primer trocar, para usar la endosutura mecánica en el momento del corte y la ligadura de vasos, y para insertar la sutura en caso de hacerse una piloroplastia, una yeyunostomía o ambas.
- Trocar en la línea medio clavicular izquierda, al mismo nivel de los dos anteriores; su tamaño depende del tipo de separador de hígado que se maneje en la institución y de si se va a practicar una piloroplastia.
- Trocar en el margen costal izquierdo a 6 cm de la línea media, formado un ángulo de 120 º con el lente de la cámara de 5 mm.
- Trocar de 5 mm en el margen costal derecho, en la misma posición del anterior. Estos dos últimos permiten la disección del hiato esofágico y del mediastino posterior.
Disección abdominal y de mediastino posterior.
El ligamento gastrohepático se divide en dirección al diafragma, hasta encontrar el pilar derecho y se continúa sobre el ligamento freno-esofágico todo el camino hasta el mismo pilar derecho; durante este paso se identifica el nervio vago anterior. La disección se inicia sobre el lóbulo caudado del hígado, donde el ligamento es más delgado. El pilar derecho y el izquierdo se separan del esófago, generalmente, con disección roma; en pacientes con radioterapia o quemaduras, puede ser difícil. La disección se debe extender hasta donde sea posible y segura, sin riesgo de lesiones adicionales o sangrado (figura 3).
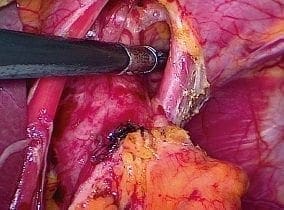 Figura 3. Disección del hiato esofágico, del esófago distal y del mediastino posterior.
Figura 3. Disección del hiato esofágico, del esófago distal y del mediastino posterior.
En este paso se deben retirar los ganglios linfáticos bajos del mediastino y descartar infiltración tumoral de la aorta en pacientes con cáncer.
Corte de vasos gástricos cortos.
Los vasos gástricos cortos se dividen, iniciando en un punto medio a lo largo de la curvatura mayor y se continúa en dirección proximal, conservando la arcada vascular que permita el uso del estómago como neoesófago en la mayoría de su extensión. A través del trocar 2 se inserta el instrumento laparoscópico de energía y, por el trocar 5, el cirujano introduce una pinza para ejercer tracción, mientras el ayudante a la derecha del paciente ejerce tracción sobre la curvatura mayor del estómago a través del trocar 4 (figura 4).
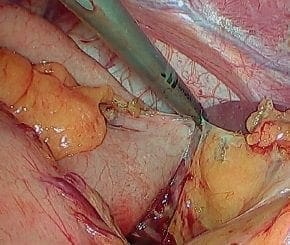 Figura 4. Disección y corte de los vasos gástricos cortos
Figura 4. Disección y corte de los vasos gástricos cortos
Creación de ventana y colocación de drenaje de Penrose alrededor del esófago. Se diseca la pared posterior del esófago como en una fundoplicatura de Nissen y se coloca un drenaje de Penrose alrededor del esófago para tracción y exposición. El drenaje se empuja y se deja abandonado en el mediastino posterior, lo que hace más fácil su identificación en el tiempo torácico (figura 5).
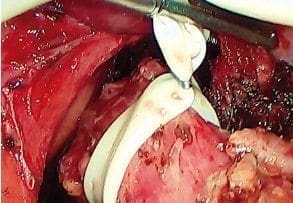 Figura 5. Creación de ventana y colocación del drenaje de Penrose alrededor del esófago
Figura 5. Creación de ventana y colocación del drenaje de Penrose alrededor del esófago
Movilización gástrica. Se diseca la vena coronaria y la arteria gástrica izquierda hasta su base; en pacientes con cáncer se busca la mayor cantidad posible de ganglios y se procede al corte y la ligadura en este lugar, con una endosutura vascular. La movilización y la liberación gástricas se continúan con la disección del epiplón mayor hasta el píloro, preservando la arteria gastroepiploica derecha y la arteria gástrica derecha, las cuales aportarán la irrigación del neoesófago (figura 6).
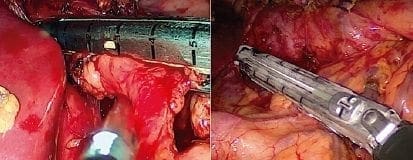 Figura 6. Movilización gástrica. Disección, corte y ligadura de la vena coronaria y de la arteria gástrica izquierda
Figura 6. Movilización gástrica. Disección, corte y ligadura de la vena coronaria y de la arteria gástrica izquierda
Piloroplastia (opcional).
Si se tiene planeado practicar una piloroplastia, el trocar 3 deber ser de 12 mm para insertar la cámara a través del mismo. Se hace un corte longitudinal y una sutura transversal con seda 2 0 en el píloro, a través del trocar 1 y el 4, con el cirujano ubicado al lado derecho de la mesa quirúrgica. Un trocar adicional puede situarse en el cuadrante superior derecho, para formar un ángulo de 120º con la cámara para facilitar la sutura. Se usan dos puntos en cada extremo para permitir la movilización y la tracción, y la sutura se practica sobre un material hemostático (reabsorbible) introducido dentro del píloro, para evitar que la sutura incluya la pared posterior. Finalmente, este se reabsorbe. Este paso se ha abandonado paulatinamente, pues no se observan diferencias y, por el contrario, existe una nueva zona de potencial fuga (figura 7).
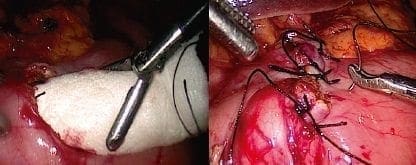 Figura 7. Piloroplastia, sutura sobre material reabsorbible
Figura 7. Piloroplastia, sutura sobre material reabsorbible
Yeyunostomía (opcional).
El trocar 1 se utiliza para la cámara y, el 2 y 5, para manipular y suturar el intestino. Se inserta un tubo 10 F para alimentación a 40 cm distalmente al ligamento de Treitz y, con una seda 3 0, se crea un ‘túnel’ y se fija a la pared abdominal con puntos separados. Este paso también se ha abandonado paulatinamente, pues permite una nueva zona de potencial fuga y porque se inicia una dieta líquida al cuarto día posoperatorio, administrando temporalmente nutrición parenteral; en nuestro medio las sondas de yeyunostomía no son frecuentes y, generalmente, las otras que se usan se tornan disfuncionales en el posoperatorio, a pesar de haber sido probadas durante el procedimiento.
Cierre abdominal.
Los trocares se retiran bajo visión directa, se verifica la hemostasia y, en seguida, se suturan los orificios y se cubren las heridas.
Tiempo quirúrgico torácico
Movilización y resección del esófago.
Se coloca el paciente en decúbito lateral izquierdo y se practica una toracotomía postero-lateral en el quinto espacio intercostal. Para una mejor visualización, se reseca un segmento de costilla de 1,5 cm. Se divide el ligamento pulmonar inferior; en este momento se identifica el drenaje de Penrose abandonado en el tiempo abdominal. También se hace la ligadura de la vena ácigos (ligadura con seda o endosutura vascular).
Se diseca el esófago en sentido distal y proximal, teniendo cuidado de ligar el conducto torácico localizado en el mediastino posterior a la derecha de la vena ácigos. Mediante tracción se desplaza el estómago al tórax, cuidando de no girarlo; después de colocar una pinza de Satinsky en el esófago 3 cm por encima de la vena ácigos, para que no se separe la mucosa de las capas musculares, se secciona el esófago. Enseguida, se forma el tubo gástrico para formar el neoesófago usando sutura mecánica; se refuerza la sutura con seda 3 0 en puntos separados, para no retraer y disminuir su tamaño (figura 8).
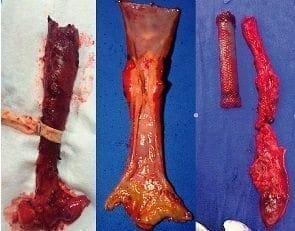 Figura 8. Resección esofágica, especímenes de quemadura esofágica (izquierda) y de tumores esofágicos (centro y derecha).
Figura 8. Resección esofágica, especímenes de quemadura esofágica (izquierda) y de tumores esofágicos (centro y derecha).
Anastomosis esofagogástrica intratorácica.
Se hace una anastomosis latero-lateral con endosutura mecánica de 45 mm, la cual permite una mejor flexión que por ser “reticulable” permite un mejor ángulo. Se fija el esófago sobre la pared anterior del fondo gástrico con puntos de Prolene® 3 0 para fijación en cuatro puntos. Y se practican la gastrotomía y la anastomosis con sutura mecánica (tejido mediano) a través de la boca del esófago y la gastrotomía, y se cierra la boca en dos planos, cuidando de tomar el esófago en sentido transversal para evitar desgarros.
En este punto se puede avanzar una sonda de nutrición entérica si no se practicó una piloroplastia, una yeyunostomía o ambas; se prefiere dejar una sonda nasogástrica en el cuerpo del estómago (neoesófago) para disminuir la presión sobre la anastomosis, la cual queda con drenaje libre (figura 9).
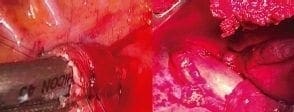 Figura 9. Anastomosis intratorácica latero-lateral con endosutura mecánica
Figura 9. Anastomosis intratorácica latero-lateral con endosutura mecánica
Drenaje y cierre de la pared del tórax. Antes de cerrar la pared torácica, se dejan dos tubos de toracostomía (anterior y posterior) para el adecuado drenaje de la cavidad. Se verifica que exista una buena expansión pulmonar, se aproximan las costillas y se cierra por planos.
Periodo posquirúrgico
Al finalizar el procedimiento, el paciente es llevado a la unidad de cuidados intensivos para monitorización; el catéter peridural permite un adecuado control del dolor en la gran mayoría de los pacientes y no limita la movilidad. En caso de haber decidido dejar una yeyunostomía o una sonda de nutrición entérica, esta se debe iniciar tempranamente.
Al cuarto día posoperatorio, se inicia una dieta líquida, la cual se completa progresivamente. El catéter epidural se retira al quinto día posoperatorio, después de asegurar un adecuado control del dolor. Los tubos de tórax se retiran a medida que disminuye el drenaje.
En caso de sospechar una fuga anastomótica, se deben practicar estudios radiológicos con contraste y una tomografía axial, para evaluar su tamaño, así como pruebas de laboratorio que alerten sobre la presencia de signos de reacción inflamatoria sistémica. Ante la existencia de una fuga pequeña con ausencia de signos de reacción inflamatoria, se suspende la vía oral, y se suministra alimentación entérica y antibióticos. Se deben repetir los estudios imaginológicos a los siete días o si se presenta nueva sintomatología. En presencia de signos de reacción inflamatoria, la reanimación hídrica y el manejo inicial son iguales; sin embargo, se deben considerar el drenaje percutáneo, una endoprótesis colocada con endoscopia o una nueva intervención, según la gravedad del caso.
Como en cualquier procedimiento, la evolución del paciente determina el procedimiento que se debe seguir y el momento del egreso.
Discusión – Esofagectomía Híbrida
La esofagectomía es el tratamiento de elección en pacientes con enfermedades como el cáncer esofágico potencialmente resecable, quemaduras esofágicas, acalasia terminal o perforaciones esofágicas, entre otras. Existen diferentes abordajes y opciones, las cuales se han ampliado con la cirugía asistida con video 1-5.
Se presenta un procedimiento sencillo con las ventajas de la laparoscopia durante el ascenso gástrico, con el cual, si no se practica yeyunostomía y piloroplastia (como lo hemos venido haciendo progresivamente), disminuye el tiempo operatorio y se limitan las complicaciones intrabdominales que puedan presentarse. El abordaje transtorácico abierto permite una amplia exposición que, en pacientes con fistulas traqueoesofágicas por quemaduras químicas o en aquellos sometidos a radioterapia, facilita el control del sangrado, la disección y el tratamiento de las enfermedades concomitantes 1,4.
En pacientes seleccionados con cáncer de esófago (estadios tempranos), es una opción válida para su manejo, con tasas similares de supervivencia y complicaciones 5-8.
La esofagectomía per se constituye un procedimiento complejo con gran morbilidad (23 a 50 %) y mortalidad (2 a 8 %), las cuales se reducen (11 a 25% y 1 a 3%, respectivamente) cuando se hace uso de técnicas mínimamente invasivas con asistencia de video 6.
La anastomosis latero-lateral intratorácica practicada como se ha descrito es segura y, en comparación con las anastomosis manuales, produce menores tasa de fugas (10 Vs. 20,9 %) y de estenosis (20,3 Vs. 6,3 %) 9-11.
La esofagectomía transtorácica ha demostrado mayores tasas de complicaciones respiratorias.
No obstante, con el uso rutinario del catéter epidural torácico implantado en la etapa preoperatoria para manejar el dolor, se disminuye la tasa de neumonía (28 Vs. 48 %; p=0,005), la necesidad de reintubar (17 Vs. 34 %; p=0,011), la estancia media en la unidad de cuidados intensivos (2,8 Vs. 5,8 días; p=0,001), la estancia hospitalaria media (17 Vs. 21 días; p=0,015) y la mortalidad hospitalaria (0 Vs. 8 pacientes; p=0,003) 12.
La nutrición entérica temprana se encuentra asociada con reducción de la inflamación y aumento de la reacción inmunológica, con una rápida recuperación de la motilidad intestinal, lo cual disminuye los costos. Estos beneficios se pueden obtener con una yeyunostomia o con la sonda de nutrición entérica. Sin embargo, el inicio temprano de la dieta oral en los pacientes con una anastomosis segura latero-lateral y con una baja tasa de fugas anastomóticas, limita el uso de la nutrición parenteral por pocos días 13.
En conclusión, consideramos que la esofagectomía hibrida transtorácica con ascenso gástrico laparoscópico y anastomosis intratorácica latero-lateral con sutura mecánica es un procedimiento sencillo para el personal con entrenamiento adecuado y seguro con una baja tasa de complicaciones.
Agradecimientos – Esofagectomía Híbrida
Agradecemos a Myriam Raquel Cortés Rodríguez, Mélida Jiménez Reyes, María del Tránsito Gaona de Borráez y Leonor Segura Libreros, por su constante apoyo en nuestro desarrollo académico y personal.
Hybrid esophagectomy: transthoracic esophagectomy with laparoscopic gastric ascent, how we do it
Abstract – Esofagectomía Híbrida
Esophagectomy is the gold standard in the treatment of patients with esophageal cancer and other entities. Multiple approaches and options are available, which have been amplified with the advent of video assisted surgery which is associated with shorter hospital stays, lesser infection rates, less pain and early return to daily activities. This paper describes the approach for trans-thoracic hybrid esophagectomy with laparoscopic gastric ascent and side-to-side intrathoracic esophagogastric anastomosis, which combines the advantages of laparoscopy with those of the transthoracic open approach.
Key words: esophagus; esophageal neoplasms; esophagectomy; thoracotomy; laparoscopy.
Referencias – Esofagectomía Híbrida
- 1. Allaix ME, Herbella FA, Patti MG. Hybrid trans-thoracic esophagectomy with side-to-side stapled intra-thoracic esophagogastric anastomosis for esophageal cancer. J Gastrointest Surg. 2013;17:1972-9.
- 2. Ramírez JC, Córdoba A, Medina GS. Esofagectomía mínimamente invasora: experiencia en el Hospital de San José, 2009-2010. Rev Colomb Cir. 2013;28:117-26.
- 3. Braghetto I, Csendes A, Carmedil G, Burdiles P, Rodríguez A, Guerra J. Complicaciones de la esofagectomía: diagnóstico, mecanismo fisiopatológico, prevención y manejo. Rev Chil Cir. 2002;54:451-63.
- 4. Messager M, Pasquer A, Duhamel A, Caranhac G, Piessen G, Mariette G. Laparoscopic gastric mobilization reduces postoperative mortality after esophageal cancer surgery: A French nationwide study. Ann Surg. 2015;262:817-23.
- 5. Xiong WL, Li R, Lei H-K, Jiang ZY. Comparison of outcomes between minimally invasive osophagectomy and open oesophagectomy for oesophageal cancer. ANZ J Surg. 2015 Oct 19. doi: 10.1111/ans.13334..
- 6. Mu J, Gao S, Maoo Y, Mao Y, Xue Q, Yuan Z, Li N, et al.. Open three-stage transthoracic oesophagectomy versus minimally invasive thoraco-laparoscopic oesophagectomy for oesophageal cancer: Protocol for a multicenter prospective, open and parallel, randomized controlled trial. BMJ Open. 2015;5:e008328.
- 7. Nason K. Minimal or maximal surgery for esophageal cancer? J Thorac Cardiovasc Surg. 2016;151:633-5..
Bibliografías – Esofagectomía Híbrida
- 8. Deldycke A, Daele VE, Ceelen W, Nieuwenhove YV, Pattyn P. Functional outcome after Ivor Lewis esophagectomy for cancer. J Surg Oncol. 2016;113:24-8.
- 9. Harustiak T, Pazdro A, Snajdauf M, Stolz A, Lischke R. Anastomotic leak and stricture after hand-sewn versus linear-stapled intrathoracic oesophagogastric anastomosis: Single-center analysis of 415 oesophagectomies. Eur J Cardiothorac Surg. 2015 Nov 15. pii: ezv395.
- 10. Orringer MB, Marshall B, Iannettoni MD. Eliminating the cervical esophagogastric anastomotic leak with a side-to-side stapled anastomosis. J Thorac Cardiovasc Surg. 2000;119:277- 88.
- 11. Zhao L, Ge J, Li W, Luo Y, Chai Y. Minimally invasive esophageal resection and intrathoracic anastomosis for lower thoracic esophageal cancer with single position. J Thorac Dis. 2015;7:1486-8.
- 12. Cense HA, Lagarde SM, de Jong K, Omloo JM, Busch OR, Henny CP, et al. Association of no epidural anesthesia with postoperative morbidity and mortality after transthoracic esophageal cancer resection. J Am Coll Surg. 2006;202:395- 400.
- 13. Rajabi Mashhadi MT, Bagheri R, Ghayour-Mobarhan M, Zilaee M, Rezaei R, Maddah G,, et al. Early Post Operative Enteral Versus Parenteral Feeding after Esophageal Cancer Surgery. Iran J Otorhinolaryn. 2015; 27: 331-6
Correspondencia: Bernardo A. Borráez, MD
Correo electrónico: bborraez@hotmail.com
Bogotá, D.C.
Autores – Esofagectomía Híbrida
1 AngélicaM. Borráez, JohanaPáez. Departamento de Medicina General, Universidad La Sabana, Bogotá, Colombia
2 Oswaldo A. Borráez. Departamento de Cirugía General, Universidad Nacional, Bogotá, D.C., Colombia
3 Bernardo A. Borráez. Departamento de Cirugía General. Fundación Clínica Shaio, Bogotá, Colombia.
4 Bernardo A. Borráez. Fellow Cirugía Gastrointestinal y Endoscopia Digestiva, Instituto Nacional de Cancerología – Universidad Militar Nueva Granada, Bogotá D.C., Colombia.
Citar como: Borráez AM, Páez J, Borráez OA, Borráez BA. Esofagectomía híbrida: esofagectomía transtorácica con ascenso gástrico laparoscópico, cómo lo hacemos. Rev Colomb Cir. 2016;31:91-97.