En Pacientes con Pancreatitis Aguda Grave
SERGIO IVÁN HOYOS DUQUE, MD* , NUBIA GIRALDO, MD**,
JORGE DONADO, MD***, KATHERINE HENAO, MD****, MÓNICA PELÁEZ HERNÁNDEZ*****
Palabras clave: pancreatitis, terapia nutricional, costos y análisis de costos.
Resumen
Introducción: El soporte nutricional en pancreatitis aguda grave ha sido controversial según los resultados. Nuestro objetivo es describir los resultados en días de hospitalización, costos y complicaciones según el tipo de soporte nutricional (enteral, parenteral y mixto) en pacientes con pancreatitis aguda grave.
Materiales y métodos: Se realizó un estudio observacional descriptivo (serie de casos) en 45 pacientes con diagnóstico de pancreatitis aguda y criterios de cuadro grave, que ingresaron al Hospital Pablo Tobón Uribe durante 1999-2004. Para el análisis estadístico se utilizaron las siguientes pruebas: Chi cuadrado para comparación de proporciones, Kuskall Wallis y U de Mann Whitney para la comparación de promedios entre los diferentes grupos.
Resultados: La principal causa de pancreatitis fue la de origen biliar (49%). La NE fue la más utilizada (48,8%). Al comparar la NE y NPT se presentaron diferencias estadísticamente significativas en hiperglicemia (p=0.0001) y días de hospitalización (p=0.047). No se presentaron diferencias en las complicaciones generales (p=0.053), ni en las infecciosas (p=0.136).
La nutrición mixta tuvo resultados similares a la NPT en hiperglicemia, días de estancia hospitalaria y costos. No hubo mortalidad en esta serie.
Conclusión: La NE se puede usar con seguridad en pacientes con pancreatitis aguda grave; con ella se logra mejor control de la glicemia y menos días de hospitalización. Se observó además la necesidad de implementar nutrición mixta en algunos pacientes en quienes no se logra siempre llenar los requerimientos sólo con NE.
Introducción
La pancreatitis aguda ha sido definida como una condición inflamatoria del páncreas que compromete de manera variable los tejidos peripancreáticos, e incluso puede llegar a ser causa de falla orgánica múltiple (FOM) (1, 2).
La incidencia de esta entidad varía entre diferentes países, pero se encuentran entre 5,4 y 79,8 casos por 100000 habitantes (3, 4) y la mortalidad se calcula entre 10 y 15% (5, 6). La gravedad varía desde cuadros leves en un 70-80% de los casos, hasta la pancreatitis aguda grave en un 20-30%. Es en ésta última donde se presentan las complicaciones y la mortalidad asociada a la enfermedad (7, 8).
En esta entidad se requiere un manejo interdisciplinario dentro del cual el soporte nutricional es fundamental (9), ya que se pretende minimizar el catabolismo y suministrar los nutrientes necesarios para mantener el funcionamiento de los demás órganos. La respuesta metabólica del paciente, la gravedad de la enfermedad y el estado nutricional previo a la lesión, forman un perfil completo que ayuda en el diseño de la terapia nutricional (10).
Sin embargo, en los protocolos de manejo de pacientes con pancreatitis aguda grave no está claramente definido el tipo de nutrición a utilizar, y aunque tradicionalmente la nutrición parenteral total (NPT) ha sido el soporte de elección porque evita la estimulación pancreática, existe evidencia que asocia la nutrición enteral total (NE) con menos costos y disminución en las complicaciones sépticas y metabólicas (11-14).
En este trabajo se analizan los resultados del manejo nutricional como parte de la terapéutica en los pacientes con pancreatitis aguda grave, en un hospital de tercer nivel de complejidad.
Materiales y Métodos
Se realizó un estudio observacional descriptivo (serie de casos) en pacientes con diagnóstico de pancreatitis aguda grave (PAG) que ingresaron al Hospital Pablo Tobón Uribe durante los años 1999 y 2004. Se incluyeron los pacientes que presentaron cuadro clínico de pancreatitis aguda, asociado a un aumento de amilasas tres veces por encima de su valor normal; la gravedad de la pancreatitis se determinó por la presencia de 3 ó más criterios de Ranson, la presencia de más de un criterio de falla orgánica, o criterios tomográficos (Balthazar D o E o por índice de gravedad) (15-18).
El proyecto fue aprobado por el Comité de Investigación del Hospital Pablo Tobón Uribe. La información se obtuvo de las historias clínicas y de la base de datos del grupo de soporte nutricional. Las variables analizadas fueron las siguientes: edad, sexo, causa de la pancreatitis, índice de masa corporal (IMC), diagnóstico nutricional, colocación sonda nasoyeyunal, tipo de soporte nutricional, intolerancia a NE, tipo de fórmula enteral, complicaciones, hiperglicemia, infección, días de hospitalización, muerte y costo total de la hospitalización.
El tipo de soporte nutricional se clasificó en: enteral, parenteral y mixto. Éste último definido como la administración de NE y NPT para lograr mantener los requerimientos nutricionales en las etapas críticas de la enfermedad a pacientes en quienes la NE no se logró de manera rápida debido a intolerancia o algún grado de ileus.
Para el análisis estadístico se utilizaron los programas SPSS versión 11.5 (SPSS Inc., Chicago, Illinois) y EPINFO 3.1. Algunos datos se reportaron como medianas, promedios y DS. Se usó la prueba de Chi cuadrado para la comparación de proporciones. Una vez determinada la normalidad de las variables analizadas mediante la prueba de Shapiro Wilk, se utilizaron la prueba de Kuskall Wallis para la comparación de los resultados entre los tres grupos de soporte nutricional y la U de Mann Whitney para la comparación de promedios entre dos grupos. El nivel de significancia estadística se estableció como p<0.05.
Resultados
Se obtuvieron 45 registros de pacientes con pancreatitis aguda grave, con edad promedio de 43.7±18.2 años, con una frecuencia mayor en el grupo de mujeres (57,8%). Véase tabla 1.

Al analizar la etiología, se encontró como principal causa de pancreatitis la de origen biliar 49% (n=22), seguido por la idiopática 33% (n=15), alcohólica 11% (n=5), y trauma 7% (n=3).
Se realizó una clasificación nutricional a los pacientes durante la valoración inicial en el ingreso hospitalario, se encontró que el 48,9% (n=22) de los pacientes estaba clasificado dentro de los parámetros de sobrepeso, seguido por el grupo de pacientes con estado nutricional normal 31,1% (n=14), obesidad 4,4% (n=2), y déficit nutricional leve 6,6% (n=3).
En 4 pacientes no fue posible obtener este dato ya que no se encontraba registrado en las historias clínicas. De los tres esquemas de nutrición que recibieron los pacientes, la nutrición enteral fue la más utilizada 48,8% (n=22); seguido por nutrición mixta y la nutrición parenteral total con 26,6% (n=12) y 24,5% (n=11) respectivamente.
Para la nutricional enteral se utilizaron fórmulas oligoméricas, las cuales minimizan las secreciones pancreáticas y favorecen la absorción por tener algunos nutrientes hidrolizados. Se documentó intolerancia al producto en 38,4% (n=13) de los 34 pacientes que recibieron este tipo de soporte nutricional.
El acceso al yeyuno por vía endoscópica combinada con fluoroscopia, fue el método utilizado por el grupo de soporte nutricional para garantizar la administración de la nutrición enteral. De todos los pacientes hubo fracaso en la colocación de la sonda en 5,9% (n=2).
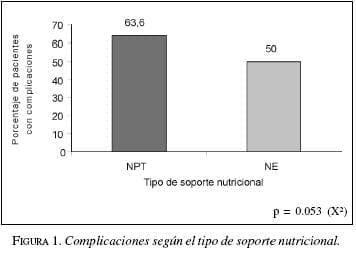
En cuanto a las complicaciones generales en los pacientes (infecciosas, fístulas o colecciones, derrame pleural) en el presente estudio se encontró una incidencia mayor en el grupo de pacientes con nutrición parenteral 63,6% (n=7) vs. el grupo con nutrición enteral 50% (n=11).
El análisis estadístico entre los grupos de NPT y NE no mostró diferencias estadísticamente significativas p=0.053. Figura 1.
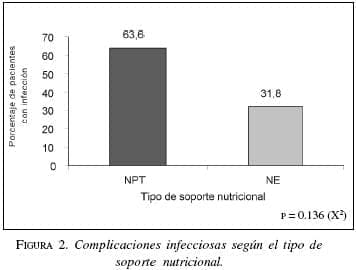
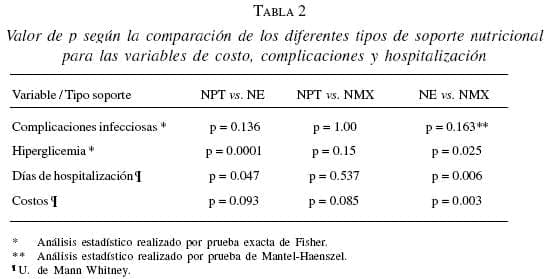
Complicaciones infecciosas se encontraron en el 63,6% (n=7) de los pacientes con NPT, y en el grupo con NE, 31,8% (n=7). El análisis estadístico no encontró una diferencia significativa (p=0.136). Figura 2, tabla 2.
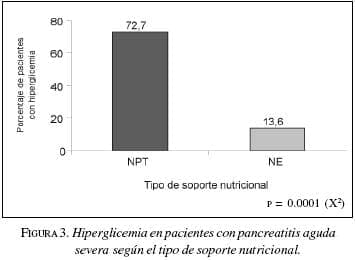
Dentro de las complicaciones metabólicas, la hiperglicemia, valorada como un factor de mal con trol metabólico, se presentó en 72,7% (n=8) de los pacientes con nutrición parenteral y en 13,6% (n=3) en el grupo de nutrición enteral. La diferencia fue estadísticamente significativa (p=0.000). Figura 3.
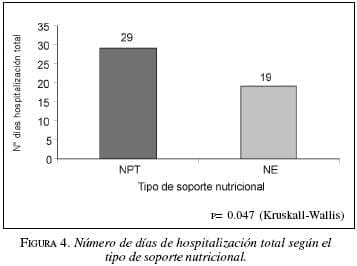
Otra de las variables analizadas fue el número de días de hospitalización (mediana 22); los pacientes con NPT estuvieron un promedio de 29 días (rango 11-60 días), el grupo con NE 19 días (8-40). Aquí también hubo diferencia estadísticamente significativa p=0.012. Figura 4.
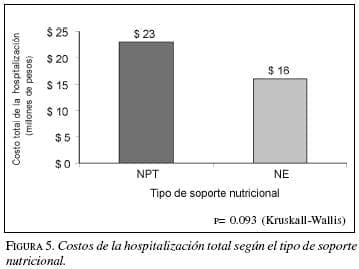
En cuanto a los costos totales de la hospitalización (mediana $15.000.000) se encontró una gran variabilidad. Se observó que el grupo con nutrición mixta tuvo gastos más elevados, en promedio de $38.318.349, seguido por los pacientes de NTP y NE con $23.226.719 y $16.076.709 respectivamente. En la comparación entre los tipos de soporte nutricional NPT vs. NET no tuvieron diferencia significativa (p=0.093). Figura 5. No se presentó mortalidad en esta serie.
* Cirujano de hígado, vías biliares y páncreas. Hospital Pablo Tobón Uribe. Grupo gastrohepatología, Universidad de Antioquia.
** Nutricionista. Epidemióloga. Docente Facultad de Nutrición y dietética, Universidad de Antioquia.
*** Internista. Jefe Unidad de Investigación y Docencia. Hospital Pablo Tobón Uribe.
**** Nutricionista, Hospital Pablo Tobón Uribe. Medellín, Colombia. Grupo Gastrohepatología Universidad de Antioquia.
***** Estudiante pregrado de Medicina, Universidad de Antioquia.
*
Discusión
Desde hace varios años se viene presentando un creciente interés por tratar de definir un tipo de soporte nutricional en pacientes con PAG, que sea seguro y esté asociado con menos complicaciones, días de estancia hospitalaria y costos. Precisamente uno de los objetivos del presente trabajo fue describir el comportamiento de los pacientes con pancreatitis aguda grave manejados en un hospital de III nivel de complejidad, según el tipo de soporte nutricional y su relación con las variables mencionadas anteriormente. Para comenzar, en el análisis de las características de la población en nuestro estudio, se encontró que la causa principal de pancreatitis fue biliar, lo cual coincide con lo reportado en algunas series de otros países (19-23). En concordancia con lo anterior, se evidenció que el género más afectado fue el femenino.
Con respecto a la clasificación nutricional de los pacientes, se ha observado que la obesidad (IMC>30) tiene un impacto negativo en el pronóstico y la severidad de la pancreatitis aguda (24, 25) e incluso algunos autores recomiendan que el IMC debería ser calculado en todos los pacientes que ingresan con diagnóstico de PA (26). En nuestra serie sólo 2 pacientes presentaban un IMC>30, pero el 50% de los pacientes presentaron un IMC=25.8 ó más, lo que posiblemente indica que el sobrepeso podría constituirse en un factor de riesgo.
Como ya es conocido, la nutrición enteral temprana ha demostrado mejorar el balance nitrogenado, la reparación tisular, la función inmunológica, un mejor funcionamiento de los sistemas celulares antioxidantes, disminución de la respuesta hipermetabólica y preservación de la integridad de la mucosa intestinal. La nutrición temprana en pacientes críticamente enfermos se ha asociado con menor incidencia de infecciones y menor estancia hospitalaria (27).
Acerca de la seguridad de la administración de nutrientes por vía enteral, existen trabajos que demuestran que el uso de la vía enteral distal al duodeno, genera un estímulo semejante al de la NPT (28), el cual es mínimo en cuanto a la secreción enzimática se refiere. Resultados de investigaciones como la de Bodoky y col. (29) y Pisters y col. (30) llegan a la conclusión de que la administración de nutrientes a yeyuno mediante NE no incrementa el volumen exocrino del páncreas ni el del bicarbonato comparado con controles. Por otra parte, la NPT favorece la presencia de alteraciones en la barrera intestinal por un aumento en la permeabilidad de ésta (31-32) y por la alteración funcional de las células del epitelio intestinal (33).
Estudios clínicos recientes sobre manejo nutricional de pacientes con pancreatitis aguda han mostrado mejores resultados con la nutrición enteral en términos de disminución de la respuesta inflamatoria, reducción en la incidencia de infección, cirugías y costos de la hospitalización (34). McClave y col. (11) publicaron uno de los primeros estudios randomizados de NPT versus NET, el cual mostró mayor costo con el uso de la NPT, pero incluyó pancreatitis leves y crónica. En nuestra serie la diferencia en él no fue una variable con diferencias significativas al comparar los esquemas de nutrición parenteral y enteral (p=0.093). Con respecto al costo, hallazgos similares a los de McClave fueron encontrados por Louie y col. en su estudio realizado en Canadá (35).
Uno de los trabajos que mejores aportes ha dado al uso y beneficio de la NET sobre la NPT en pancreatitis aguda severa, es el de Kalfarentzos y col. (12); para este estudio se incluyeron 38 pacientes. Se encontró que los individuos que habían recibido NE, presentaron menor número de complicaciones sépticas (p<0.01) y complicaciones generales (p<0.05); no hubo diferencias significativas en el requerimiento de antibióticos, ni en el tiempo de estadía hospitalaria. Nuevamente se confirmó la diferencia en los costos de la NET vs. la NPT.
Contrario a estos resultados, los pacientes de nuestra serie no tuvieron diferencias estadísticamente significativas en la presentación de complicaciones generales (p=0.053); estas diferencias podrían deberse al diseño metodológico empleado y a que en nuestra serie se incluyó un nuevo grupo que recibía nutrición mixta.
En otro estudio, Windsor y col. (13) mostraron mejores resultados con la NET vs. NPT, no sólo en morbilidad sino también en necesidad de cirugía y UCI. Un metaanálisis que incluyó 6 ensayos clínicos aleatorizados y un total de 263 pacientes, comparó la nutrición enteral y parenteral en pacientes con pancreatitis aguda; mostrando que la nutrición enteral estaba asociada con menor frecuencia de infección (p=0.004), cirugía (p=0.05) y estancia hospitalaria (p<0.001). Sin embargo, no hubo diferencias significativas en la mortalidad ni en la incidencia de complicaciones diferentes a la infección (36).
En nuestra serie un hallazgo similar se presentó con relación al menor número de días de estancia hospitalaria que se observó entre los dos tipos de soporte (p=0.047), pero encontrándose la diferencia más significativa entre los grupos NE y NMX (p=0.006).
En este estudio no se presentaron diferencias significativas en las complicaciones sépticas (p=0.136).
Sin embargo, en la literatura se reportan que las diferencias en las complicaciones infecciosas están explicadas por el estímulo trófico que tiene la nutrición enteral en la mucosa intestinal y en el tejido linfoide asociado (GALT), lo cual disminuye la translocación bacteriana (37); también se ha descrito que los pacientes con NPT pueden desarrollar alteraciones en la inmunidad celular y humoral, aumentando el riesgo de presentar complicaciones infecciosas (38).
Es importante mencionar que el presente trabajo incluye un grupo de nutrición mixta, en el cual los pacientes estaban recibiendo NP y, por lo tanto, estaban expuestos a los riesgos de infección del catéter y a las otras complicaciones sépticas asociadas con este tipo de soporte.
La más reciente publicación de McClave y col. (39) sobre resultados del soporte nutricional en pancreatitis aguda, mostró nuevamente que el uso de NET está asociado con una reducción significativa en las complicaciones infecciosas (p=0.001), menos días de estancia hospitalaria (p<0.0001) y ningún efecto en la mortalidad (p=0.72). Los resultados de algunos estudios allí analizados, sugieren que la NET comparada con la NPT, reduce el estrés oxidativo, favorece la resolución rápida del proceso y tiene menor costo.
Con la evidencia que existe hasta hoy, ya son varios los expertos que recomiendan la NET como el soporte nutricional de primera elección en el manejo del paciente con pancreatitis aguda grave (34, 40-45). En nuestro estudio se encontró que la nutrición enteral fue el principal tipo de soporte nutricional implementado, favorecido además por los buenos resultados en la colocación de sonda nasoyeyunal.
La hiperglicemia como complicación metabólica en pacientes críticamente enfermos se ha asociado con dos situaciones: la primera se debe a una respuesta metabólica aguda inducida por el estrés y el desarrollo de resistencia a la acción de la insulina por el aumento de hormonas contrarreguladoras como glucagón, adrenalina y cortisol. La segunda explicación se asocia con el exceso de administración de calorías o sobrealimentación, que se presenta particularmente con la NPT (46-48).
En la presente serie, la diferencia fue bastante significativa en los tres grupos (p=0.000), y en la comparación de cada uno de ellos, NE vs. NPT presentó la diferencia más importante (p=0.0001), seguido por NE vs. NMX (p=0.025), lo que indica que el control metabólico se logra de manera más rápida y efectiva con la NE.
Actualmente se discute que la mayoría de los estudios realizados sobre nutrición en pancreatitis aguda grave fueron realizados antes de observar la asociación que existe entre un estricto control de la glicemia en pacientes en UCI y la reducción en las complicaciones infecciosas, renales, necesidad de soporte ventilatorio y mortalidad (49-51). Es probable que muchas de las complicaciones asociadas a la NPT sean ocasionadas por la hiperglicemia (44) que frecuentemente presentan los pacientes que reciben este tipo de soporte nutricional, y se debe pensar en la necesidad de incluir dentro de los protocolos, esquemas con insulina que permitan mantener estados de normoglicemia.
En conclusión, nuestros resultados en el manejo del soporte nutricional de pacientes con pancreatitis aguda grave donde el principal soporte nutricional es la NE, muestran una menor presentación de complicaciones metabólicas (hiperglicemia) y menos días de estancia hospitalaria al compararla con la NPT que hasta hace pocos años era el soporte de elección.
Un elemento importante es la inclusión en el estudio del grupo con nutrición mixta, que se emplea en pacientes en los cuales por intolerancia a la fórmula, no es posible suministrar todo el aporte calórico del paciente con la NE y hay necesidad de administrar concomitantemente NPT. Este grupo presentó en nuestro estudio resultados similares a la NPT en variables como hiperglicemia, días de hospitalización y costos.
Por ser este un estudio observacional descriptivo (serie de casos) y tener una muestra pequeña de pacientes, no se pueden establecer asociaciones causales.
Costs, Hospital Stay, and Complications According to the Type of Nutritional Support in Patients with Severe Acute Pancreatitis
Abstract
Introduction: Nutritional support in severe acute pancreatitis has been controversial according to outcomes. Our objective is to describe results of length of hospital stay, costs and complications according to nutritional support (enteral, parenteral and mixed) in patients with severe acute pancreatitis.
Methods: An observational descriptive study (Case Series) was made in a sample of 45 patients with severe acute pancreatitis who were admitted to Hospital Pablo Tobón Uribe between 1999 and 2004. Statistical analysis was made by the Chi2 test for proportions comparison, the Kuskall Wallis test and the Mann Whitney’s U for comparison between three and two groups respectively.
Results: The principal cause of pancreatitis was gallstones (49%). Enteral nutrition was the main nutritional support (48,8%). Comparison between total parenteral nutrition and enteral nutrition showed statistically significant difference in hyperglycemia (p=0.0001) and length of hospital stay (p=0.047). There were no statistically significant differences in general complications (p=0.053), or infectious complications (p=0.136). Mixed nutrition had similar results as total parenteral nutrition in hyperglycemia, costs and length of hospital stay. No mortality was registered in this study.
Conclusion: With EN there was better control of glycemia, and a reduced length of hospital stay. We also describe the importance of mixed nutrition in patients unable to use just enteral feeding.
key words: pancreatitis, nutrition therapy, costs and costs analysis.
Referencias
1. ABOU-ASSI S, O’KEEFE SJD. Nutrition in acute pancreatitis. Am J Clin Gastroenterol 2001; 32: 203-209.
2. KINGSNORTH A. role of cytokines and their inhibitors in acute pancreatitis. Gut 1997; 4: 1-4.
3. TOOULI J, BROOKE-SMITH M, BASSI C, et al. Guidelines for the management of acute pancreatitis. J Gastroenterol Hepatol 2002; 17(Suppl): S15-S39.
4. SEKIMOTO M, TAKADA T, KAWARADA Y, et al. JPN Guidelines for the management of acute pancreatitis: epidemiology, etiology, natural history, and outcome predictors in acute pancreatitis. J Hepatobiliary Pancreat Surg 2006; 13: 10-24.
5. MANN DV, HERSHMAN MJ, HITTINGER R, et al. Multicentre audit of death from acute pancreatitis. Br J Surg 1994; 81: 890-893.
6. YOUSAF M, MCCALLION K, DIAMOND T. Management of severe acute pancreatitis. Br J Surg, 2003; 90: 407-420.
7. LOBO D, MEMON M, ALLISON S, et al. Evolution of nutritional support in acute pancreatitis. Br J Surg, 2000; 87: 695-707.
8. WHITCOMB DC. Acute pancreatitis. N Engl J Med 2006; 354: 2142-2150.
9. HOYOS S, HENAO K, GIRALDO N, et al. Evaluación del soporte nutricional en la pancreatitis aguda severa. Lecturas sobre nutrición 2001; 8 (3): 65-70.
10. GONZÁLEZ MA, RESTREPO B. Soporte nutricional y metabólico en el paciente críticamente enfermo. En: González M, Restrepo G, Sanín A. Fundamentos de Medicina, paciente en estado crítico, 3a. ed., CIB. 2003; 56-73.
11. MCCLAVE S, GREENE L, SNIDER HL, et al. Comparison of the safety of early enteral vs. parenteral nutrition in mild acute pancreatitis. JPEN 1997; 21: 14-20.
12. KALFARENTZOS F, KEHAGIAS J, MEAD N, et al. Enteral nutrition is superior to parenteral nutrition in severe acute pancreatitis: results of a randomized prospective trial. Br J Surg 1997; 84: 1665- 1669.
13. WINDSOR A, KANWAR S, LI AG, et al. Compared with parenteral nutrition, enteral feeding attenuates the acute phase response and improves disease severity in acute pancreatitis. Gut 1998; 42: 431-435.
14. ABOU-ASSI S, CRAIG K, O’KEEFE S. Hipocaloric jejunal feeding is better than total parenteral nutrition in acute pancreatitis: results of a randomized comparative study. Am J Grastoenterol 2002; 97:2255-2262.
15. RANSON JHC, RIFKIND KM, ROSES DF, et al. Prognostic signs an the role of operative management in acute pancreatitis. Surg Gynecol Obstet 1974; 139: 69-81.
16. RANSON JH. Etiological and prognostic factors in human acute pancreatitis: a review. Am J Gastroenterol 1982; 77: 633-638.
17. BALTHAZAR E, ROBINSON D, MEGIBOW A, et al. Acute pancreatitis value of CT in establishing prognosis. Radiology 1990; 174: 331-336.
18. TRAN D, CUESTA M. Evaluation of severity in patients with acute pancreatitis. Am J Gastroenterol 1992; 87: 604-608.
19. ANDERSSON R, ANDERSSON B, HARALDSEN P, et al. Incidence, management, and recurrence rate of acute pancreatitis. Scand J Gastroenterol 2004; 39 (9): 891-894.
20. GISLASON H, HORN A, HOEM D, et al. Acute pancreatitis in Bergen, Norway: a study on incidence, etiology, and severity. Scand J Surg 2004; 93 (1): 29-33.
21. GULLO L, MIGLIORI M, OLAH A, et al. Acute pancreatitis in five European countries: etiology and mortality. Pancreas 2002; 24 (3): 223-227.
22. CAVALLINI G, FRULLONI L, BASSI C, et al. ProInf-AISP Study Group prospective multicentre survey on acute pancreatitis in Italy (ProInf-AISP): results on 1005 patients. Dig Liver Dis 2004; 36 (3): 205-211.
23. SUAZO-BARAHONA J, CARMONA-SÁNCHEZ R, ROBLES-DÍAZ G, et al. Obesity: a risk factor for severe acute biliary and alcoholic pancreatitis. Am J Gastroenterol 1998; 93 (8): 1324-1328.
24. HIROTA M, TAKADA T, KAWARADA Y, et al. JPN Guidelines for the management of acute pancreatitis: severity assessment of acute pancreatitis. J Hepatobiliary Pancreat Sur 2006; 13: 33-41.
25. MARTÍNEZ J, SÁNCHEZ PJ, PALEZON JM, et al. Obesity: a prognostic factor of severity in acute pancreatitis. Pancreas 1999; 19: 15-20.
26. PITCHUMONI CS, PATEL NM, SHAH P. Factors influencing mortality in acute pancreatitis. J Clin Gastroenterol 2005; 39: 798-814.
27. MARIK PE ZALOGA GP. Early enteral nutrition in acutely ill patients: a systemic review. Crit Care Med 2001; 29: 2264-2270.
28. MCCLAVE S, RITCHIE C. Artificial nutrition in pancreatic disease: ¿what lessons have we learned from the literature? Clin Nutrit 2000; 19: 1-6.
29. BODOKY G. HARSANYI L. PAP A, TIHANYI T, et al Effect of enteral nutrition on exocrine pancreatic function. AM J SURG JAN 1991; 161 (1): 144-1448.
30. PISTERS PW, Ranson JHC. Nutritional support for acute pancreatitis. Surg Gynecol Obstet 1992; 175: 275-284.
31. BUCHMAN AL, MOUKARZEL AA, et al. Parenteral nutrition is associated with intestinal morphologic and functional changes in humans. J Parenter Enteral Nutr 1995; 19: 453-460.
32. KALFARENTZOS FE, KARAVIAS DD, KARATZAS TM, et al. Total parenteral nutrition in severe acute pancreatitis. J Am Coll Nutr 1991; 10: 156-162.
33. MIURA S, TANAKA S, YOSHIOKA M, et al. Changes in intestinal absorption of nutrients and brush border glycoproteins after total parenteral nutrition in rats. Gut 1992; 33: 484-489.
34. TAKEDA K, TAKADA T, KAWARADA Y, et al. JPN Guidelines for the management of acute pancreatitis: medical management of acute pancreatitis. J Hepatobiliary Pancreat Sur 2006; 13: 42-47.
35. LOUIE BE, NOSEWORTHY T, HAILEY D, et al. 2004 McLean Mueller Prize. Enteral or parenteral nutrition for severe pancreatitis; a randomized controlled trial and health technology assessment. Can J Surg 2005; 48 (4): 298-306.
36. MARIK P, ZALOGA G. Meta-analysis of parenteral nutrition versus enteral nutrition in patients with acute pancreatitis. BMJ 2004; 328: 1407-1413.
37. OLA’H A, PARDAVI G, BELA’GYI T, et al. Mohamed GA. Early nasojejunal feeding in acute pancreatitis is associated with a lower complication rate. Nutrition 2002; 18: 259-262.
38. MARIK PE, PINSKY M. Death by parenteral nutrition. Intensive Care Med 2003; 29: 867-869.
39. MCCLAVE SA, CHANG WK, DHALIWAL R, et al. Nutrition support in acute pancreatitis: a systematic review of the literature. J Parenter Enteral Nutr 2006; 30 (2): 143-156.
40. SWAROOP VS, CHARI ST, CLAIN JE. Severe acute pancreatitis. JAMA 2004; 23: 2865-2868.
41. UK Working party on acute pancreatitis. UK guidelines for the management of acute pancreatitis. Gut 2005; 54 (Suppl III) III1-III9.
42. MITCHELL RM, BYRNE MF, BAILLIE J. Pancreatitis. Lancet 2003; 361: 1447-1455.
43. MONTERO JG, GARCÍA A, ORDÓÑEZ FJ. Soporte nutricional en la pancreatitis aguda. Nutr Hosp 2005; 20: 25-27.
44. NATHENS A, CURTIS JR, BEALE RJ, et al. Management of the critically ill patient with severe acute pancreatitis.Crit Care Med 2004; 32: 2524-2536.
45. BARREDA L, TARGARONA J, RODRÍGUEZ C. Protocolo para el manejo de la pancreatitis aguda grave con necrosis. Rev. Gastroenterol. Perú 2005; 25: 168-175.
46. ALAEDEEN DI, WALSH MC, CHWALS WJ. Total parenteral nutritionassociated hyperglycemia correlates with prolonged mechanical ventilation and hospital stay in septic infants. J Pediatr Surg 2006; 41: 239-244.
47. BRISTIAN BR. Update on total parenteral nutrition. Am J Clin Nutr 2001; 74: 153-154.
48. VARGA P, GRIFFITHS R, CHIOLERO R, et al. Is parenteral nutrition guilty? Intensive Care Med 2003; 29: 1861-1864.
49. VAN DEN BG, WOUTERS P, WEEKERS F, et al. Intensive insulin therapy in the critically ill patients. N Engl J Med 2001; 345:1359-1367.
50. THORELL A, ROOYACKERS O, MYRENFORS P, et al Intensive insulin treatment in critically ill trauma patients normalizes glucose by reducing endogenous glucose production. J Clin Endocrinol Metab 2004; 89: 5382-5386.
51. CHEUNG NW, NAPIER B, ZACCARIA C, et al. Hyperglycemia is associated with adverse outcomes in patients receiving total parenteral nutrition. Diabetes Care 2005; 28: 2367-2371.
