Una Visión Actual
LÁZARO ANTONIO ARANGO MOLANO, MD*, MARIO SANTACOLOMA OSORIO, MD**, CAMILO ANDRÉS URBANO GUZMÁN, MD***
* Cirujano general, gastroenterólogo clinicoquirúrgico, coordinador posgrado de Gastroenterología Clinicoquirúrgica, Universidad de Caldas, Manizales, Colombia.
** Internista, gastroenterólogo, coordinador posgrado de Gastroenterología Clínica, Universidad de Caldas.
***Residente de IV año de la Universidad de Caldas.
Palabras clave: tumores estromales gastrointestinales, proteina c-kit, agentes antineoplásicos, inhibidores de quinasa de la proteina.
Resumen
Los tumores estromales gastrointestinales son un grupo de neoplasias de baja frecuencia y de reciente diferenciación. Muestran acentuada asociación con la expresión de proteínas que actúan como receptores de la tirosin – kinasa y desempeñan papel importante en su patogénesis. Se consideran de mejor pronóstico que el resto de tumores del tracto gastrointestinal, cuyo riesgo de malignidad se establece con base en el tamaño tumoral y el número de mitosis presentes. El abordaje quirúrgico sigue siendo el estándar de oro para el tratamiento; sin embargo, la aparición de terapias dirigidas con medicamentos como el Imatinib marcan un nuevo paso a favor en el control de la enfermedad.
Introducción
El término GIST (gastrointestinal stromal tumor/tumor estromal gastrointestinal) corresponde a un grupo de tumores de origen mesenquimal que hace 20 años eran clasificados como tumores de músculo liso, pero los avances en microscopía electrónica e inmunohistoquímica han permitido su diferenciación (3, 4). Su presentación no es frecuente, cerca del 0,1 al 3% de las neoplasias del tracto gastrointestinal; se registra un promedio de 5.000 casos nuevos por año en Estados Unidos (4, 13, 11). En nuestro país aún no tenemos datos estadísticos de la prevalencia de esta neoplasia.
No hay compromiso específico por sexo y son más frecuentes en la quinta y sexta década de la vida; sólo un 10% de los casos se presenta en menores de 40 años. Aunque el 70% de estos tumores tiene curso benigno y su pronóstico es mejor que otras neoplasias del tracto gastrointestinal, se considera que todos tienen potencial maligno (1, 4, 8). Su localización más frecuente es en el estómago (60-70%), seguido del intestino delgado (20-30%); el 10% restante se reparte entre esófago, colon y recto, aunque también se puede hallar en el omento, mesenterio y retroperitoneo (7, 11).
Expresión Genética
Quizás una de las características principales de los tumores estromales es la expresión del KIT que corresponde a una glicoproteína de 145 KDa producto del protooncógeno c-Kit y que hace parte de los receptores de tirosina – kinasa, los cuales se expresan en las células hematopoyéticas, mastocitos, células germinales y células intersticiales de Cajal (figura 1). Estas últimas hacen parte de un grupo de células especializadas que actúan como marcapasos del tracto gastrointestinal y participan en la regulación de la motilidad intestinal y se han relacionado típicamente con esta patología.
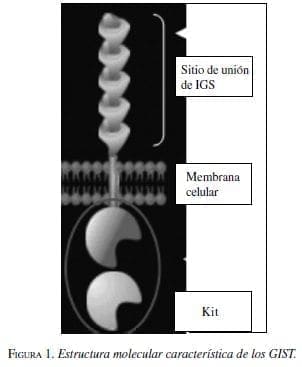
El antígeno c-Kit se expresa en un 95% asociado con GIST, lo que permite su diferenciación y diagnóstico marcando positivo para CD117 en el análisis inmunohistoquímico. Este tipo de proteínas actúa en la activación como señales específicas en la cascada que da origen a la tumorogénesis, participando en la proliferación, adhesión, apoptosis y diferenciación celular.
En el estudio de hibridación genómica comparativa ha sido posible identificar cambios en el ámbito genético, localizados principalmente en el cromosoma 4q11 – q12 y con menos frecuencia en otros cromosomas como: 1p, 8q, 5q, 10q, 15q, 3p, 3q, 9p, 8p.
Adicionalmente los tumores estromales también expresan CD34 la cual es una glicoproteína transmembrana de sialilato que es positiva en 60 – 70% de los GIST (20).
Histología
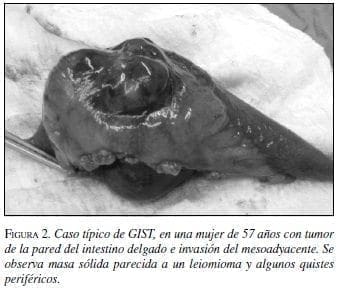
Se han descrito macroscópicamente como tumores bien delimitados, nodulares, lobulados, blandos en su consistencia y con frecuencia localizados en áreas quísticas. Al corte se observa color rosado claro o amarillo (1).
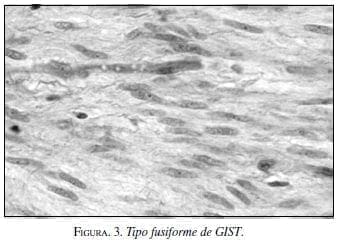
Al microscopio se identifican tres tipos básicos de células: 1. Células fusiformes (60%) (figura 3); 2. Células epitelioides (40%), y 3. Mixtas (10%) (tabla 1). El subtipo sarcomatoso tanto para células fusiformes como epitelioides se considera como el de peor pronóstico (1).

Entre las características histológicas asociadas con malignidad se encuentran atipia nuclear, celularidad marcada, morfología mixta, tasa mitótica por encima de 5 por 50 campos de alto poder, invasión de la mucosa y necrosis (8).
En la tinción para inmunohistoquímica marca positivo para CD117 y CD34; es poco frecuente que sea positivo para desmina, actina para músculo liso y proteína S 100 (1).
Presentación Clínica
Con frecuencia los pacientes son asintomáticos más cuando el tumor tiene menos de 2 cm; se encuentra como hallazgo incidental en de una exploración quirúrgica o en exámenes imaginológicos por otra causa, esta situación se identifica hasta en 30% de los casos (7). El síntoma de mayor presentación es el sangrado digestivo (50%), seguido del dolor o malestar abdominal. Es claro que las manifestaciones encontradas dependerán de la localización específica del tumor, entre los síntomas más comunes se pueden presentar: náuseas, vómitos, pérdida de peso y disfagia. La obstrucción intestinal está asociada con tumores localizados en el intestino delgado aunque su frecuencia es baja (1).
En un porcentaje muy variable que oscila entre 15 y 50% al momento del diagnóstico se puede encontrar enfermedad metastásica, especialmente en hígado y peritoneo, seguidos de retroperitoneo, pulmón, tejido celular subcutáneo, pleura y hueso (1, 4).
Los tumores estromales también se han asociado con la neurofibromatosis tipo I y con la tríada de Carney consistente en tumor estromal gastrointestinal, paraganglioma multicéntrico extraadrenal y condroma pulmonar; esta asociación tiene buen pronóstico con una sobrevida a 20 años de 80% (13, 3, 20).
Factores Pronósticos
Los tumores localizados en el esófago tienen mejor pronóstico que los observados en el intestino delgado (8). El índice de recurrencia es alto según lo muestra el seguimiento a largo plazo, cercano al 90%. Generalmente se presentan dentro de los dos primeros años después de la intervención con un tiempo promedio de aparición de 18 meses; sin embargo, es posible encontrar recurrencia hasta 20 años después (13, 17).
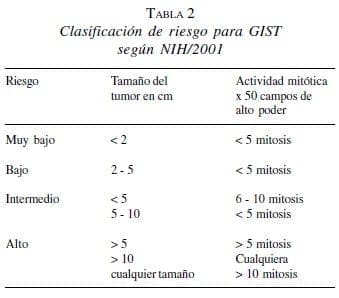
Se han estudiado diferentes variables con el propósito de identificar la asociación con malignidad y que a la vez sean de utilidad para valorar el riesgo y el pronóstico. Se ha establecido que el tamaño del tumor y el número de mitosis son los dos elementos más relevantes.
Estos parámetros definidos por el National Institute of Health (NIH) de Estados Unidos en su convención de abril de 2001 permiten categorizar los tumores dentro de un grupo de riesgo determinado (7) (tabla 2).
En términos generales la sobrevida a cinco años es 85% cuando la malignidad es de bajo grado, descendiendo hasta 55% cuando es de alto grado (20).
Imaginología
Endoscopia: Se observa como una protrusión blanda en el lumen gastrointestinal con una superficie mucosa de aspecto normal, ya que su crecimiento es de predominio extraluminal. En pocas ocasiones son umbilicados o ulcerados (14).
TAC: Es una herramienta diagnóstica muy útil y para determinar la extensión de la lesión que permita hacer un plan quirúrgico. Se visualiza como una masa extraluminal, bien circunscrita con densidad de tejidos blandos y con centro necrótico (4). La presencia de calcificaciones, ulceración, necrosis, áreas quísticas y fístulas se asocian con malignidad (7) (figura 4).
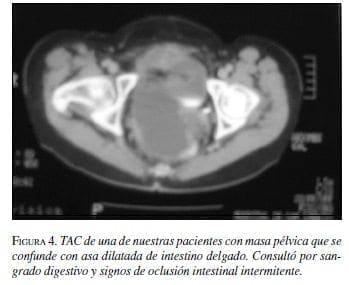
La reciente aparición de la reconstrucción en tercera dimensión permite obtener mejores imágenes que determinan el origen del tumor con mayor seguridad (12, 19).
Endosonografía: En el estudio endosonográfico las lesiones se observan de forma ovoide e hipoecogénicas. La presencia de: espacios quísticos, bordes extraluminales irregulares y focos ecogénicos en su interior dan una sensibilidad de 80 a 100% para definir malignidad si se presentan juntas estas tres características (7). Adicionalmente se pueden obtener biopsias que hasta en 75% son de óptima calidad para confirmar el diagnóstico (14).
PET: Los GIST son tumores metabólicamente muy activos que captan con facilidad la 18- fluorodesoxiglucosa, usada para estadiaje de la enfermedad inicial, para identificar la presencia de metástasis y también como medio de control de la respuesta o resistencia al Imatinib.
