En la Clínica de Seno de la Clínica del Country trabajamos esta técnica desde el año 1998. Inicialmente con un grupo de 3 mastólogos desarrollamos la experiencia y recopilamos los datos. Presentamos la experiencia de dos de nosotros (Robledo JF, Caicedo JJ).
Se llevó a cabo una fase de validación inicial con 65 casos en los cuales se efectuó DGC y VA; iniciamos nuestra experiencia con azul de isosulfán y azul de metileno para la detección del GC. Obtuvimos mejores resultados cuando incorporamos la técnica del radiocoloide, alcanzando una cifra de falsos negativos de 7% (uno de trece casos), con una identificación de más de 90% de los casos; esto nos permitió abandonar el VA (reuníamos los estándares mundiales) y pasar a la práctica rutinaria de la DGC.
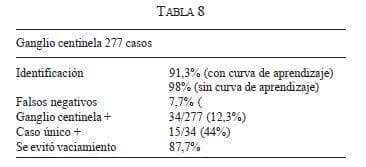
Hasta enero de 2005, habíamos realizado 277 procedimientos; sin tener en cuenta la fase de validación inicial, el porcentaje de detección está en más de 98%. En la mayoría de los casos hemos combinado el azul de metileno con la albúmina sérica marcada con Tc 99 con buenos resultados (tabla 6).

Casi todas las lesiones fueron no palpables, las cuales se combinaron con marcación con alambre o últimamente con marcación con ROLL (Radioguided Occult Lesion Localization), que se traduce como localización radioguiada de lesiones no palpables; este último procedimiento utiliza una macromolécula de albúmina marcada con Tc 99, que tiene la ventaja de no migrar, por lo tanto, la lesión se puede detectar con la sonda y hacer una extirpación de la lesión con menos cantidad de tejido alrededor, y más centrada de lo que se logra con el alambre (tabla 7). Esta técnica fue desarrollada especialmente por el grupo de Milán e introducida en nuestro país por Fabio Torres (28).
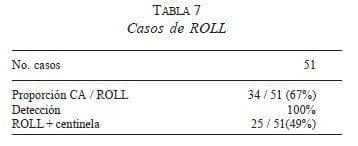
Se identificó el tumor en todos los casos con el radiotrazador. El 67% de los casos demostró ser un carcinoma; en el resto de lesiones se trataba de papiloma o de hiperplasia epitelial atípica, y en el caso de microcalcificaciones benignas de adenosis. Se identificó GC como positivo en 12,3% de los casos, siendo el único positivo en 44% de las pacientes; el promedio de ganglios resecados como centinela fue de 1,4 y finalmente se evitó el VG en 88% de las pacientes (tabla 8).
En siete casos la consulta intraoperatoria informó GC negativo pero en el informe final de anatomía patológica se informaron micrometástasis en cinco de ellos y macrometástasis en dos (de 3 y 4 mm). Tres de estas pacientes fueron reintervenidas; se practicó linfadenectomía axilar. Las otras recibieron radioterapia sobre la axila.
Las complicaciones del procedimiento fueron pocas: cinco casos de seromas postquirúrgicos menores de 10 cc resueltos mediante drenaje por punción. Una paciente presentó hematoma agudo postquirúrgico en la axila que requirió drenaje abierto. Dos casos de necrosis cutánea en el sitio de inyección del azul de metileno posiblemente por inyección muy superficial del medio.
Consideramos que esta es una buena experiencia y coincide con la experiencia del primer año de funcionamiento de la Clínica de Seno, en donde 82% de las pacientes sometidas a cirugía son en estados tempranos de la enfermedad (figura 10). En los casos de carcinoma escamocelular infiltrante de extremidades, creemos se debe convertir en el estándar debido a la alta tasa de infección de estos tumores; produce adenomegalias que clínicamente podrían confundirse con metastásicas. En los dos casos que informamos el GC fue negativo y así evitamos el VG. Es el primer informe en la literatura colombiana sobre la aplicación de esta nueva técnica quirúrgica, con aporte de nuestra experiencia.
Conclusión
La técnica de DGC, se ha convertido en el estándar en centros mundiales de manejo del cáncer mamario y melanoma en estados tempranos, especialmente en países desarrollados. En Colombia el VA sigue siendo la rutina en pacientes con carcinomas infiltrantes de mama y melanoma infiltrante con Breslow mayor a 1 mm. En centros especializados como el nuestro (Clínica de Seno del Country) en donde detectamos la mayoría de la patología mamaria en estados tempranos, hemos abandonado el VA y lo remplazamos por la DGC, después de haber hecho una curva de aprendizaje en conjunto con el grupo de patología y medicina nuclear de la Clínica de Seno.
Hemos realizado 277 procedimientos de GC y evitado el VA en 88% de las pacientes, por lo tanto disminuyendo la morbilidad. Realizamos 51 casos de ROLL, el 50% de ellos simultáneamente con la DGC. Consideramos en nuestra práctica actual estas técnicas como manejo estándar en casos de cáncer temprano de seno, melanoma y carcinoma escamocelular de extremidades.
Dissection of the Sentinel Node. A New Concept, a New Surgical Technique
Abstract
Dissection of the sentinel lymph node has become a standard procedure in the management of early-stage breast cancer and melanomas. A learning-curve is required, together with the proper validation of the technique by surgeons, nuclear medicine specialists, and pathologists before abandoning the orthodox lymph node dissection. The aim of this technique is the rationalization of the axillary lymph node dissection and thus diminishing morbidity.
Several vital stains, such as patent blue, isulphan blue, and, among us, methylene blue, are utilized for the detection of the sentinel node. Also, the radiolocalization techniques of nuclear medicine by means of the injection of colloidal sulphur labelled with 99Tc and the intraoperative use of a gamma probe. All techniques should yield a detection rate superior to 90%, with a false-negative rate below 5%.
We hereby report a literature review together with our experience at the Breast Clinic of Clínica del Country, Bogotá, Colombia, where 82% of our cases present with breast cancer in the early stages. Our report is based on the experience with 277 cases collected between January 1998 and January 2005. Our annual rate of detection of the sentinel lymph node is above 98%, with a false negative rate of 7%. We have avoided the axillary dissection in 87% of our patients with early-stage invasive breast carcinoma. This novel technique has become the standard procedure in the management of early stage breast carcinoma and a clinically negative axilla.
Key words: breast neoplasms, melanoma, sentinel lymph node biopsy, lymph node dissection, radionuclide imaging.
Referencias
1. GILCHRIST RK. Fundamental factors governing lymphatic spread of carcinoma. Ann Surg 1940; 111: 630-639.
2. HALSTED WS. The results of operations for the cure of cancer of the breast performed at the Johns Hopkins Hospital from June 1889 to January 1894; Johns Hopkins Hosp Bull 1894; 4: 297-323.
3. FISHER B, FISHER ER. Barrier function of lymph node to tumor cells and erythrocytes. Cancer 1967; 20: 1907-1913.
4. GOULD EA, WINSHIP T, PHILBIN PH, KERR HH. Observations on a ‘sentinel node’ in cancer of the parotid. Cancer 1960; 13: 77-78.
5. CABAÑAS RM. An approach for the treatment of penile carcinoma. Cancer 1977; 39: 456-466.
6. KETT K, VARGA G, LUKÁCS L. Direct lymphography of the breast. Lymphology 1970; 1: 3-12.
7. CHRISTENSEN B, BLICHERT-TOFT M, SIEMSSEN OJ, NIELSEN SL. Reliability of axillary lymph node scintiphotography in suspected carcinoma of the breast. Br J Surg 1980; 67: 667-668.
8. HAAGENSEN CD, FEIND KR, HERTER FP, SLANETZ CA, WEINBERG JA. The lymphatics in cancer. Philadelphia. WB Saunders Company, 1972.
9. MORTON DL, WEN DR, WONG JH, ECONOMOU JS, CAGLE LA, STORM FK, FOSHAG LJ, et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 1992; 127: 392-399.
10. MORTON DL, WEN DR, COCHRAN AJ. Pathophysiology of regional lymph node metastases in early melanoma studied by intraoperative mapping of the cutaneous lymphatics (abstract). Second International Conference on Melanoma 1989; 131.
11. GIULIANO AE, KIRGAN DM, GUENTHER JM, MORTON DL. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg 1994; 220: 391-398.
12. KRAG DN, WEAVER DL, ALEX JC, FAIRBANK JT. Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe. Surg Oncol 1993; 2: 335-339.
13. GIULIANO AE. Mapping a pathway for axillary staging: a personal perspective on the current status of sentinel lymph node dissection for breast cancer. Arch Surg 1999; 134: 195-199.
14. TURNER RR, OLLILA DW, KRASNE DL, GIULIANO AE. Histopathologic validation of the sentinel lymph node hypothesis for breast carcinoma. Ann Surg 1997; 226: 271-278.
15. PATIÑO RESTREPO JF. Seno. Lecciones de cirugía, Bogotá, Editorial Médica Panamericana, 2000; 325-402. 16. ABAÚNZA H. Cáncer mamario, 2ª ed. Sociedad Colombiana de Cirugía, 1997; 143-183.
17. CODY HS, BORGEN PI. State-of-the-art approaches to sentinel node biopsy for breast cancer: study design, patient selection, technique, and quality control at Memorial Sloan- ettering Cancer Center. Surg Oncol 1999; 8: 85-91.
18. MORROW M, RADEMAKER AW, BETHKE KP, TALAMONTI MS, DAWES LG, CLAUSON J, HANSEN N. Learning sentinel node biopsy: results f a prospective randomized trial of two techniques. Surgery 1999; 126: 714-722.
19. COX CE, SALUD CJ, CANTOR A, et al. Learning curves for breast cancer sentinel lymph node mapping based on surgical volume analysis. J Am Coll Surg 2001; 193: 593-600.
20.DUPONT E, COX C, SHIVERS S, SALUD C, NGUYEN K, CANTOR A, REINTGEN D. Learning curves and breast cancer lymphatic mapping: institutional volume index. J Surg Res 2001; 97: 92-96.
21. KRAG D, WEAVER D, ASHIKAGA T, MOFFAT F, KLIMBERG VS, SHRIVER C, FELDMAN S, et al. The sentinel node in breast cancer – a multicenter validation study. N Engl J Med 1998; 339: 941-946.
22. XING Y, DING M, COX D, ROSS MI, HUNT KK, CORMIER JN, ANDERSON MD. ASCO 2004. Meta-analysis of sentinel lymph node biopsy following preoperative chemotherapy in patients with operable breast cancer.
23. VERONESI U, PAGANELLI G, GALIMBERTI V, VIALE G, ZURRIDA S, BEDONI M, COSTA A, et al. Sentinel node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph-nodes. Lancet 1997; 349: 1864-1867.
24. KERN KA. Sentinel lymph node mapping in breast cancer using subareolar injection of blue dye. J Am Coll Surg 1999; 189: 539- 545.
25. GORDON F, SCHWARTZ MBA, GIULIANO AE, MD, VERONESI U. The Consensus Conference Committee. Proceedings of the Consensus Conference on the Role of Sentinel Lymph Node Biopsy in Carcinoma of the Breast April 19-22, 2001, Philadelphia, PA, USA.
26. MCMASTERS KM, WONG SL, CHAO C, WOO C, EDWARDS MJ. Defining the optimal surgeon experience for breast cancer sentinel lymph node (SLN) biopsy. A model for implementation of new surgical technique. Ann Surg 2001; 234: 292-300.
27. ASHRAF NOUR. Efficacy of methylene blue dye in localization of sentinel lymph node in breast cancer patients. The Breast Journal, September 2004; 10, Issue 5, 388.
28. TORRES F. Tratamiento de las lesiones no palpables del seno. Rev Col Cir 2004; 19: 38-42.
Correspondencia:
JOSÉ JOAQUÍN CAICEDO, MD.
jocaiced@hotmail.com
Bogota, D.C., Colombia
