Hay dos reglas de oro para el tratamiento de la pancreatitis aguda, pensar en ella, para establecer el diagnóstico y, habiéndolo realizado, definir el factor desencadenante del episodio (27). La primera es de importancia inmediata en el momento del ingreso del paciente; una vez establecido el diagnóstico, las medidas de monitoreo y soporte del paciente pueden iniciarse; posteriormente deben realizarse los estudios tendientes a aclarar la etiología que inició el proceso de la enfermedad.
Una gran cantidad de posibles marcadores plasmáticos de la severidad de la pancreatitis han sido estudiados, pero sus procesos de evaluación no han sido lo suficientemente rigu-rosos para que permitan su aplicación de manera fácil y rutinaria en la práctica clínica; dentro de ellos los más estudiados se enumeran en la Tabla 1 (28).
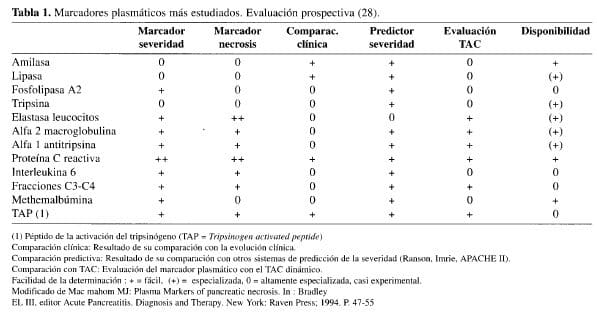
Con la excepción del informe de Buchler (29) y col, hay muy poca evidencia de que alguno de los marcadores plasmáticos citados, pueda compararse con la proteína C reactiva como marcador de severidad de la pancreatitis, principalmente en aquellos centros hospitalarios que no cuentan con el recurso de la tomografía axial computarizada.
Un nuevo test que consiste en la medición del péptido de la activación del tripsinógeno (TAP = tripsinogen activated peptide) parece ser promisorio en este sentido. Este péptido que resulta habitualmente de la activación intraduodenal del tripsinógeno por la enteroquinasa, normalmente se pierde en el contenido intestinal. Sin embargo, cuando hay activación intrapancreática, como ocurre en la pancreatitis aguda, este péptido se puede determinar en la sangre, líquido ascítico u orina. La medición del TAP en la orina durante las primeras 48 h de admisión, revela que tomando valores de 10 mmol/L como límite, se observó una sensibilidad de 100% con especificidad de 88% en la detección de pancreatitis seve-ras. Por otra parte, el valor predictivo negativo para pancrea-titis moderadas fue de 100% (30).
Valor de la tomografía axial computarizada (TAC) en la evaluación de la pancreatitis
En pancreatitis que no tienen claros signos de severidad, la TAC no está indicada, lo cual disminuye el costo del estudio. Si existen dudas en las primeras horas de evolución, hay indicación de realizarla y la severidad de las alteraciones del páncreas y tejidos vecinos observados en la TAC, tienen va-lor pronóstico (31) comparable según muchos autores a los criterios clínicos de Ranson y cols (Nomenclatura 3).

En las pancreatitis severas con notables alteraciones en la TAC, es importante determinar la magnitud de la necrosis pancreática. Para ello se usa la tomografía dinámica con inyección rápida de medio de contraste intravenoso. Esta técnica permite detectar áreas de necrosis e hipoperfusión que captan menos el medio de contraste o no lo captan (32).
La extensión de la necrosis pancreática guarda proporción con la morbilidad y la mortalidad; necrosis menores del 30% de la superficie del páncreas no tienen mortalidad y presentan una morbilidad de 40%; necrosis extensas, mayores de 50%, se asocian a una alta mortalidad y morbilidad (33). En 1987 Gersof (34) describió la punción y aspiración con aguja fina de las necrosis, dirigida por tomografía, con el fin de establecer la presencia de infección en estas áreas mediante coloración de Gram y cultivo del aspirado lo que ha servido para demostrar infección muy precozmente e iniciar terapia antibiótica (35). No es una técnica que necesariamente deba usarse en todos los casos de pancreatitis aguda, pero ciertamente es de utilidad en casos que muestran síntomas y signos de compromiso sistémico.
Valor de la colangiopancreatografía endoscópica retrógrada (CPER) y la papilotomía endoscópica, en el diagnóstico y tratamiento de la pancreatitis
La pancreatitis biliar puede ser originada por cálculos que provocan una obstrucción transitoria de la ampolla de Vater, y generalmente se asocia a microlitiasis, con cálculos de menos de 3 mm de diámetro (36). Hay poca duda sobre el empleo de la (CPER) en la pancreatitis biliar cuando la colangitis complica la pancreatitis aguda; el problema se presenta en los pacientes sin colangitis que son la mayoría de los casos de pancreatitis biliar.
Cetta (37) en un estudio en donde el 12% de los pacientes presentaban pancreatitis de origen biliar, encontró cuatro variables que predecían la presencia de cálculos en el co-lédoco: edad > de 55 años, bilirrubinas al ingreso > de 30 µmol/mL (1.7 mg/dL), colédoco dilatado (> 6 mm) a la ecografía, y sospecha ecográfica de cálculos en la vía biliar. La presencia de estos cuatro “predictores” mostró 94% de probabilidad de cálculos coledocianos, pero en la ausencia de todos los cuatro, la posibilidad de litiasis de la vía biliar era del orden de 18%. El ultrasonido abdominal puede mostrar el cálculo impactado en un conducto biliar dilatado; sin embargo, su sensibilidad para detectar los cálculos bi-liares asociados a pancreatitis es solamente del 60 al 70% (38).
ntes de que la (CPER) llegara a estar ampliamente disponible, los cirujanos éramos los responsables de tratar los pacientes con obstrucción biliar. Hace 10 años, la mayo-ría de los endoscopistas pensaban que la CPER se encontraba contraindicada en la fase aguda de la pancreatitis. En 1988, Neoptolemos señaló que la CPER temprana, con la descompresión y el retiro los cálculos biliares reducían la morbilidad pero no la mortalidad en los pacientes ancianos en quienes se predecía que una pancreatitis severa pudiese desarrollarse (39). La CPER no parecía empeorar la pancrea-titis subyacente, una preocupación que había limitado pre-viamente el uso de este procedimiento.
En 1993, Fan (40) realizó en Hong Kong un estudio prospectivo que incluía la CPER temprana (en un plazo de 24 horas después de la admisión) y la papilotomía, y las comparó con el tratamiento convencional en una serie de enfermos. En el grupo de pacientes que recibían el tratamiento endoscópico temprano, la morbilidad por sepsis biliar fue reducida notablemente, pero la mortalidad derivada de la pancreatitis no, y concluyeron que la descompresión endoscópica del ducto biliar beneficiaba a los pacientes seriamente enfermos con pancreatitis y colangitis. Desafortunadamente, estos datos fueron extrapolados sin análisis, y la CPER y la papilotomía endoscópica se han realizado y continúan realizándose en gran cantidad de pacientes con pancreatitis aguda que no la requieren (41-52). No hay evidencia de que la CPER y la papilotomía alteren el curso de la enfermedad en pacientes con pancreatitis biliar, pero sí mejoran las consecuencias derivadas de la sepsis biliar (39, 40).
Para indicar la papilotomía endoscópica en el curso de una pancreatitis biliar deben tenerse en cuenta los siguientes aspectos (37):
1. La pancreatitis biliar es una complicación que tiene una incidencia variable en pacientes con litiasis biliar, que no es determinada por el azar, sino que obedece a una serie de factores predisponentes; entre ellos, el tamaño, el tipo y consistencia de los cálculos, así como características que se podrían considerar particulares del individuo, presencia de canal pancreático accesorio, tamaño del conducto cístico y su inserción baja en las vecindades de la papila.
2. En pacientes con pancreatitis de origen biliar se puede sospechar la presencia de litiasis del colédoco en presencia de bilirrubina sérica en el momento del ingreso.
3. La colangitis supurativa es una indicación formal para realizar CPER y papilotomía endoscópica de urgencia, pero es raro encontrarla en pacientes jóvenes.
4. La esfinterotomía de rutina es innecesaria en pacientes con pancreatitis biliar sin obstrucción litiásica; no sólo es inútil sino peligrosa en el curso del tiempo.
Neoptolemos (53) define muy claramente las indicaciones de la colangiografia endoscópica retrógrada y de la papilotomía endoscópica en casos de pancreatitis aguda:
1. Colangiografia endoscópica para el diagnóstico de pancreatitis de origen biliar en casos severos con etiología incierta y duda de impactación de cálculo en el esfínter.
2. Papilotomía endoscópica
2.1. Para el manejo de cálculos impactados en el coledoco en la pancreatitis severa
2.2. Para la extracción de cálculos coledocianos en casos de pancreatitis aguda persistente.
Finalmente, Folsch (54) en un estudio multicéntrico aleatorio que reunió 238 pacientes con pancreatitis aguda sin signos de obstrucción biliar, de los cuales a 126 se les practicó colangiopancreatografías dentro de las siguientes 72 horas, la cual fue exitosa en el 96% de los casos, se encontraron cálculos en el colédoco en 56 de tales pacientes, que fueron extraídos de manera satisfactoria. En el grupo de 112 pacientes que se trató conservativamente, la colagiopancreatografía se realizó en 22 casos por aparición de colangitis, persistencia y aumento de la hiperbilirrubinemia o presencia de dolor abdominal. En 13 de ellos encontraron cálculos en el colédoco que se retiraron. En el grupo con CPER temprana se presentaron 14 muertes, 10 atribuibles a la pancreatitis; en el grupo de tratamiento conservativo hubo 7 muertes, 4 atribuibles al proceso de pancreatitis aguda; estos datos no tienen significancia estadística.
El autor concluye que en el grupo de pacientes con pancrea-titis biliar pero sin signos de obstrucción biliar, no hay evidencia que sugiera que la CPER temprana tenga un efecto benéfico sobre el curso de la pancreatitis aguda.
Tratamiento de la Pancreatitis
Aproximadamente el 75% de los pacientes con pancreatitis aguda evolucionan favorablemente a la rehidratación endovenosa, con uso de analgésicos y supresión de la vía oral. Esta última recomendación basada en el principio unánimemente aceptado del beneficio del reposo del páncreas. El curso de estas pancreatitis leves es habitualmente benigno, son más frecuentes en casos de alcohólicos con pancreatitis crónica recurrente, y en ellos no se ha observado beneficio de la intubación y aspiración nasogástrica.
En el 25% restante con pancreatitis aguda severa es necesario usar la mayor suspicacia clínica para identificarlos precozmente puesto que harán un curso tormentoso y entre ellos el riesgo de complicaciones y mortalidad es mayor. En estos pacientes es necesario identificar lo más tempranamente la presencia de complicaciones sistémicas y lo más prudente es trasladarlos a la Unidad de Cuidados Intensivos para maximizar los recursos terapéuticos.
Medidas recomendadas
A. Reemplazo agresivo del volumen circulante con soluciones hidroelectrolíticas según lo indiquen las pérdidas por diuresis, vómitos o diarrea. En ocasiones, y depen-diendo de la severidad del proceso, es conveniente moni-torizar con medidas invasoras tipo catéter de Swan-Ganz, para evitar la sobrecarga. No hay indicación de usar rutinariamente plasma, soluciones coloidales y/o transfusiones de glóbulos rojos, las que estarían determinadas por circunstancias individuales, especialmente cuando hay hemorragia digestiva.
B. Es importante aliviar el dolor, para lo cual es a menudo necesario administrar derivados opiáceos a pesar de la posibilidad que estos compuestos puedan aumentar mo-deradamente la presión del esfínter de Oddi.
C. La intubación nasogástrica parece ser especialmente útil cuando los pacientes presentan vómitos, sangrado digestivo alto o distensión abdominal.
D. Las complicaciones pulmonares son la causa principal de la muerte en el plazo de los primeros 7 días de la pancreatitis aguda. La capacidad deteriorada de la difusión de oxígeno, la elasticidad pulmonar disminuida, la resistencia de la vía aérea creciente y la capacidad vital disminuida, son las anormalidades comunes de la fisio-logía respiratoria. Todos los pacientes con pancreatitis severa deben recibir oxígeno suplementario y vigilar cuidadosamente la saturación arterial de oxígeno. La intubación endotraqueal y la ventilación con presión po-sitiva al final de la espiración (PEEP), se requieren frente al deterioro progresivo de la ventilación. Aun en las pancreatitis leves el aporte de oxígeno por cánula o máscara de Venturi es importante, son pacientes con diferentes grados de hipoperfusión y con consumo de oxígeno aumentado.
E. Aunque su utilidad es debatida, el empleo de antibióticos aparece predominantemente en el listado de medicamentos ordenados para el tratamiento de la pancreatitis aguda. Es bien conocido que el 80% de las muertes por pancreatitis aguda se debe a la infección, que se incrementa en la medida en que el porcentaje de tejido pancreático necrótico aumenta, generada por microorganismos de tipo entérico por translocación bacteriana (23). Por lo tanto al indicar el antibiótico se deben tener en cuenta varios aspectos:
a) Espectro que cubra la flora entérica, principalmente del grupo coliforme solo o asociado con otras entero-bacterias, del género Klebsiella, Pseudomona, Enterococo y Bacteroide
b) Penetración del antibiótico en el páncreas; en este aspecto la liposolubilidad parece ser de fundamental importancia para el paso a través de la estructura lipídica de la membrana celular. Dentro de estos aparecen con mejor liposolubilidad las fluoroqui-nolonas, el cefoxitín (55), la clindamicina (56), el metronidazol (57) y el imipenem (58). Los aminoglu-cósidos llegan al fluido pancreático en concentraciones adecuadas luego de 6 a 8 horas de administrados (55).
c) Penetración del antibiótico en el tejido necrótico de la pancreatitis aguda; en este aspecto el metronidazol, la pefloxacina y el imipenem aparecen como los antibióticos que mejor penetran en el tejido necrótico del páncreas (59).
d) Soporte nutricional: El déficit alimentario aparece en estos pacientes con ayuno prolongado durante el episodio de pancreatitis aguda. Aunque no está indicado rutinariamente en pacientes con pancreatitis aguda leve, en el grupo de pacientes con enfermedad severa, la nutrición parenteral total mejora el equili-brio del nitrógeno y la respuesta inmunológica del paciente.
Medidas discutibles
a) Los bloqueadores H2 de la histamina se usan rutinariamente en la mayoría de los centros en pacientes en condiciones de estrés fisiológico, como profilaxis de la hemorragia digestiva por lesiones agudas de la mucosa gástrica. La efectividad de esta medida no es aceptada uniformemente ya que rara vez se obtiene una franca anacidez con las dosis usadas; es preferible compartir la conducta de profesionales en cuidado intensivo de admi-nistrar profilaxis con antiácidos (sucralfato) para prevenir el reflujo ácido al árbol bronquial.
b) No se ha demostrado ninguna utilidad significativa con el uso de glucagón, corticoides, inhibidores de las proteasas, 5-fluorouracil, somatostatina o su análogo el octreótido, cuando su eficacia ha sido sometida a estudios controlados aleatoriamente, de tal manera que su uso sistemático no es racional; es más, se ha debatido en muchos foros que el empleo de estos dos últimos puede aumentar la hipoperfusión de un páncreas de por sí ya hipoperfundido.
c) La diálisis peritoneal inicialmente pareció ser una medida de utilidad pero estudios aleatorios posteriores no parecieron confirmar su efectividad (60). Sin embargo, según Ranson y col, la diálisis prolongada por 7 días, puede ser efectiva en casos de pancreatitis severa (61), lo que necesita ser confirmado por estudios con una población mayor de pacientes.
Papel de la cirugía
A la luz del conocimiento actual y de la universalización de la medicina, el paciente con pancreatitis aguda requiere para su tratamiento un equipo multidisciplinario, en el que participen el especialista en cuidado intensivo, un gastroenterólogo intervencionista, el grupo de soporte nutricional, el infectólogo y el cirujano. La decisión quirúrgica se debe tomar luego de un análisis concienzudo de este equipo, cuando no hay respuesta a la terapia médica y hay evidencias claras de infección o deterioro progresivo del paciente a pesar de las medidas de soporte adecuado
La intervención se encuentra orientada al tipo de complicación infecciosa de la pancreatitis aguda ya definida ante-riormente, absceso pancreático o necrosis pancreática, que son dos entidades completamente diferentes, concepto en el que ya hemos insistido con anterioridad (12, 27). Es factible drenar un absceso pancreático por laparoscopia, pero no es posible que mediante este procedimiento se logre la evacua-ción adecuada de una necrosis pancreática; fundamentalmente a este tipo de complicación de la pancreatitis haremos referencia a continuación.
Se acepta universalmente que existen cuatro indicaciones absolutas para la intervención quirúrgica en la pancreatitis necronizante:
- Si se encuentra asociada a falla multiorgánica
- Si es una necrosis extensa
- Si se encuentra infectada
- Si se encuentra asociada a patología biliar.
Surge la inquietud de si deben intervenir las necrosis pancreáticas estériles; en el pasado esa pudo ser la conducta u posiblemente muchas de las pancreatitis nmecróticas que intervenimos hace unos años se encontraban en este estado; posteriormente, una serie de estudios retrospectivos sugirieron que algunos casos con necrosis estériles se beneficiaron del manejo conservativo(62, 63) y con el recurso de la aspiración de la necrosis mediante punción dirigida por tomografía para definir si se encuentran o no infectadas(34), actualmente se puede contemporizar con estos pacientes, siempre y cuando no cursen con falla multiorgánica. Beger(63) recomienda intervenir las pancreatitis necróticas estériles cuando el paciente se encuentre en shock, con masa abdominal plapable por más de 8 días o cuando presente falla orgánica persistente a pesar del soporte adecuado ne la UCI.
Por el contrario, no existe ninguna duda en intervenir un paciente con una pancreatitis necrótica infectada; el procedimiento que se debe seguir ya se ha depurado, se han abandonado las pancretectomías totales que en algún momento se propusieron, se mantienen con resultados similares la técnica del lavado del fondo de saco menor propuesta por Beger(63) y aplciada por Larvin(64) mediante una necrosectomía inicial y colocación de catéteres para irrigación-drenaje continuo y la laparostomía con empaquetamiento propuesta por Bradley(65), los dos procedimientos con mortalidades que oscilan entre 15 y 25%.
El abceso pancreático se puede considerar una complciación de la pancreatitis aguda; sus características ya fueron definidas en la “Clasificación de Atlanta” y la moralidad derivada de esta complicación es sensiblemente menor que la de la necrosis infectada. Su tratamiento oscila entre el drenaje percutáneo dirigido por tomografía, con control periódico mediante la realización de abscesografías(66) o mediante el drenaje quirúrgico abierto marsupializando la colección a través del fondo de saco menor(67).
Protocolo de Manejo de la Pancreatitis Aguda
En gracia de discusión y sin visos dogmáticos, se propone el siguiente protocolo para el manejo de la pancreatitis aguda.
Todo paciente con el diagnóstico presuntivo de pancreatitis aguda debe ser visto conjuntamente por el cirujano general y el gastroenterólogo. Una vez se ocmprueba el diagnóstico y de acuerdo con la severidad del caso, Ranson mayor de 3 o APACHE II mayor de 8, el paciente debe continuar su tratamiento en la Unidad de Cuidaod Intensivo con el siguiente régimen:
Supresión de la vía oral; si hay vómito, colocación de sonda nasogástrica
Reemplazo agresivo del volumen circulante con soluciones hidroelectrolíticas para mantener un adecuado volumen urinario, mayor de 50 mL/kilo/hora.
Oxígeno por máscara o cánula nasal.
Antibioticoterapia profiláctica en pancreatitis clasificadas por tomografía como Balthazar C o mayor. O pacientes con más de tres criterios de Ranson o más de ocho en el APACHE II. De acuerdo con lo anotado previamente, podría iniciarse un esuqema con metronidazol o clindamicina más un aminoglucósido, dejando como segunda línea las quinolonas y el imipenem-cilastina.
Nutrición parenteral, la cual al tiempo que provee el soporte necesario, evita la estimulación de la secreción pancreática.
El diagnóstico de pancreatitis aguda obedece a los criterios de la nueva “Clasificación de Atlanta” (1992).
El diagnóstico de pancreatitis biliar se establece por los siguientes criterios: edad mayor de 55 años, bilirrubinas al ingreso mayores de 30 m mol/mL (1.7 mg/dL), colédoco dilatado (>6 mm) a la ecografía, y sospecha o demostración ecográfica de cálculos en la vía biliar(37).
Si se cuenta con el recurso de la TAC, ésta debe realizarse una vez se haya comprobado el episodio de pancreatitis aguda con el fin de evaluar la existencia y extensión de la necrosis y definir el tratamiento ulterior.
La colangiografía endoscópica estaría indicada para el diagnóstico de pancreatiitis de origen biliar en casos severos con duda de impactación de cálculo e el esfínter de Oddi.
En casos de colangitis supurativa hay indicación formal de papilotomía endoscoópica de urgencia.
Si los Hallazgos endoscópicos son confirmatorios de pancreatitis biliar aguda, s eprocede con la esfinterotomía endoscópica y la extracción de cálculos retenidos en el colédoco.
Si se demuestra un cálculo impactado en la ampolla de Vater y lso rpocedimientos endoscópicos son fallidos, es necesario intentar la intervención quirúrgica. El rpocedimiento biliar y lograr la extracción de los cálculos con la menor agresividad quirúrgica. Puede intentarse inicialmente la colecistectomía y coledocotomía con exploración biliar con canastilla de Dormia o catéteres de Fogarty. La esfinteropalstia transduodenal debe reservarse como último recurso.
En la pancreatitis d eorigen alcohólico u ocasionadas por otros factaroes etiológicos diferentes a la litiasis biliar, es prudente el tratamiento médico, expectante, sin intentar de entrada los rpocedimientos definidos para la pancreatitis de origen biliar. El paciente se tratará en la unidad de cuidado intensivo si los criterios de Ranson o APACHE II inhdican una pancreatitis severa, empleando todos los soportes que sean requeridos, sin intentar el tratamiento quirúrgico hasta tanto se prseenten las indicaciones d ecirugía que se han definido anteriormente.
La operación recomendada en la pancreatitis necrótica es la resección del tejido compromedtido, drenando los espacios afectados con el fin de prevenir la reacumulación; esto puede realizarse mediante la laparostomía y empaquetamiento para lavados postoperatorios o mediante la colocación de drenes para irrigación continua y drenaje consecutivo; las resecciones pancreáticas empleadas hace tiempo prseentan una mortalidad prohibitiva. En casos de abceso pancreático, la intervención má ssegura es la marsupialización o laparostomía; en los ocasionales casos en que se presenta erosión de laguno de los vasos que rodean la celda pancreática, si la hemorragia no es masiva y exsanguinante, el paso inicial para su control es la embolización del vaso mediante radiología intervencionista.
Abstract
We have reviewed our experience with acute pancreatitis with emphasis on the necrotizing type; the cellular and chemical pathophysiology was analyzed according to the “Atlanta classification”, clinical presentation and evolution, complications and severity according to Ranson and APACHE II criteria, together with the different serum markers, CT findings, and ERCP and papillotomy, discussing the different therapeutic modalities, incluiding antibiotic therapy and surgery.
Referencias
1. Brook JR: Historical development and epidemiology. In: Brooks JR, Editor. Surgery of the pancreas. Philadelphia: W.B. Saun-ders Company; 1983. p. 25
2. Steer ML, Meldolesi J: The cell biology of experimental pancreatitis. N Eng J Med 1987; 316: 144-50
3. Figarella C, Amouric M, Guy Crotte O: Enzyme activation and liberation: intracellular and extracellular events. In: Beger HG, Buchler M, editors. Acute pancreatitis: research and clinical management. Berlin: Springer-Verlag; 1987. p. 53-60
4. Kloppel G, Dreyer T, Willemer S, Kern HF, Adler G: Human acute pancreatitis: its pathogenesis in the light of immunocytochemical and ultrastructural findings in acinar cells. Virchows Arch 1986; 409: 791-803
5. Quon M, Wisner JR, Chandrasoma P, Valenzuela JE: Chronic ethanol comsumption intensifies caerulein-induced pancreatitis in the rat. Inter J Pancreatol 1992; 12: 31-9
6. Havel RJ: Pathogenesis, differentiation and management of hypertriglicerdemic. Adv Med Int 1969; 15: 117 – 20
7. Goodhead B: Acute pancreatitis and pancreatic blood flow. Surg Gynecol Obstet 1969; 129: 331-40
8. Sanfey H, Bulkley GB, Cameron JL: The role of oxygen free radicals in the pathogenesis of acute pancreatitis Ann Surg 1984; 200: 405-13
9. Banerjee AK, Steele RJC: Current views on the pathophysiology of acute biliary pancreatitis. Gut 1995; 36: 803-5
10. García F, Méndez CG, Arteta DS: Pancrea-titis aguda en el Hospital Universitario de Cartagena. Estudio de 224 casos, 1976 – 1989. Rev Col Gastroenterol. 1991: 6 (3): 163- 71
11. Reyes R, Gómez M: Pancreatitis aguda, revisión de 48 casos de 1968 a 1973. Temas Escogidos de Gastroenterología 1975; 18: 185 – 95
12. Nieto JA, Castelblanco J, Pimiento H: Pancreatitis aguda. Casuística del Hospital Militar Central de Bogotá. Rev Colomb Cir 1989; 4 (2): 102 – 10
13. Acosta JL, Ledesma CL: Gallstones migration as a cause for acute pancreatitis. N Engl J Med 1974; 190: 484 – 7
14. Robinson TM, Dumphy JE: Continuous perfusion of bile protease activators trhough the pancreas. JAMA 1963; 183: 530 – 5
15. McCutcheon Ad: Reflux of duodenal contents in the pathogenesis of pancreatitis. Gut 1964; 5: 260 – 5
16. Cavuoti PO, Moody FG, Martínez G: Role of pancreatic duct occlusion with prolamine (Ethibloc) in necrotizing pancreatitis. Surgery 1988; 103: 261 – 6
17. Senninger N, Moody FG, Van Buren DH, Coelho JCU, Li YF: Effect of biliary obstrucction on pancreatic exocrine in cons-cious opossum. Surg Forum 1984; 35: 226-8
18. Steer ML: Pathophysiology and pathogenesis of acute pancreatitis. In: Bradley EL III editor, Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Press; 1994: 3-11
19. Steinberg W, Tenner S: Acute pancreatitis. N Eng J Med 1994; 330: 1198-1210
20. Bradley EL III: A clinically based classification system for acute pancreatitis: summary of the international symposium on acute pancreatitis, Atlanta 1992. Arch Surg 1993; 128: 586-90
21. Frey CF : Pathogenesis of nitrogen retention in pancreatitis. Am J Surg 1965; 109: 474-9
22. Nath BJ, Warshaw Al: Pulmonary insuficiency. In: Bradley EL, editor. Complica-tions of pancreatitis. Medical and surgical management. 1st. ed. Philadelphia: W.B. Saunders; 1982. p. 51-71
23. Moody FG, Haley D, Muncy, DM: Intestinal transit and bacterial translocation in obstructive pancreatitis. Dig Dis Sci 1995; 40: 1798 – 804
24. Beger HG, Rau B, Mayer J, Pralle U: Natural course of acute pancreatitis. World J Surg 1997 Feb; 21(2): 130-5
25. Ranson JHC, Pasternack BS: Statistical methods for quantifying the severity of clinical pancreatitis. J Surg Res 1977; 22: 79-91
26. Wilson C, Heath DI, Imrie CW: Prediction of outcome in acute pancreatitis : a comparative study of APACHE II, clinical assessment and multiple factor scoring systems. Br J Surg 1990; 19: 849-61
27. Nieto JA: Pancreatitis aguda. Cirugía y Hospital Schering Plough 1992; 1: 17-20
28. Mac Mahon MJ: Plasma Markers of pancreatic necrosis. In : Bradley EL III, editor. Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Press; 1994. p. 47-55
29. Buchler M, Malfertheiner P, Schoetensack C, et al: Sensitive of antiproteases, complement factors and C-reactive protein in detecting pancreatic necrosis: results of a prospective clinical study. Int J Pancreatol 1986; 1: 227-35
30. Tenner S, Fernández del Castillo C, Warshaw AL, Steingerg, Hermon-Taylor J, Valenzuela JE, Hariri M, Banks PA.: Urinary trypsinogen activation peptide (TAP) predicts severity in acute pancreatitis. Gastroenterology 1995; 108: 395-8
31. Balthazar EJ: CT diagnosis and staging of acute pancreatitis. Radiol Clin North Am 1989; 27: 19-37
32. Kivisaari L, Somer K, Standetskjold-nordenstam C-G, Schroder T, Kivilaakso E, Lempinen M: Early detection of acute fulminant pancreatitis by contrast-enhanced computed tomography. Scan J Gastro-enterol 1983; 18: 39-41
33. Balthazar EJ: Contrast-Enhanced Compu-ted Tomography in severe acute pancreatitis. In : Bradley EL III, editor. Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Pres; 1994. p. 57-68
34. Gersof S, Banks PA, Robbins AH, et al: Early diagnosis of pancreatic infection by computed tomography-guided aspiration. Gastroenterology 1987; 93: 1315-20
35. Banks PA, Gerzof SG, Chong FK, Worthington MC, Doss WG, Sullivan JG, Johnson WS: Bacteriologic status of necrotic tissue in necrotizing pancreatitis. Pan-creas 1990; 5: 330-3
36. Cetta F: Gallstone Pancreatitis, Associated Cholangitis, Clinical Predictors of Persis-tent Common Duct Stones, and ERCP or Endoscopic Sphincterotomy. Am J Gastro-enterol 1998; 93: 493-6
37. Cetta F, Lombardo F, Giubbolini M, et al: Age is a major risk factor specific for brown, but not for black or cholesterol gallstones. Gastroenterology 1995; 108: 9
38. Neoptolemos JP, Hall AW, Finlay DF, Berry JM, Carr-Locke DL, Fossard DP. The urgent diagnosis of gallstones in acute pancreatitis: a prospective study of three methods. Br J Surg 1984; 71: 230-3
39. Neoptolemos JP, Carr-Locke DL, London NJ, Bailey IA, James D, Fossard DP: Controlled trial of urgent endoscopic retrograde cholangiopancreatography and endoscopic sphincterotomy versus conservative treatment for acute pancreatitis due to gallstones. Lancet 1988; 2: 979-83
40. Fan ST, Lai ECS, Mok FPT, et al: Early treatment of acute biliary pancreatitis by endoscopic papilotomy. N Engl J Med 1993; 328: 228-32
41. Barkun AN, Barkun JS, Fried GM, et al: Useful predictors of bile duct stones in patients undergoing laparoscopic cholecystectomy. Ann Surg 1994; 220: 32-9
42. Leitman IM, Fisher MI, McKinley MJ, et al: The evaluation and management of known or suspected stones of the common bile duct in the era of minimal access surgery. Surg Gynecol Obstet 1993; 176: 527-33
43. Cotton PB: Is your sphincterotomy really safe and necessary?. Gastrointest Endosc 1996; 44: 752-5
44. May GR, Cotton PB, Edmunds EJ, et al: Removal of stones from the bile duct at ERCP without sphincterotomy. Gastrointest Endosc 1993; 396: 749-51
45. MacMathuna P, White P, Clarke F, et al: Endoscopic balloon sphincteroplasty (papillary dilatation) for bile duct stones: efficacy, safety, and follow-up in 100 patients. Gastrointest Endosc 1995; 42: 468-74
46. Esber EJ, Sherman S: The interface of endoscopic retrograde cholangiopancreatography and laparoscopic cholecystectomy. Gastrointest Endosc Clin North Am 1996; 6: 57-80
47. Petelin JB: Laparoscopic approach to common duct pathology. Surg Laparosc Endosc 1991; 1: 33-41
48. Phillips EH, Carroll BJ, Pearlstein AR, et al: Laparoscopic choledochoscopy and extraction of common bile duct stones. World J Surg 1993; 17: 22-8
49. Phillips EH: Laparoscopic transcystic duct common bile duct exploration: Outcome and costs. Surg Endosc 1995; 9: 1240-2
50. Lezoche E, Paganini AM: Single-stage treatment of gallstones and common bile duct stones in 120 unselected, consecutive patients. Surg Endosc 1995; 9: 1070-5
51. Flowers JL: ERCP versus laparoscopic surgery: The contest over common bile duct stones. Endoscopy 1996; 28: 438-40
52. Bergman JJGHM, Van der Mey S, Rauws EAJ, et al: Long-term follow-up after endoscopic sphincterotomy for bile duct stones in patients younger than 60 years of age. Gastrointest Endosc 1996; 44: 643-9
53. Neoptolemos JP: Endoscopic retrograde cholangiopancreatography in necrotizing pancreatitis. In: Bradley EL III, editor. Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Pres; 1994. p. 69-76
54. Folsch U, Nitsche R, Ludtke R, Hilgers R, et al: Should Patients with Biliary Pancrea-titis Undergo Early ERCP?. N Engl J Med 1997; 336: 237-42
55. Tyden G, Malmorg AS: Penetration of antibiotics into pancreatic juice. Lancet 1985; 1: 1046-7
56. Hershey SD, Sugawa C, Cushing R, et al: The value of prophylactic antibiotic theraphy during endoscopic retrograde cholangiopancreatography. Surg Gynecol Obstet 1982; 155: 801-3
57. Wallace JR, Johnson J, Lucas CE: Assess-ment of pancreatic ductal penetration of antibiotics. Am J Surg 1984; 50: 66-7
58. Brastrom C, Malmborg AS, Tyden G Penetration of imipenem in human pancreatic juice following single intravenous administration. Chemotherapy 1989; 35: 83-7
59. Bassi C, Pederzoli P: Antibiotics in necrotizing pancreatitis. In: Bradley EL III, editor. Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Pres; 1994. p. 93-9
60. Mayer AD, McMahon MJ, Corfield AP et al: Controlled clinical trial of peritoneal lavage for the treatment of severe acute pancreatitis. N Eng J Med 1985; 312-399-404.
61. Ranson JHC, Berman RS: Long peritoneal lavage decreases pancreatic sepsis in acute pancreatitis. Ann Surg 1990; 211: 708-16
62. Neoptolemus JP, Hall AW, Finlay DF, Berry JM, Carr-Locke DL, Fossard DP. The urgent diagnosis of gallstones in acute pancreatitis: a prospective study of three methods. Br J Surg 1984; 71: 230-3
63. Beger HG, BüchlerM, Bittner R: Necrosectomy and postoperative local lavage in patients with necrotizing pancreatitis. World J Surg 1988; 12: 255-62
64. Larvin M, Chalmers AG, Robinson PJ: Debridment and closed cavity irrigation for the treatment of pancreatic necrosis. Br J Surg 1989; 76: 465-71
65. Bradley EL III: Management of infected pancreatic necrosis by open drainage. Ann Surg 1987; 206; 542-50
66. Van Sonnenberg E: Percutaneous therapy for pancreatic abscess. In: Bradley EL III, editor. Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Pres; 1994. p. 161-4
67. Frey CF: Surgical management of pancreatic abscess. In: Bradley EL III, editor. Acute Pancreatitis. Diagnosis and Therapy. New York: Raven Pres; 1994. p. 165-71.
Correspondencia: Doctor Julio Alberto Nieto Silva. Dirección Científica Clínica Nueva. Diag. 45 N° 16B-11. Santafé de Bogotá, D.C.

